HD-BioP3 細(xì)胞電轉(zhuǎn)染條件的優(yōu)化
王亞萍,宋路萍,邢體坤,李靜波,張靜靜(通信作者)
河南晟明生物技術(shù)研究院有限公司 (河南新鄉(xiāng) 453500)
電轉(zhuǎn)染主要通過(guò)物理電流擊穿細(xì)胞膜形成瞬時(shí)孔隙,目的基因通過(guò)孔隙進(jìn)入細(xì)胞[1],這種方法具有操作簡(jiǎn)便、毒性小、電轉(zhuǎn)染效率較高等優(yōu)點(diǎn),其轉(zhuǎn)染效率通常在30%~90%之間[2-4]。電轉(zhuǎn)染在克隆操作以及表達(dá)中具有重要作用,因此,提升基因電轉(zhuǎn)染效率是當(dāng)前基因工作研究人員關(guān)注的重點(diǎn)問(wèn)題[5]。電轉(zhuǎn)染效率受很多因素的影響,包括電轉(zhuǎn)染緩沖液[6-8]、電轉(zhuǎn)染程序[9-11]、細(xì)胞數(shù)量[12]、電轉(zhuǎn)染質(zhì)粒量[13-15]、電轉(zhuǎn)染前后溫度[16]等。不同的細(xì)胞系有不同的最佳電轉(zhuǎn)染條件[17]。哺乳動(dòng)物細(xì)胞的電轉(zhuǎn)染通常在磷酸鹽緩沖液(phosphate buffered saline,PBS)、PBS+蔗糖或培養(yǎng)基中進(jìn)行[18-19]。本研究分析電轉(zhuǎn)染緩沖液、電轉(zhuǎn)染溫度和電轉(zhuǎn)染質(zhì)粒量3 個(gè)因素對(duì)細(xì)胞活率及電轉(zhuǎn)染效率的影響,從而確定HD-BioP3 細(xì)胞的最佳電轉(zhuǎn)染條件。
1 材料與儀器
1.1 材料
HD-BioP3 細(xì)胞購(gòu)自Horizon 公司;GFP 質(zhì)粒購(gòu)自Lonza 公司;EX-CELL?CD CHO Fusion 培養(yǎng)基、L-Glutamine solution、蔗糖購(gòu)自默克公司;CD Forti CHOTM培養(yǎng)基、PBS 購(gòu)自賽默飛世爾科技公司;0.2%臺(tái)盼藍(lán)溶液購(gòu)自Countstar 公司。
1.2 儀器
電穿孔系統(tǒng)(品牌:Bio-Rad 伯樂(lè),型號(hào):Gene Pulser Xcell,用于轉(zhuǎn)染每種細(xì)胞類(lèi)型的模塊化電穿孔系統(tǒng));疊加式恒溫振蕩器(品牌:精騏,型號(hào):IS-RDS6C,帶CO2);二氧化碳培養(yǎng)箱(品牌:Heal Force,型號(hào):HF90);潔凈工作臺(tái)(品牌:蘇凈安泰,型號(hào):SW-CJ-2FD);電熱恒溫水浴鍋(品牌:上海一恒,型號(hào):HWS-28);全自動(dòng)熒光細(xì)胞分析儀(品牌:Countstar,型號(hào):Rigel S2);離心機(jī)(品牌:Eppendorf,型號(hào):5804R)。
2 實(shí)驗(yàn)方法
2.1 HD-BioP3細(xì)胞電轉(zhuǎn)染優(yōu)化前準(zhǔn)備
37 ℃水浴復(fù)蘇一支HD-BioP3 細(xì)胞,待細(xì)胞生長(zhǎng)至1.5×106~4.0×106cells/ml 時(shí),按0.2×106cells/ml 接種至生長(zhǎng)培養(yǎng)基(含4 mmol/L L-Glutamine solution的CD Forti CHOTM培養(yǎng)基)中;電轉(zhuǎn)染前一天將細(xì)胞以0.5×106cells/ml 接種至生長(zhǎng)培養(yǎng)基中培養(yǎng)(培養(yǎng)條件:轉(zhuǎn)速為120 rpm,二氧化碳濃度為5%,溫度為37 ℃,振幅為26 mm),24 h 后用于電轉(zhuǎn)染優(yōu)化。
2.2 HD-BioP3細(xì)胞電轉(zhuǎn)染優(yōu)化
2.2.1 HD-BioP3細(xì)胞電轉(zhuǎn)染緩沖液和電轉(zhuǎn)染溫度優(yōu)化
準(zhǔn)備PBS、PBS+5%蔗糖、EX-CELL?CD CHO Fusion 培養(yǎng)基、CD Forti CHOTM培養(yǎng)基4 種介質(zhì)作為電轉(zhuǎn)染緩沖液并分別標(biāo)記為Buffer1~Buffer4 備用;取2.1 中準(zhǔn)備的細(xì)胞,將0.2%臺(tái)盼藍(lán)溶液與細(xì)胞懸液按照1‥1 比例混合,采用全自動(dòng)熒光細(xì)胞分析儀對(duì)細(xì)胞進(jìn)行計(jì)數(shù);根據(jù)計(jì)數(shù)結(jié)果取5×106個(gè)細(xì)胞,以220 rcf 速度離心5 min,棄上清液;取電轉(zhuǎn)染緩沖液 600 μl 重懸細(xì)胞,再加入20 μg GFP 質(zhì)粒,輕輕吹打混勻細(xì)胞和質(zhì)粒轉(zhuǎn)入電擊杯,按上述步驟,Buffer1~Buffer4 各做兩組,一組于常溫條件下進(jìn)行電擊,另一組于4 ℃條件下放置5 min 后進(jìn)行電擊。電擊參數(shù)設(shè)置如下,電壓為300 V,電容為950 μF,脈沖為指數(shù)衰減,將電擊后的細(xì)胞迅速轉(zhuǎn)至含預(yù)熱后的5 ml 生長(zhǎng)培養(yǎng)基的T25 方瓶中,溫度為37 ℃,二氧化碳濃度為5%,濕化過(guò)夜培養(yǎng)。
2.2.2 HD-BioP3細(xì)胞電轉(zhuǎn)染質(zhì)粒量?jī)?yōu)化
根據(jù)2.2.1 選擇合適的電轉(zhuǎn)染緩沖液和電轉(zhuǎn)染溫度,在10~100 μg 之間設(shè)置10 個(gè)梯度的電轉(zhuǎn)染質(zhì)粒量進(jìn)行最佳電轉(zhuǎn)染質(zhì)粒量的優(yōu)化,電擊參數(shù)設(shè)置如下,電壓為300 V,電容為950 μF,脈沖為指數(shù)衰減,將電擊后的細(xì)胞迅速轉(zhuǎn)到含預(yù)熱后的5 ml 生長(zhǎng)培養(yǎng)基的T25 方瓶中,溫度為37 ℃,二氧化碳濃度為5%,濕化過(guò)夜培養(yǎng)。
2.3 分析方法
HD-BioP3 細(xì)胞電轉(zhuǎn)染優(yōu)化24 h 后,用0.2%臺(tái)盼藍(lán)溶液與細(xì)胞懸液按照1‥1 比例混合,采用全自動(dòng)熒光細(xì)胞分析儀對(duì)細(xì)胞進(jìn)行電轉(zhuǎn)染效率檢測(cè)及計(jì)數(shù)。
3 結(jié)果分析
3.1 HD-BioP3細(xì)胞電轉(zhuǎn)染緩沖液和電轉(zhuǎn)染溫度優(yōu)化結(jié)果分析
電轉(zhuǎn)染效率檢測(cè)結(jié)果顯示,在常溫條件下Buffer1~Buffer4的細(xì)胞電轉(zhuǎn)染效率依次為8.4%、18.8%、48.8%、22.4%,在4 ℃條件下Buffer1~Buffer4 的細(xì)胞電轉(zhuǎn)染效率依次為20.9%、25.2%、67.3%、15.7%;Buffer1 在常溫和4 ℃條件下的細(xì)胞電轉(zhuǎn)染效率相差12.5%,依次類(lèi)推,Buffer1~Buffer4 在常溫和4 ℃條件下的細(xì)胞電轉(zhuǎn)染效率相差在6.4%~18.5%之間;在同一溫度下,4 種電轉(zhuǎn)緩沖液的電轉(zhuǎn)染效率差距較大,在常溫條件下,Buffer2 和Buffer4 的細(xì)胞電轉(zhuǎn)染效率相差3.6%,而B(niǎo)uffer3 和Buffer1 的細(xì)胞電轉(zhuǎn)染效率相差40.4%,因此在常溫條件下細(xì)胞電轉(zhuǎn)染效率相差3.6%~40.4%,依此類(lèi)推,在4 ℃條件下細(xì)胞電轉(zhuǎn)染效率相差4.3%~51.6%(圖1~4)。

圖1 在常溫條件下HD-BioP3細(xì)胞電轉(zhuǎn)染24 h 后電轉(zhuǎn)染效率

圖2 在4 ℃條件下HD-BioP3細(xì)胞電轉(zhuǎn)染24 h 后電轉(zhuǎn)染效率
HD-BioP3 細(xì)胞電轉(zhuǎn)染優(yōu)化24 h 后,結(jié)果顯示,在常溫條件下,Buffer1 和Buffer3 細(xì)胞活率均>80%,Buffer4 細(xì)胞活率<60%(圖3);在4 ℃條件下Buffer3 細(xì)胞活率>80%,Buffer1 和Buffer4 細(xì)胞活率<60%(圖4)。

圖3 常溫條件下HD-BioP3細(xì)胞在電轉(zhuǎn)緩沖液Buffer1~Buffer4中細(xì)胞活率和電轉(zhuǎn)染效率
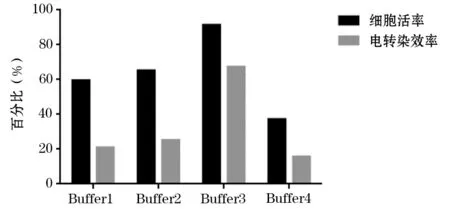
圖4 在4 ℃條件下HD-BioP3細(xì)胞在電轉(zhuǎn)緩沖液Buffer1~Buffer4中細(xì)胞活率和電轉(zhuǎn)染效率
3.2 HD-BioP3細(xì)胞電轉(zhuǎn)染質(zhì)粒量測(cè)試
根據(jù)3.1 選擇細(xì)胞轉(zhuǎn)染效率和細(xì)胞活率均最高的實(shí)驗(yàn)條件,即選擇Buffer3 作為電轉(zhuǎn)染緩沖液在4 ℃條件下進(jìn)行電轉(zhuǎn)染質(zhì)粒量?jī)?yōu)化,結(jié)果顯示,隨著電轉(zhuǎn)染質(zhì)粒量的增加,細(xì)胞活率呈逐漸下降,10~30 μg 電轉(zhuǎn)染質(zhì)粒量細(xì)胞活率>70%,40~70 μg 電轉(zhuǎn)染質(zhì)粒量細(xì)胞活率在60%~65%之間,80~100 μg 電轉(zhuǎn)染質(zhì)粒量細(xì)胞活率均<50%。隨著電轉(zhuǎn)染質(zhì)粒量的增加,電轉(zhuǎn)染效率逐漸升高;電轉(zhuǎn)染質(zhì)粒量為30 μg 時(shí)電轉(zhuǎn)染效率達(dá)到平臺(tái)期,電轉(zhuǎn)染質(zhì)粒量>70 μg 時(shí)電轉(zhuǎn)染效率出現(xiàn)下降趨勢(shì),電轉(zhuǎn)染質(zhì)粒量不同造成電轉(zhuǎn)染效率最大相差24.6%(圖5~7)。

圖5 HD-BioP3細(xì)胞電轉(zhuǎn)染24 h 后電轉(zhuǎn)染效率

圖6 HD-BioP3細(xì)胞電轉(zhuǎn)染24 h 后電轉(zhuǎn)染效率
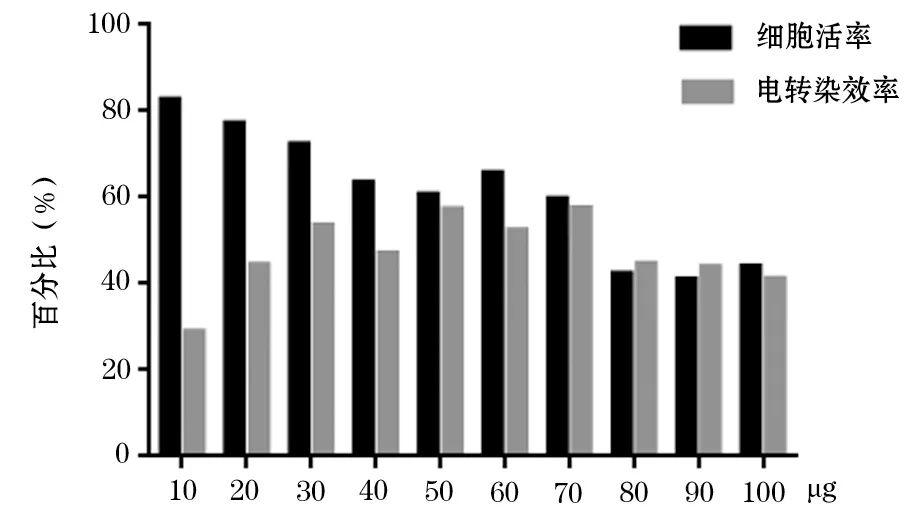
圖7 HD-BioP3細(xì)胞不同電轉(zhuǎn)染質(zhì)粒量細(xì)胞活率和電轉(zhuǎn)染效率
4 討論
電轉(zhuǎn)染是一種常用的細(xì)胞轉(zhuǎn)染方法[20],目的基因能否進(jìn)行表達(dá),取決于表達(dá)目的基因能否成功進(jìn)入細(xì)胞[21];這種電轉(zhuǎn)染方式雖然操作簡(jiǎn)單,電轉(zhuǎn)染效率高,但不合適的電轉(zhuǎn)染條件容易導(dǎo)致細(xì)胞無(wú)法形成電穿孔或死亡,造成電轉(zhuǎn)染效率下降[22]。
本研究結(jié)果顯示,在測(cè)試3 個(gè)因素對(duì)電轉(zhuǎn)效率的影響實(shí)驗(yàn)中,不同電轉(zhuǎn)染緩沖液對(duì)電轉(zhuǎn)染效率影響最大相差51.6%,其次為不同電轉(zhuǎn)染質(zhì)粒量,電轉(zhuǎn)質(zhì)粒量對(duì)電轉(zhuǎn)染效率影響最大相差24.6%,電轉(zhuǎn)染溫度影響較小,不同電轉(zhuǎn)染溫度對(duì)電轉(zhuǎn)染效率影響最大相差18.5%。故在EX-CELL?CD CHO Fusion 作為電轉(zhuǎn)染緩沖液、電轉(zhuǎn)染溫度為4 ℃、電轉(zhuǎn)染質(zhì)粒量為30 μg 的條件下,電轉(zhuǎn)染效果最好。
綜上所述,優(yōu)化HD-BioP3 細(xì)胞的電轉(zhuǎn)染條件,可為研究外源基因電轉(zhuǎn)染HD-BioP3 細(xì)胞提供基礎(chǔ)數(shù)據(jù)。

