黑木耳液體發酵條件優化研究
馬銀鵬 姜 威 張丕奇 戴肖東 周舒揚 馬慶芳 劉佳寧 田 爽 朱加楠 張介馳 王天亮
(1黑龍江省科學院微生物研究所,黑龍江哈爾濱 150010;2黑龍江省科學院,黑龍江哈爾濱 150001)
黑木耳Auricularia heimuer是一種重要的食藥用真菌[1],不僅營養豐富,還含有多糖、黑色素、腺苷等活性成分[2-4],具有止咳化痰、抗氧化、降血脂、抗輻射等功效[5-6]。據中國食用菌協會統計,黑木耳2021 年總產量712.3 萬t,已成為我國第二大栽培食用菌。液體菌種的研究和使用促進黑木耳產業迅速發展。傳統的固體菌種存在生產周期長、菌齡不整齊、成本高、污染率高等問題[7]。而液體菌種具有生產周期短、菌齡一致、成本低、發菌快且不易污染等優點,是解決固體菌種不足的有效途徑之一[8]。因此,食用菌液體菌種的研究逐漸受到重視。
由于菌種特性、培養條件及其優化方法等因素的差異,不同菌株的液體發酵條件差別較大[9]。范秀芝等[10]從22 個國審黑木耳品種中篩選出一株較優的液體發酵高產菌株。王謙等[11]研究發現黑木耳液體發酵的最佳條件為接種量8%,培養基初始pH 5.0,培養溫度28 ℃,搖床轉速160 r/min。錢雪晴等[12]優化得到黑木耳液體菌種培養基配方:葡萄糖2.16%,牛肉粉0.48%,馬鈴薯15%,磷酸二氫鉀0.33%,硫酸鎂0.1%。因此,不同黑木耳菌株需要分別開展液體發酵條件的優化研究,從而獲得特定菌株的最佳液體發酵條件。
筆者以黑木耳1703為試驗菌株,以菌絲體生物量為評價指標,采用單因素和正交試驗優化液體發酵條件,為黑木耳液體菌種的生產應用提供參考。
1 材料與方法
1.1 試驗材料
(1)供試菌株:黑木耳1703菌株,由黑龍江省科學院微生物研究所保藏和提供。
(2)供試培養基:黑木耳菌種活化采用PDA 培養基(土豆200 g/L,葡萄糖20 g/L,蛋白胨3 g/L,磷酸二氫鉀2 g/L,硫酸鎂0.5 g/L,瓊脂粉18 g/L,pH 自然)。液體菌種培養采用PD 培養基(土豆200 g/L,葡萄糖20 g/L,蛋白胨3 g/L,磷酸二氫鉀2 g/L,硫酸鎂0.5 g/L,維生素B10.001 g/L,pH自然)。
1.2 試驗方法
1.2.1 菌株活化
將黑木耳1703菌株轉接到PDA固體培養基中,28 ℃恒溫避光培養10 d活化菌株。
1.2.2 液體菌種培養
用直徑1.0 cm的打孔器取相同菌齡活化菌株,接種(5塊菌種)于含有100 mL PD培養基的250 mL三角瓶中,25 ℃、160 r/min培養7 d,用于液體發酵接種。
1.2.3 菌絲體生物量測定
液體發酵結束后過濾收集菌絲體,無菌水沖洗3次,80 ℃烘干至恒重,稱量菌絲體干重即為菌絲體生物量。
1.2.4 液體發酵條件單因素篩選試驗
1.2.4.1 供試碳源的篩選試驗
以PD 培養基為基礎培養基,分別加入20 g/L 供試碳源果糖、麥芽糖、蔗糖、可溶性淀粉、葡萄糖,以碳源零添加為空白對照。接種5%液體菌種于含有100 mL 培養基的250 mL 三角瓶中,置于25 ℃、160 r/min 搖床培養7 d。以1.2.3 方法收集、烘干、稱量菌絲體。
1.2.4.2 供試氮源的篩選試驗
以PD 培養基為基礎培養基,分別加入5 g/L 供試碳源麩皮、(NH4)2SO4、豆粉、蛋白胨、酵母浸粉,以氮源零添加為空白對照,置于25 ℃、160 r/min 搖床培養7 d。菌絲體收集、烘干、稱量同1.2.3。
1.2.4.3 接種量的篩選試驗
液體菌種接種量分別為3%、5%、8%、10%、13%,置于25 ℃、160 r/min 搖床培養7 d。菌絲體收集、烘干、稱量同1.2.3。
1.2.4.4 培養基初始pH的篩選試驗
PD培養基的初始pH分別調整為5、6、7、8、9,置于25 ℃、160 r/min 搖床培養7 d。菌絲體收集、烘干、稱量同1.2.3。
1.2.4.5 搖床轉速的篩選試驗
搖床轉速分別設置為130 r/min、140 r/min、150 r/min、160 r/min、170 r/min,置于25 ℃、搖床培養7 d。菌絲體收集、烘干、稱量同1.2.3。
1.2.5 正交試驗設計
在單因素試驗基礎上,選取葡萄糖(A)、蛋白胨(B)、培養基初始pH(C)三個因素,設3 因素3 水平L9(33)正交試驗(表1)。以菌絲生物量為評價指標,通過極差分析法分析最佳液體發酵條件。進行三次驗證試驗,驗證正交試驗結果的有效性。

表1 正交試驗因素和水平
1.3 數據統計分析
所有試驗均三次重復,數據以平均值±標準差形式呈現。采用SPSS 17 進行數據統計分析,采用單因素方差分析方法進行顯著性分析。
2 結果與分析
2.1 單因素試驗結果
2.1.1 供試碳源的篩選結果
由圖1可知,當碳源為葡萄糖或可溶性淀粉時,黑木耳(1703)菌絲體生物量最高,分別為0.537 g/100 mL、0.509 g/100 mL。單因素方差分析發現,葡萄糖、可溶性淀粉為碳源時與其他碳源的菌絲體生物量差異顯著(P<0.05)。綜合考慮成本的因素,黑木耳液體發酵培養基以葡萄糖為最佳碳源。
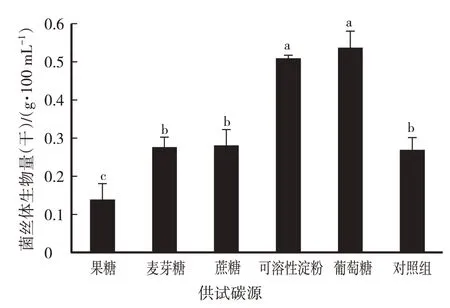
圖1 碳源試驗黑木耳(1703)菌絲體生物量比較
2.1.2 供試氮源的篩選結果
由圖2可知,當氮源為蛋白胨時,黑木耳(1703)菌絲體生物量最高,為0.520 g/100 mL。單因素方差分析結果,蛋白胨為氮源時與酵母浸粉、尿素的菌絲體生物量差異顯著(P<0.05);與硫酸銨、麩皮、對照組的菌絲體生物量差異不顯著(P>0.05)。因此,黑木耳液體培養的最佳氮源為蛋白胨。

圖2 氮源試驗黑木耳(1703)菌絲體生物量比較
2.1.3 接種量的篩選結果
由圖3 可以看出,隨著接種量的增加,黑木耳(1703)菌絲體生物量呈先升高后下降的趨勢。當接種量為8% 時,菌絲體生物量最高,為0.446 g/100 mL。單因素方差分析結果,接種量為8%與3%的菌絲體生物量差異顯著(P<0.05);與其他接種量的菌絲體生物量差異不顯著(P>0.05)。因此,液體培養黑木耳菌絲體的最佳接種量為8%。
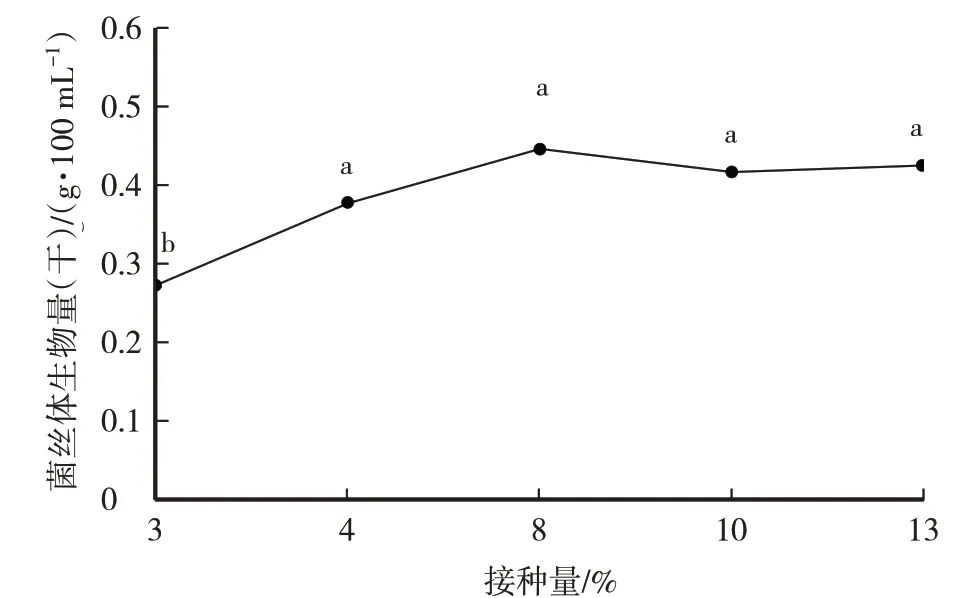
圖3 接種量試驗黑木耳(1703)菌絲體生物量比較
2.1.4 培養基初始pH篩選結果
由圖4 可以看出,隨著培養基初始pH 的上升,黑木耳(1703)菌絲體生物量呈先升高后降低的趨勢。當培養基初始pH 為6 時,菌絲體生物量最高,為0.467 g/100 mL。單因素方差分析結果,培養基初始pH為6時與培養基初始pH為8、pH為9的菌絲體生物量差異顯著(P<0.05);與培養基初始pH 為5、pH 為7 的菌絲體生物量差異不顯著(P>0.05)。因此,黑木耳菌絲體發酵培養的培養基最佳初始pH為6。

圖4 培養基初始pH試驗黑木耳(1703)菌絲體生物量比較
2.1.5 搖床轉速篩選結果
由圖5 可知,隨著搖床轉速的加快,黑木耳(1703)菌絲體生物量呈先升高后下降的趨勢。當搖床轉速為150 r/min 時,菌絲體生物量最高,為0.462 g/100 mL。因此,黑木耳菌絲體發酵培養搖床最佳轉速為150 r/min。

圖5 搖床轉速試驗黑木耳(1703)菌絲體生物量比較
2.2 正交試驗結果
正交試驗和極差分析結果如表2 所示,根據極差分析結果可知,對黑木耳(1703)菌絲體生物量的影響次序為A>C>B,即葡萄糖>培養基初始pH>蛋白胨,其中葡萄糖對菌絲體生物量影響最大。各因素的最優組合為A2B2C2,即葡萄糖20 g/L,蛋白胨3 g/L,培養基初始pH為6,菌絲體生物量最高。

表2 正交試驗和極差分析結果
正交試驗方差分析結果如表3所示,葡萄糖、蛋白胨、培養基初始pH 均對黑木耳(1703)菌絲體生物量影響顯著(P<0.05)。三個因素對菌絲體生物量影響次序為A>C>B,即葡萄糖>培養基初始pH>蛋白胨。方差分析結果與極差分析結果一致。

表3 正交試驗方差分析結果
因此,黑木耳(1703)菌株液體發酵最佳條件為葡萄糖20 g/L,蛋白胨3 g/L,培養基初始pH 為6,接種量8%,搖床轉速150 r/min。在此條件下重復三次,菌絲體生物量(干)為(0.542±0.103)g/100 mL,高于正交試驗各組的菌絲體生物量,因此,該試驗設計方法可靠有效。
3 小結與討論
研究結果表明,黑木耳1703菌株液體發酵最佳條件為葡萄糖20 g/L,蛋白胨3 g/L,培養基初始pH為6,接種量8%,搖床轉速150 r/min。
碳源和氮源是影響液體發酵菌絲體生物量的主要因素。試驗結果表明黑木耳(1703)液體發酵培養基最佳碳源為葡萄糖,與肖彩霞[13]的研究結果一致,但是荊瑞勇等[14]研究發現黑木耳液體發酵最佳碳源為果糖。試驗結果表明黑木耳液體發酵培養基最佳氮源為蛋白胨,與馮小飛等[15]的研究結果一致,但是于海洋等[16]研究發現黑木耳液體發酵培養基最佳氮源為酵母浸膏,謝意珍等[17]研究結果最佳氮源為麩皮。這可能與選用的黑木耳菌株有關。因此,對不同的黑木耳菌株液體發酵條件進行篩選,以優化獲得最佳的碳源、氮源。
結果表明,黑木耳(1703)液體發酵的最佳接種量為8%,培養基初始pH 為6,搖床轉速為150 r/min。王晨等[18]研究發現黑木耳再生株Aa66液體培養適宜接種量為8%,與筆者研究結果一致。錢雪婷[19]采用響應面法優化秦巴山區黑木耳菌株耳261 的液體發酵pH 為5.85,與筆者研究培養基初始pH基本一致。
黑木耳液體發酵過程中會產生多種活性物質,如多糖、多肽、酶、核酸、氨基酸、維生素等,因此利用液體發酵技術獲得代謝產物并研究其活性具有較好的發展前景[20]。試驗所得黑木耳(1703)液體發酵條件僅是搖瓶培養結果,后續還需發酵罐放大試驗進一步驗證。

