具有泌酸腺分化的胃腫瘤7例臨床病理特征
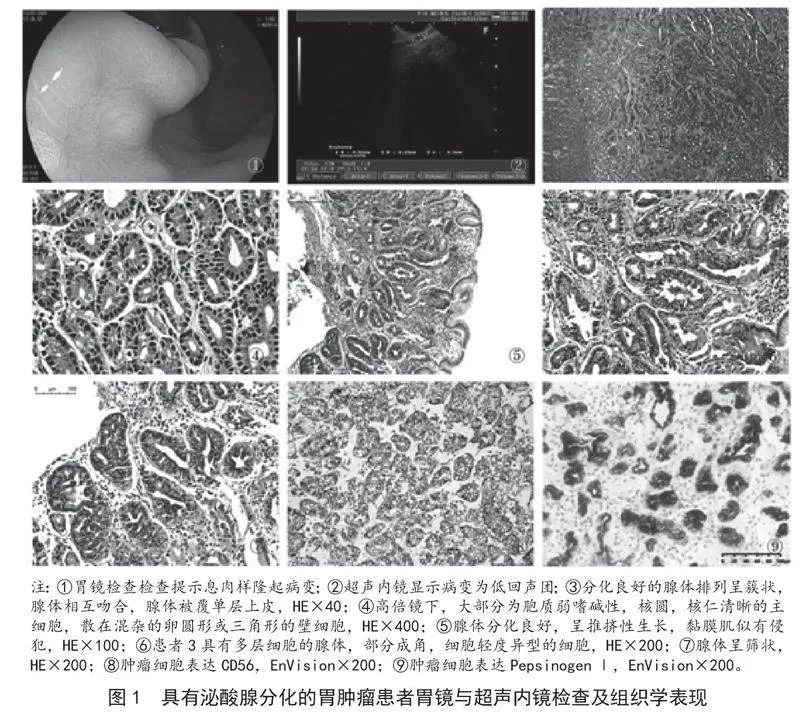
【摘要】" 目的" 具有泌酸腺分化的胃腫瘤分為泌酸腺腺瘤及胃底腺腺胃癌,報告具有泌酸腺分化的胃腫瘤臨床病理特征的病例。方法" 回顧性分析2018年1月- 2022年12月醫院診斷為泌酸腺腺瘤的7例患者的臨床資料、內鏡特征、病理形態、免疫表型及隨訪資料。結果" 7例患者中,女性6例,男性1例,平均年齡49歲,1例患者服用了抑酸藥。所有的病變均位于胃中部,其中6例為息肉樣突起,內鏡超聲顯示低回聲腫塊。形態學上,由主細胞為主的細胞形成分化良好的腺體。免疫組化表達Pepsinogen1、MUC6、Syn和CD56。結論" 胃底型腺癌近年來引起了一些關注,特別是早期癌,時常被漏診,泌酸腺腺瘤形態與胃底腺腺癌相似但不伴有黏膜肌侵犯,后者是一種非常罕見且預后良好的腫瘤。
【關鍵詞】" 泌酸腺腺瘤;胃底腺腺癌;胃腫瘤;主細胞
中圖分類號" R735.2" " 文獻標識碼" A" " 文章編號" 1671-0223(2023)14--03
Clinicopathological features of gastric tumors with fundic gland type: A series of 7 cases Zhou Bin, Zheng Qiaoli. Department of Pathology, Zhuhai People’s Hospital, Zhuhai 519000, China
【Abstract】" Objective" Gastric tumors with fundic gland type have been variably called adenocarcinoma of fundic gland type and oxyntic gland polyp/adenoma. Herein, we present a series of 7 cases that show a morphological spectrum of gastric tumors with fundic gland type. Methods" The clinical data of 7 patients were selected for retrospective analysis. The clinical data, gastroscopy, histopathology, HP infection, and follow-up situation were analyzed.Results" Among the 7 patients, there were 6 females and 1 male, with an average age of 49 years old. PPIs were used in 1 case. All the lesions were located in the fundus, of which 6 cases were polypoid" lesions and endoscopic ultrasound showed hypoechoic masses. Morphologically, the predominant chief form well-differentiated glands. Pepsinogen1, MUC6, Syn and CD56 were expressed by immunohistochemistry. Conclusion Gastric fundus adenocarcinoma and OGP show a morphological continuum,the latter is similar in shape to the former but without invading mucosal muscle and with a good prognosis.
【Key words】" "Oxyntic gland adenoma; Gastric adenocarcinoma; Gastric neoplasms; Chief cells
胃底腺型腺癌及泌酸腺腺瘤是新近提出的伴有泌酸腺分化的胃腫瘤。最新的WHO藍皮書將前者作為胃腺癌的一個罕見的組織學亞型,而將后者定義為良性腫瘤,經常會進展為胃底腺型腺癌[1]。本文對7例具有泌酸腺分化的胃腫瘤臨床病理學特征進行分析,旨在加深對該類疾病的認識。
1" 病例來源
分析病例為2019年1月-2022年12月醫院收治的具有泌酸腺分化的7例胃腫瘤患者,3例患者行內鏡下黏膜剝離術(ESD)切除,其中1例在切除前行超聲內鏡檢查,1例患者行超聲內鏡檢查并行內鏡下黏膜切除術(EMR),其余3例為活檢組織。每個病例由3位病理醫師進行雙盲診斷,評估內容包括主細胞和壁細胞的構成比例、組織結構、細胞異型性、病變深度、促結締組織反應及周圍胃黏膜是否伴有萎縮,組織結構包括分化良好的腺體呈簇狀/實性、腺體相互吻合呈條索狀、擴張的腺體、具有多層細胞的復雜腺體及篩狀結構。
2" 臨床特征
患者年齡36~62歲,平均年齡49歲,中位年齡45歲;女6例,男1例;5例位于胃底,2例位于胃體。胃鏡檢查6例呈息肉樣(圖1①),1例呈隆起型;病變范圍直徑3~12mm;2例超聲內鏡檢查顯示均質低回聲團,邊界尚清(圖1②);7例中有2例有用藥史,1例患者有長期質子泵抑制劑(PPI)治療,1例患者中藥對癥治療,具體名稱不詳,3例沒有使用任何藥物,其余3例不詳。
低倍鏡下,所有病例被覆正常小凹上皮,病變組織位于固有層,與周圍腺體界限清楚,5例由分化良好的腺體排列呈簇狀,腺體相互吻合,部分腺體擴張,腺體被覆單層上皮(圖1③),2例中可見具有多層細胞的復雜腺體,成角或呈篩狀(圖1⑥~⑦),高倍鏡下,大部分為胞質弱嗜堿性,核圓,核仁清晰的主細胞,散在混雜的卵圓形或三角形的壁細胞,胞質嗜酸性(圖1④),5例細胞無異型性,2例具有多層細胞復雜腺體的細胞具有輕度異型,7例均無明顯的促結締組織反應,周圍胃黏膜無萎縮及腸上皮化生。兩例標本診斷具有爭議,1例EMR標本腺體分化良好,呈推擠性生長,黏膜肌似有侵犯(圖1⑤),1例活檢標本,病變位于固有層,腺體成角及篩狀,具有多層輕度異型的細胞(圖1⑦),這2例傾向泌酸腺腺瘤,備注需鑒別胃底腺型腺癌,1例活檢標本,因為活檢組織較少,無法判斷有無黏膜下層浸潤,考慮為泌酸腺腫瘤,建議定期隨訪,其余5例腺體分化良好,無黏膜肌侵犯,均診斷為泌酸腺腺瘤,所以病例周圍胃黏膜均無萎縮或腸上皮化生,無淋巴管或靜脈侵犯,ESD或EMR標本無側緣或基底切緣侵犯。
腫瘤細胞表達黏蛋白MUC6及PepsinogenⅠ(圖1⑨),部分病例表達Syn、CD56(圖1⑧),所有病例僅散在表達CgA,小凹上皮表達黏蛋白MUC5AC,Ki-67陽性指數1%~5%。
3" 隨訪
所有患者均可獲得臨床隨訪信息,隨訪時間34~54個月,其中1例患者6個月后胃底不同位置出現再發,均無疾病進展或轉移。
4" 討論
泌酸腺腺瘤的命名現在還是存在爭議,在2019年出版的WHO消化系統腫瘤分類中保留了泌酸腺腺瘤的診斷,目前為止,國內文獻中僅孫瑋瑋等[2]在報道胃底腺型腺癌中提及2例,并備注此類腫瘤較為少見,診斷上有分歧,部分參考書命名為胃底腺型腺癌,部分參考書命名為泌酸腺腺瘤,總體此病預后較好。
2007年Tsukamoto等[3]提出了具有泌酸腺分化的胃腫瘤,將其作為胃腺癌的一個少見亞型。不久后,Ueyama等[4]提出建議將該類腫瘤作為胃腺癌的一個新的亞型,并且命名為胃底腺型胃腺癌,因為發現腫瘤細胞除了主細胞為主型外,還有頸黏液細胞為主型的相關病例報告[5],該文獻報道的作者同時提出將病變限于固有層的腫瘤命名為泌酸腺腺瘤/息肉。Lewin等[6]鑒于該種腫瘤具有浸潤生長的潛能,仍舊提議將其分類為超高分化的腺癌。國外對于該類型的病例陸續報道,不同的作者建議不同的命名,Chan等[7]建議命名為主細胞為主型的胃息肉,Yamada等[8]則將胃底腺型腺癌與泌酸腺腺瘤統稱為具有泌酸腺分化的胃腫瘤,截至目前,該腫瘤報道例數還相對較少,對其臨床病理的評估仍存在爭議。
泌酸腺腺瘤被覆正常小凹上皮,病變位于固有層,與周圍腺體界限清楚,大部分由分化良好的腺體排列呈簇狀,腺體相互吻合,部分腺體擴張,腺體被覆單層上皮,偶見具有多層細胞的復雜腺體,成角或呈篩狀,大部分為胞質弱嗜堿性,核圓,核仁清晰的主細胞,散在混雜的卵圓形或三角形的壁細胞,胞質嗜酸性,細胞無或輕度異型,病變限于黏膜肌內。胃底腺型腺癌的細胞類似泌酸腺腺瘤,異型性不明顯,但腺體有明確結構異型,伴有促纖維結締組織增生,浸潤黏膜肌。免疫組化病變區表達MUC6,小凹上皮表達MUC5AC,3例病變弱表達Syn及CD56,散在ECL分化的細胞表達CgA,Ki-67增殖指數低,平均2%。組織結構特征及免疫組化結果可能會導致沒有經驗的病理醫生誤診為神經內分泌腫瘤,有學者提到CgA是前腸神經內分泌腫瘤特異性標記,有學者也提出Syn和CD56不是前腸部位神經內分泌分化腫瘤的特異性標記[9],前腸部位CgA表達缺失可以排除神經內分泌腫瘤,很多文獻推薦使用PepsinogenⅠ標記,因為pepsinogen 1僅由胃底腺中的主細胞和黏液頸部細胞產生[10],如果陽性可以排除神經內分泌腫瘤、幽門腺腺瘤及深在性囊性胃炎。
所有文獻報道的病例經過長期隨訪均無復發及轉移,本研究病例中有1例6個月后在胃底的不同位置再發,其余病例均無復發及轉移,具有泌酸腺分化的胃腫瘤的發病機制目前還不清楚,Chan等[7]指出大部分患者發生在抑酸治療(PPI或H2受體拮抗劑)后,本研究有1例患者有長期抑酸治療史。截至目前,該腫瘤報道例數還相對較少,對其生物學行為、臨床病理及預后的準確評估需要進一步積累資料及深入探討。
5" 參考文獻
[1] Yao T,Vieth M,Carneiro F,et al.Tumours of the stomach.Oxyntic gland adenoma and Gastricadenocarcinoma of fundic-gland type[M]//Lokuhetty D,White VA,Watanabe R,et al.WHO classification of digestive system tumours.5th edn.Lyon:IARC Press,2019:83-92.
[2] 孫瑋瑋,張黎,顧敏敏,等.胃底腺型腺癌六例臨床病理學特征[J].中華病理志,2020,49(4):343-347.
[3] Tsukamoto T,Yokoi T,Maruta S,et al.Gastric adenocarcinoma with chief celldifferentiation[J].Pathol Int,2007,57:517-522 .
[4] Ueyama H,Yao T,Nakashima Y,et al.Gastric adenocarcinoma of fundic gland type(chief cell predominant type):Proposal for a new entity of gastricadenocarcinoma[J].Am J Surg Pathol,2010,34:609-619.
[5] Singhi AD,Lazenby AJ,Montgomery EA.Gastric adenocarcinoma with chief cell differentiation:A proposal for reclassification as oxyntic gland polyp/adenoma[J].Am J Surg Pathol,2012,36(7):1030-1035.
[6] Lewin E,Daroca P,Sikka S,et al.Gastric adenocarcinoma of the fundic gland type treated by endoscopic mucosal resection:A Case Report and Review of the Literature[J].Case Rep Pathol,2016,2016:8646927.
[7] Chan K,Brown IS,Kyle T,et al.Chief cell-predominant gastric polyps:A series of 12 cases with literature review[J].Histopathology,2016,68(6):825-833.
[8] Yamada S,Yamanoi K,Sato Y,et al.Diffuse MIST1 expression and decreased αGlcNAc glycosylation on MUC6are distinct hallmark for gastric neoplasms exhibiting oxyntic gland differentiation[J].Histopathology,2020,77(3):413-422.
[9] Lloyd RV.Practical markers used in the diagnosis of neuroendocrine tumors[J].Endocr Pathol,2003,14:293-301.
[10] Samloff IM,Liebman WM.Cellular localization of the group Ⅱ pepsinogens in human stomach and duodenum by immunofluorescence[J].Gastroenterology,1973,65:36-42.
[2023-04-18收稿]

