利用蛋白支架復合物提高大腸桿菌MG1655的L-蘋果酸產量
周志東,王曉瑜,張 同,李 琪,楊之帆,陳 俊
(1. 武漢科技大學化學與化工學院,湖北 武漢,430081;2. 湖北大學省部共建生物催化與酶工程國家重點實驗室,湖北 武漢,430062)
蘋果酸是一種四碳二羧酸,被廣泛用于食品、化工、醫藥和農業領域[1],常用的生產方法有化學合成法、固定化酶催化法及發酵法等。化學合成法是將苯或丁烷在高溫高壓下氧化后再利用馬來酸的水合作用產生D-蘋果酸和L-蘋果酸外消旋混合物[2],其中L-蘋果酸存在于從細菌到人類的所有生物體中,而D-蘋果酸在自然界中很少見且難以被人體吸收利用,故被禁止添加至嬰幼兒及老年人食品中。酶催化法是利用固定化的富馬酸酶或表達富馬酸酶的全細胞,以富馬酸為底物催化產生L-蘋果酸[3],使用該法雖可獲得單一的L-蘋果酸,但富馬酸酶的純化成本較高,另外,產物L-蘋果酸與反應殘留的底物富馬酸較難分離,所得L-蘋果酸純度不高。近年來,利用基因工程菌發酵已成為獲取L-蘋果酸的重要途徑[4]。將來自解甘露醇羅爾斯頓菌的磷酸烯醇式丙酮酸(PEP)羧激酶導入pta突變型的大腸桿菌菌株WGS-10,經12 h好氧發酵后,所得L-蘋果酸產量可達9.25 g/L[5]。除此之外,利用蘋果酸酶催化丙酮酸也可以生成蘋果酸。不過,丙酮酸是多種代謝途徑的關鍵底物,將其轉化為蘋果酸并非易事。Dong等[6]通過敲除大腸桿菌W3110的ldhA、poxB、pflB、pta及ackA等基因來阻斷丙酮酸的旁路消耗,再輔以蘋果酸酶的過表達,所得蘋果酸產量達到21.7 g/L。本課題組[7]敲除大腸桿菌MG1655的poxB、pta-ackA、ldhA、pflB、maeA、maeB以及pfkA等基因后,將所得工程菌株搖瓶發酵48 h,相應L-蘋果酸產量達到9.893 g/L。利用基因敲除或過表達構建多基因的從頭合成途徑時,常面臨中間產物的快速擴散和降解、對宿主細胞的毒害以及底物利用率低等問題,最終導致目標產物產量降低[8]。已有研究表明,通過模仿自然代謝控制機制,將途徑酶共定位,在空間上形成多酶復合體,提高代謝物的局部濃度,在多酶復合體內形成底物通道,能減少底物在不同活性位點間的擴散距離,將代謝通量引向目標通路從而提高目標產物的得率[9-13]。Dueber等[14]直接截取后生動物信號傳導蛋白相互作用域并融合表達后構建了一種(GBD)x-(SH3)y-(PDZ)z蛋白支架體系,通過優化蛋白支架中配體的比例、順序以及酶的化學計量數,將最終產物滴度提高了77倍。Liu等[15]利用纖維素小體,將3種NAD+依賴性的脫氫酶于酵母表面組裝來實現多酶級聯反應,以甲醇作為底物所得NADH的最終產率達到了組裝前相應值的5.1倍。Ji等[16]利用相互作用的蛋白PDZ和PDZ ligand將黃岑素和野黃岑素合成途徑中的兩個關鍵途徑酶進行自組裝,目標產物最終滴度分別提高了6.6和1.4倍。有鑒于此,本文選取遺傳背景清楚且易于進行分子操作的大腸桿菌MG1655,借助RIAD-RIDD人工蛋白支架,將L-蘋果酸生成途徑關鍵酶Pykf和maeB進行共定位以形成酶復合體,再通過丙酮酸的積累來實現maeB的逆向催化,進而提高L-蘋果酸的產量。
1 材料與方法
1.1 菌株、質粒、引物及儀器和試劑
大腸桿菌 DH5α、大腸桿菌 MG1655(DE3)和大腸桿菌 BL21(DE3)購于武漢力博瑞生物科技有限公司,載有熒光報告蛋白的支架片段以及N端或C端帶有支架蛋白標簽的目的基因片段由武漢金開瑞生物工程有限公司合成,質粒載體pET-23a和PRSFDuet-1為本實驗室保存,構建載體所用引物均由生工生物工程(上海)股份有限公司合成。本研究所用菌株、質粒以及引物分別列于表1及表2,所用主要儀器有:Bio-Rad C1000型PCR儀,Sigma 1-14K型高速冷凍離心機,D-30M型高壓細胞破碎儀,C006169(5 ml)和C006197(20 ml)重力型蛋白純化空柱,Milipore超濾管,P680型高效液相色譜儀;主要試劑有:牛血清白蛋白,購自武漢天源生物技術有限公司,PIPES,購自北京鼎國昌盛生物技術有限責任公司,卡那霉素、壯觀霉素,購自合肥博美生物科技有限責任公司,DNA Marker、質粒小提試劑盒、膠回收試劑盒、2×ESTaqMaster Mix,均購自南京諾唯贊生物科技股份有限公司,有機酸標準樣品,購自Sigma公司,其它試劑均為國產分析純試劑。
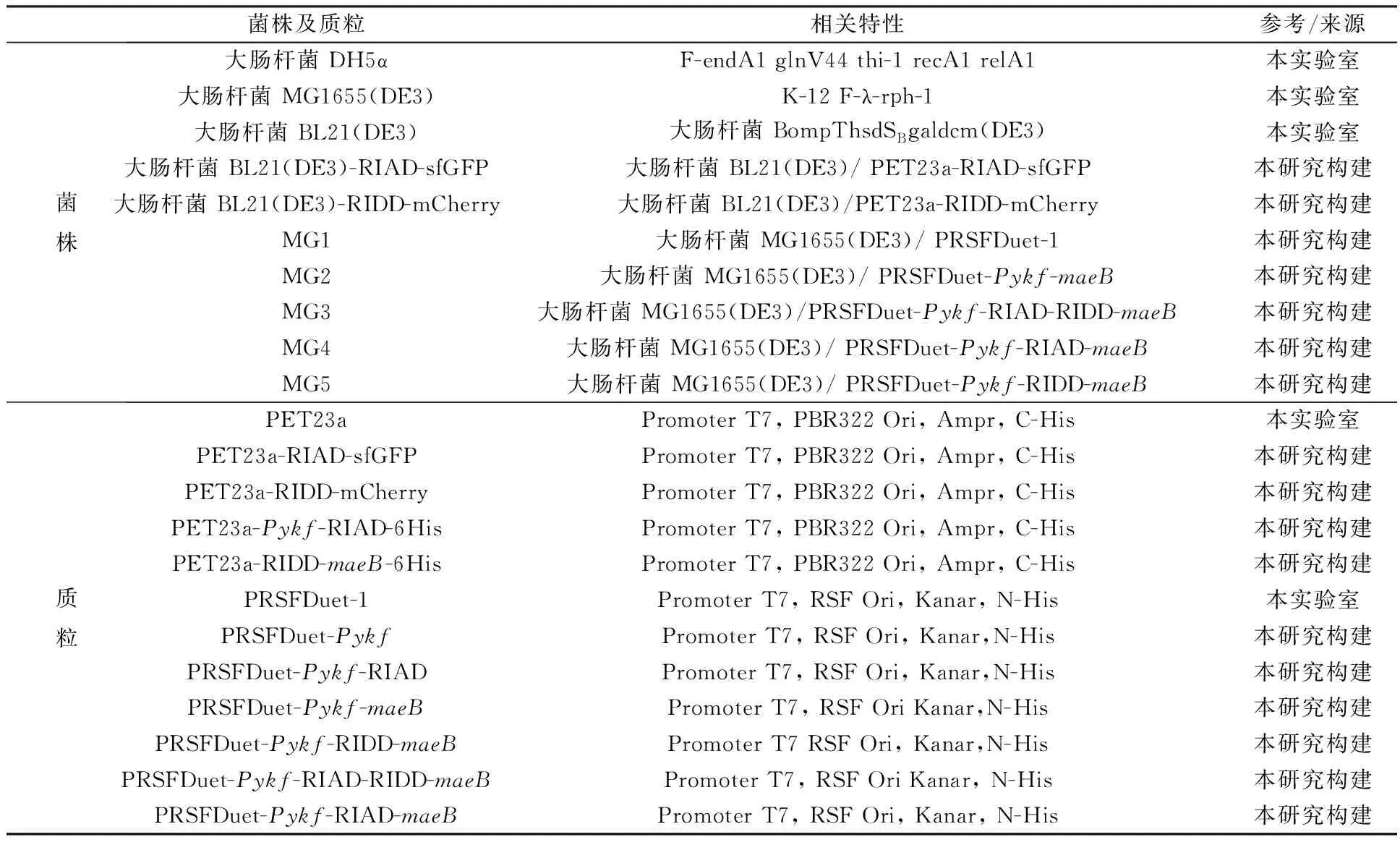
表1 菌株和質粒

表2 引物
1.2 酶支架系統的驗證
1.2.1 熒光蛋白基因的裝配
將紅色熒光蛋白mCherry和綠色熒光蛋白sfGFP分別與RIDD和RIAD的C端融合并裝配于載體pET23a上,構建重組報告質粒pET23a-RIAD-sfGFP和pET23a-RIDD-mCherry,sfGFP蛋白和mCherry蛋白靠近時會發出橙色熒光,由此判斷RIAD-RIDD蛋白支架系統的結合情況[17]。
1.2.2 熒光蛋白的誘導表達
將構建成功的熒光報告質粒pET23a-RIDD-mCherry和pET23a-RIAD-sfGFP分別轉化到大腸桿菌菌株BL21(DE3)中,相應得到菌株BL21(DE3)- RIDD-mCherry、BL21(DE3)- RIAD-sfGFP,于新鮮平板上分別挑取單菌落接種至5 mL氨芐青霉素終濃度為100 μg/mL的LB液體培養基中,在37 ℃下以200 r/min轉速過夜培養,之后再以1%的接種量轉接到100 mL相同氨芐青霉素濃度的LB液體培養基中,待OD600達到0.8~1.0時,加入終濃度為1.0 mmol/L的IPTG并在18 ℃、200 r/min的條件下培養16~18 h,待誘導結束后離心收集菌體并置于-20 ℃冰箱備用。
1.2.3 重組蛋白的純化
將充分誘導蛋白表達后離心收集的大腸桿菌 BL21(DE3)-RIDD-mCherry、BL21(DE3)- RIAD-sfGFP菌體從冰箱取出并解凍,利用20 mL PBS緩沖液充分重懸后加入200 μL PMSF(0.01 mol/L)蛋白酶抑制劑,使用高壓細胞破碎儀充分破碎細胞釋放蛋白并收集上清液,將上清液移至重力柱中,再利用含有不同梯度濃度咪唑的PBS緩沖液洗脫后分別收集流出液,將純度較高的流出液組分移至相應規格的超濾管中來進一步純化濃縮目的蛋白。測定蛋白濃度后將其分裝至1.5 mL EP管中,經液氮速凍后于-80 ℃保存。
1.3 工程菌中目的基因的組裝
在丙酮酸激酶Pykf的C端和蘋果酸酶maeB的N端分別添加RIAD和RIDD肽段標簽合成RIAD-Pykf和RIDD-maeB后克隆至pET-23a載體上,所構建的載體依次為pET23a-Pykf-RIAD、pET23a-RIDD-maeB。借助特異性引物RSF-Pykf-RIAD-F/R,以質粒pET23a-Pykf-RIAD為模板,擴增獲得Pykf-RIAD片段;利用MCS2-RIDD-maeB-F/R引物,以質粒pET23a-RIDD-maeB為模板,擴增獲得RIDD-maeB片段。再以大腸桿菌 MG1655(DE3)基因組DNA為模板,分別使用引物RSF-Pykf-F/R、MCS2-maeB-F/R擴增相應的片段Pykf和maeB來構建無組裝能力的對照組。圖1所示為重組質粒pRSFDuet-Pykf-RIAD-RIDD-maeB的具體構建過程,其關鍵在于將目的片段Pykf-RIAD和RIDD-maeB依次裝載到質粒pRSFDuet-1的第一和第二個MCS。按同樣方法構建pRSFDuet-Pykf-maeB、pRSFDuet-Pykf-RIDD-maeB以及pRSFDuet-Pykf-RIAD-maeB等重組質粒。
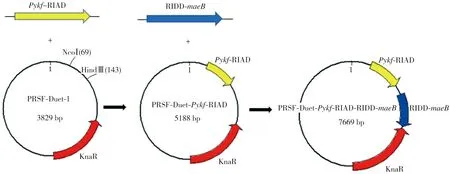
圖1 重組質粒的構建
1.4 重組蛋白誘導表達條件
配制卡那霉素濃度為50 μg/mL的LB液體培養基。將構建成功的表達載體PRSFDuet-Pykf-RIAD-RIDD-maeB轉化至大腸桿菌 MG1655(DE3)得到工程菌株MG3,挑取單菌落接種至5 mL 的LB液體培養基中于37 ℃下培養過夜,再以1%的比例將種子液接種至200 mL的LB液體培養基中于37 ℃下培養,待菌液OD600達到0.8~1.0時,取出一部分菌液分為若干組并加入終濃度為1.0 mmol/L的IPTG后分別于18、28、30、37 ℃下以200 r/min的轉速誘導培養16~18 h,待誘導結束后破胞,使用SDS-PAGE檢測蛋白表達情況,以此確定重組蛋白誘導表達的最佳溫度。同時,將另一部分OD600達到0.8~1.0的菌液仍分為若干組,分別加入終濃度為0.2、0.4、0.6、0.8、1.0、1.2 mmol/L的IPTG,并轉移至30 ℃的恒溫搖床以200 r/min的轉速誘導培養16~18 h,待誘導結束后破胞,使用SDS-PAGE檢測蛋白表達情況,以此確定重組蛋白誘導表達的誘導劑IPTG最佳濃度。
1.5 重組蛋白的誘導表達及檢測
確定最佳的培養溫度和IPTG誘導劑濃度后,進行重組蛋白Pykf和maeB的誘導表達及檢測,具體步驟參照熒光蛋白的誘導表達及重組蛋白的純化。
1.6 工程菌株搖瓶發酵及檢測
本研究采用好氧發酵方式。取出凍存的工程菌株,在添加了相應抗性的LB平板上劃線,挑取單菌落接種于50 mL、卡那霉素濃度為50 μg/mL的LB液體培養基中,在37 ℃下以200 r/min的轉速過夜培養,之后再以1%的接種量轉接至50 mL、卡那霉素濃度為50 μg/mL、葡萄糖濃度為20 g/L的LBG液體培養基中,于37 ℃下培養至對數生長末期,待OD600達到0.8~1.0時,加入終濃度為0.2 mmol/L的IPTG并轉移至30 ℃恒溫搖床以200 r/min的轉速發酵培養48 h,期間每隔6 h取出2 mL菌液,借助液相色譜儀檢測其中的有機酸,分析條件如下:色譜柱為AcclaimTM120C18(4.6 mm×250 mm,5 μm);流動相為0.02 mol/L的KH2PO4,用H3PO4調節液體pH為2.8,進樣量為20 μL,紫外檢測波長為210 nm,流速為0.5 mL/min,柱溫為25 ℃。
2 結果與分析
2.1 熒光蛋白的SDS-PAGE檢測
熒光蛋白RIAD-sfGFP和RIDD-mCherry的SDS-PAGE檢測結果如圖2所示,其中,泳道1為流穿液,泳道2和泳道3為10 mmol/L的咪唑洗脫液,泳道4和泳道5為30 mmol/L的咪唑洗脫液,泳道6和泳道7為50 mmol/L的咪唑洗脫液,泳道8為100 mmol/L的咪唑洗脫液,泳道9為300 mmol/L的咪唑洗脫液,箭頭指示目標蛋白條帶。由圖2(a)可知,熒光蛋白RIAD-sfGFP的誘導表達效果較好,當咪唑洗脫液濃度為30~100 mmol/L時(泳道4至泳道8),目標蛋白條帶較單一,可以在此范圍內收集蛋白;由圖2(b)可知,熒光蛋白RIDD-mCherry的誘導表達效果也較好,在咪唑洗脫液濃度30~300 mmol/L范圍內(泳道4至泳道9),均能獲得較單一的目標蛋白條帶,可在此范圍內收集蛋白。
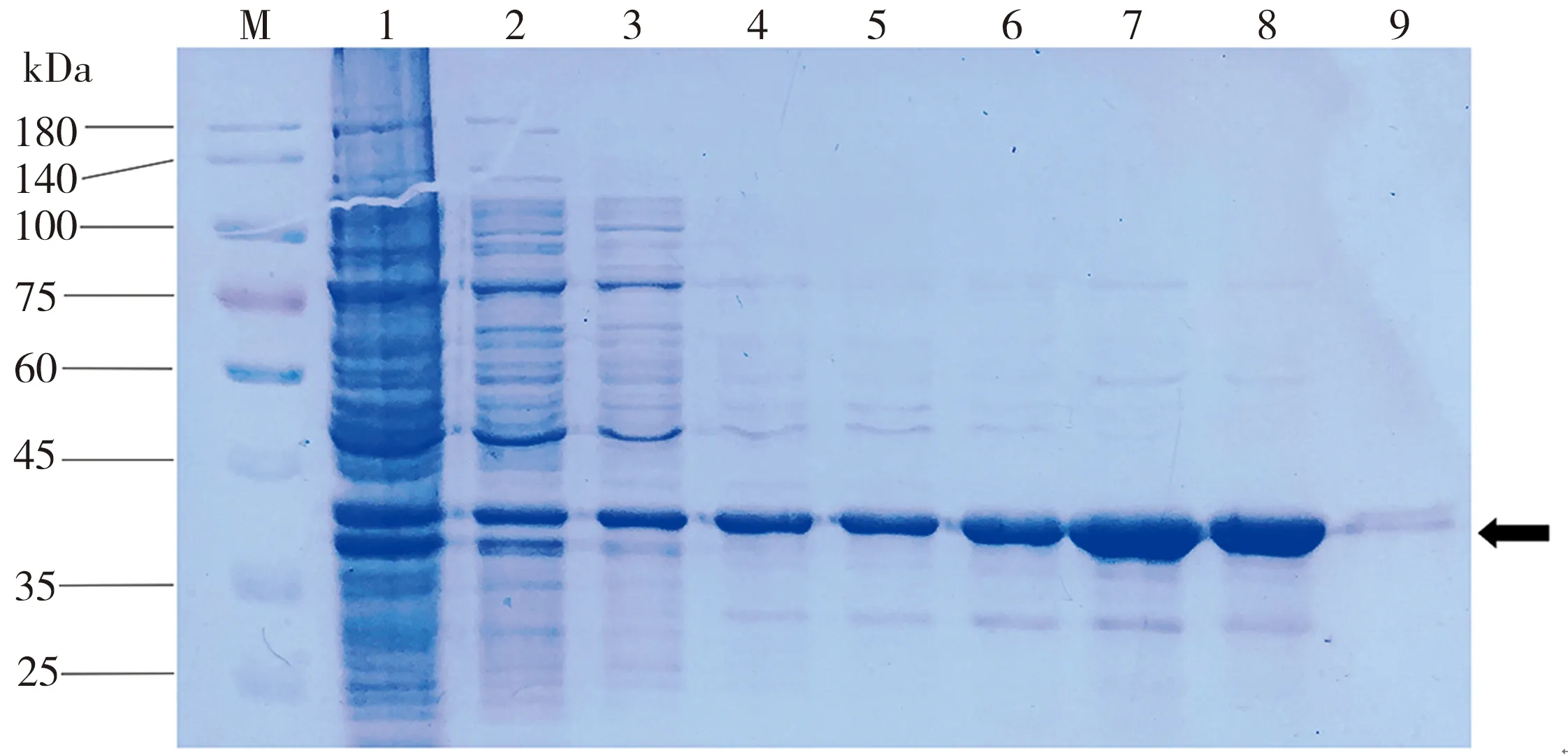
(a)RIAD-sfGFP
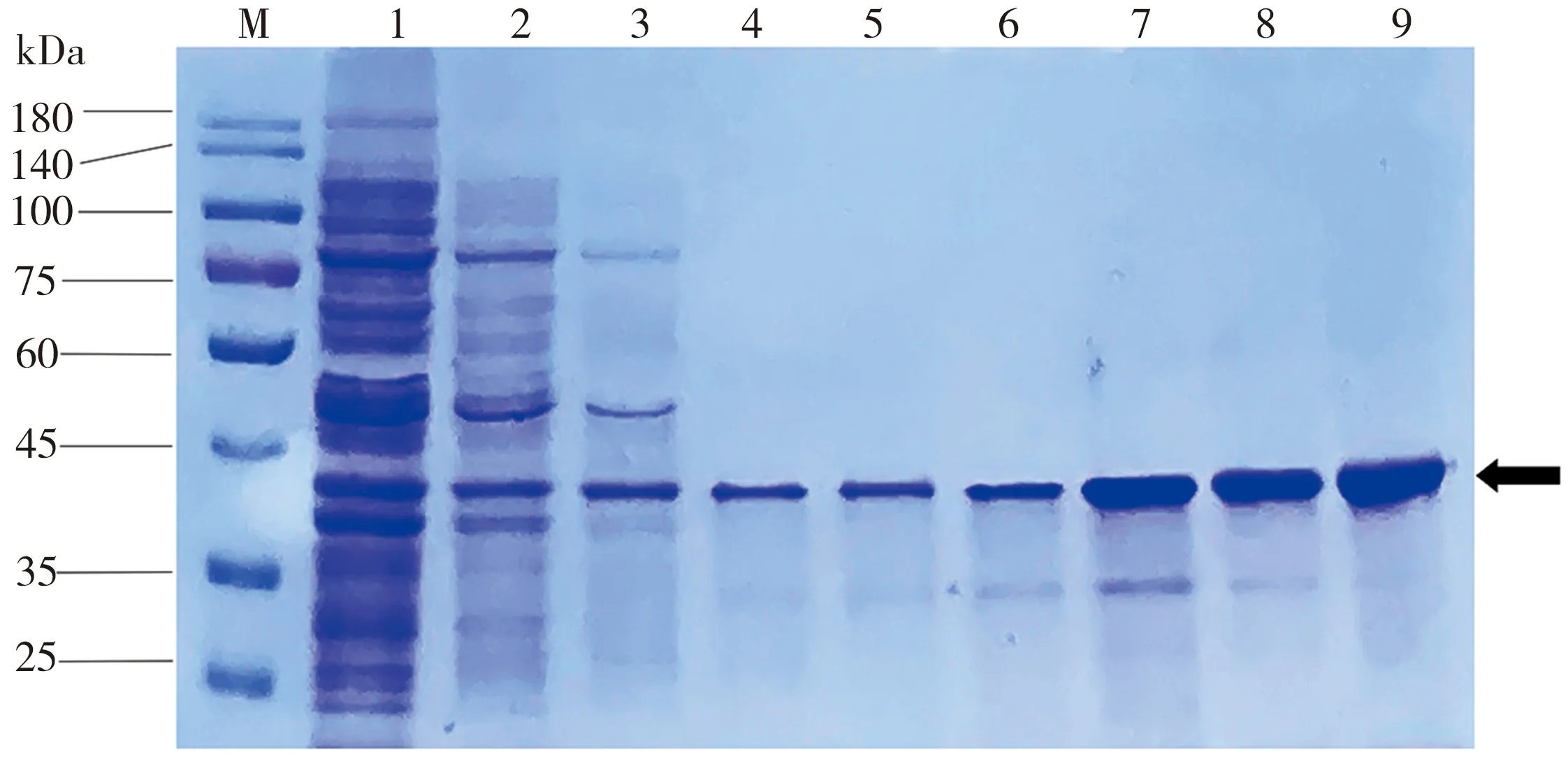
(b)RIDD-mCherry
2.2 蛋白支架功能完整性驗證
將純化的RIAD-sfGFP和RIDD-mCherry蛋白適當稀釋,在25 ℃水浴鍋中孵育30 min后分別取RIAD-sfGFP、 RIAD- mCherry以及二者的混合樣品各600 μL于藍光儀下觀察,結果見圖3。由圖3可以看出,1號管中的RIDD-mCherry樣品發出紅色熒光,3號管中的RIAD-sfGFP樣品發出綠色熒光,而2號管中RIDD-mCherry與RIAD-sfGFP的混合樣品則發出橙色熒光,這表明,經體外孵育后,sfGFP和mCherry蛋白可通過蛋白支架RIAD和RIDD結合在一起,形成呈現橙色熒光的蛋白支架復合物RIAD-sfGFP-RIDD-mCherry。

圖3 RIAD和RIDD的功能完整性驗證
2.3 RIAD-sfGFP和RIDD-mCherry蛋白的互作驗證
利用Native-PAGE檢測RIAD-sfGFP蛋白和RIDD-mCherry的蛋白互作情況,結果如圖4所示,其中泳道1為RIAD-sfGFP蛋白,泳道2為RIDD-mCherry蛋白,泳道3為二者復合體。從圖4中可見,泳道2中RIDD-mCherry蛋白的尺寸增倍,這是因RIDD在近生理條件下極易形成二聚體所致。泳道3中RIAD-sfGFP蛋白與RIDD-mCherry蛋白的混合孵育物在Native-PAGE上遷移最慢,表明二者形成了蛋白復合體,這也再次證明RIAD-sfGFP蛋白和RIDD-mCherry蛋白確實存在相互作用。

圖4 RIAD-sfGFP和RIDD-mCherry蛋白的Native-PAGE檢測
2.4 重組載體的PCR鑒定
圖5所示為重組載體的PCR檢測結果。在圖5(a)中,泳道1和泳道2分別以PRSFDuet-Pykf和PRSFDuet-Pykf-RIAD載體為模板,所用引物均為Duet-UP-1和Duet-Down-1;在圖5(b)中,泳道1和泳道2均以載體PRSFDuet-Pykf-maeB為模板,所用引物分別為Duet-UP-1、T7 Terminator Primer和 DuetUP2 Primer、Terminator Primer,泳道3和泳道4均以載體PRSFDuet-Pykf-RIDD-maeB為模板,所用引物分別為Duet-UP-1、T7 Terminator Primer和 DuetUP2 Primer、Terminator Primer;在圖5(c)中,泳道1和泳道2均以載體PRSFDuet-Pykf-RIAD-maeB為模板,所用引物分別為Duet-UP-1、T7 Terminator Primer和 DuetUP2 Primer、Terminator Primer,泳道3和泳道4均以載體PRSFDuet-Pykf-RIAD-RIDD-maeB為模板,所用引物分別為Duet-UP-1、T7 Terminator Primer和DuetUP2 Primer、Terminator Primer PCR。根據PCR檢測結果可知,所有擴增的片段大小均符合預期,表明相應的目的基因已成功克隆至PRSFDuet-1載體,經測序驗證全部正確。

(a)PRSFDuet-Pykf及PRSFDuet-Pykf-RIAD (b)PRSFDuet-Pykf-maeB及PRSFDuet-Pykf-RIDD-maeB (c)PRSFDuet-Pykf-RIAD-maeB及PRSFDuet-Pykf-RIAD-RIDD-maeB
2.5 重組蛋白誘導條件優化
在不同溫度下誘導后,重組蛋白表達情況的檢測結果如圖6所示,其中,圖6(a)中的泳道1和泳道2分別為重組蛋白于18 ℃誘導所得全菌體及破菌上清液,泳道3和泳道4分別為重組蛋白于28 ℃誘導所得全菌體及破菌上清液,圖6(b)中的泳道1為未經誘導的全菌體,泳道2和泳道3分別為重組蛋白于30 ℃誘導所得全菌體及破菌上清液,泳道4和泳道5分別為重組蛋白于37 ℃誘導所得全菌體及破菌上清液,箭頭指示目標蛋白條帶。由檢測結果可知,重組蛋白于18 ℃或30 ℃下誘導后的表達量較好,考慮到重組菌株MG3后期發酵培養對菌體生長速度及產酸的影響,最終確定重組蛋白誘導溫度為30 ℃。

(a)18、28 ℃ (b)30、37 ℃
經不同濃度的誘導劑IPTG誘導后,重組蛋白表達情況的檢測結果如圖7所示,其中泳道1為未經誘導的全菌體,泳道2和泳道3分別為重組蛋白經0.2 mmol/L的IPTG誘導所得全菌體及破菌上清液,泳道4和泳道5分別為重組蛋白經0.4 mmol/L的IPTG誘導所得全菌體及破菌上清液,泳道6和泳道7分別為重組蛋白經0.6 mmol/L的IPTG誘導所得全菌體及破菌上清液,泳道8和泳道9分別為重組蛋白經0.8 mmol/L的IPTG誘導所得全菌體及破菌上清液,泳道10和泳道11分別為重組蛋白經1.0 mmol/L的IPTG誘導所得全菌體及破菌上清液,泳道12和泳道13分別為重組蛋白經1.2 mmol/L的IPTG誘導所得全菌體及破菌上清液,箭頭指示目標蛋白條帶。由檢測結果可知,目的蛋白表達量隨著IPTG濃度的提高而逐漸減少,考慮到高濃度的IPTG會毒害菌體,而采用較低濃度的IPTG能適當延長轉錄過程,有利于可溶性蛋白的表達[18],所以最終確定IPTG的濃度為0.2 mmol/L。

圖8 重組蛋白Pykf-RIAD和RIDD-maeB的Native-PAGE檢測
2.6 重組蛋白Pykf-RIAD和RIDD-maeB的互作驗證
利用Native-PAGE檢測重組蛋白Pykf-RIAD和RIDD-maeB的互作情況,結果如圖8所示,其中,泳道1為經過純化處理的Pykf-RIAD-RIDD-maeB蛋白樣品,泳道2為流穿液經煮樣處理后的蛋白樣品,箭頭指示目標蛋白條帶。由圖8可見,泳道2中的流穿液經高溫處理后,蛋白支架間的結合作用解除,形成兩條單一的條帶分別對應RIDD-maeB和Pykf-RIAD蛋白,通過與泳道1中的Pykf-RIAD-RIDD-maeB蛋白復合物檢測結果對比可知,重組蛋白maeB和Pykf在胞內表達后,能夠通過蛋白支架RIDD和RIAD發生互作,形成Pykf-RIAD-RIDD-maeB蛋白復合物。
2.7 工程菌株發酵及產物檢測
菌株MG1、MG2和MG3的發酵生長情況及產酸量檢測結果分別如圖9和圖10所示,其中MG1為轉入空載體PRSFDuet-1的大腸桿菌 MG1655(DE3)菌株,MG2為轉入載體PRSFDuet-Pykf-maeB的大腸桿菌 MG1655(DE3)菌株,MG3為轉入載體PRSFDuet-Pykf-RIAD-RIDD-maeB的大腸桿菌 MG1655菌株。從圖9中可以看出,三組菌株的生長速度以MG3為最快,MG2次之,MG1最慢且與前兩者差距較大。由圖10可見,經過48 h搖瓶發酵,MG1菌株的L-蘋果酸積累量極低,MG2菌株的L-蘋果酸積累量也僅為0.4886 g/L,而MG3菌株的相應值則高達2.4012 g/L,同時,其丙酮酸積累量也達到了1.1342 g/L,明顯高于菌株MG2(0.6409 g/L)與MG1(0.1290 g/L)的相應值,檢測結果表明,借助蛋白支架實現Pykf和maeB共定位后,所形成的底物通道可有效促進PEP轉化為丙酮酸,胞內丙酮酸不斷積累有助于實現蘋果酸酶的逆向催化,從而大幅提高了L-蘋果酸的產量。
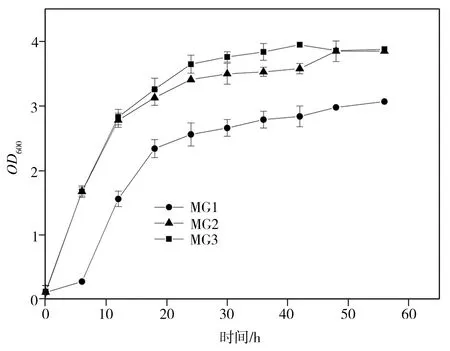
圖9 菌株的生長曲線

圖10 發酵液中的有機酸檢測
2.8 單一支架標簽對工程菌株發酵產酸的影響
構建重組菌株MG4(PRSFDuet-Pykf-RIAD-maeB)和MG5(PRSFDuet-Pykf-RIDD-maeB),以MG2(PRSFDuet-Pykf-maeB)為對照菌株,對三組菌株進行發酵培養,相應的生長情況及發酵48 h的產酸量檢測結果如圖11所示。由圖11可見,三組菌株的生長情況及蘋果酸產量差別不大,表明單一蛋白支架標簽對菌株生長速度和產酸的影響較小,這也再次證實,MG3菌株快速生長且L-蘋果酸產量大幅提高是Pykf和maeB共定位的結果,得益于蛋白支架RIAD、RIDD的相互作用。
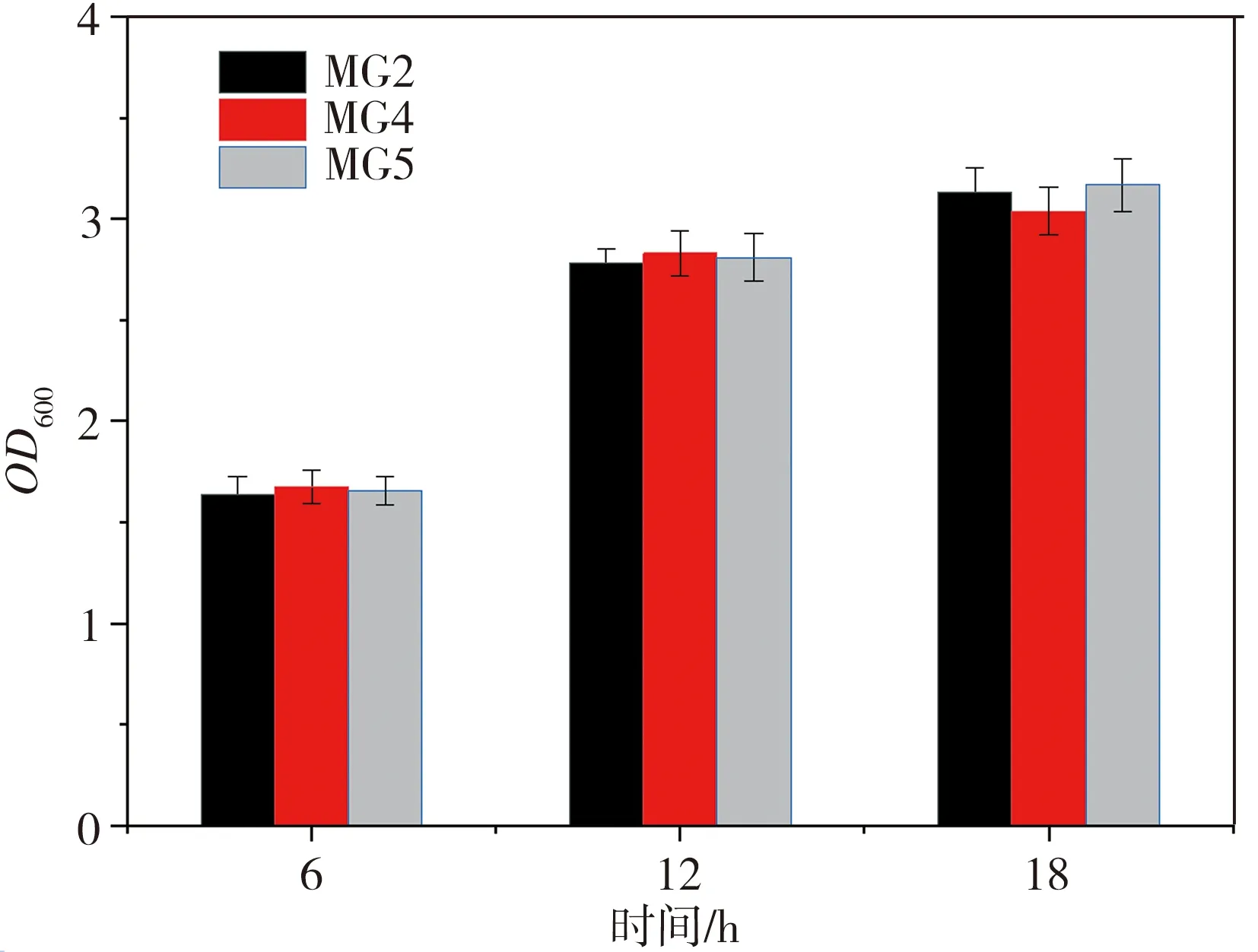
(a)菌株的生長
3 結語
為了在L-蘋果酸與丙酮酸的可逆轉化中逆向催化丙酮酸轉化成L-蘋果酸,進而積累目標產物L-蘋果酸,本研究采用RIAD和RIDD蛋白支架將L-蘋果酸合成途徑中的關鍵酶Pykf和maeB錨定在一起,形成底物通道以增加丙酮酸的積累,促使蘋果酸酶催化更多的丙酮酸轉化成L-蘋果酸。實際研究發現,利用蛋白支架RIAD和RIDD將Pykf與maeB共定位(Pykf-RIAD-RIDD-maeB)形成復合物并導入大腸桿菌MG1655后,所得重組菌株生長速度明顯加快、L-蘋果酸積累量大幅提高,這應歸因于積累的丙酮酸直接被引往生成L-蘋果酸的方向,減少了副產物如乙酸、乳酸等的產量,避免過多地消耗胞內還原力,從而使菌株生長速度加快,同時,蘋果酸酶在催化丙酮酸轉化為L-蘋果酸時還可能伴隨著NAD(P)H的生成,蛋白支架的引入使該反應過程加快,因此在胞內產生更多的NAD(P)H,進一步導致菌株生長加速,在菌株生長加速以及蛋白支架將酶共定位加速催化逆向反應的雙重作用下,重組菌株的L-蘋果酸產量大幅增加,這對于構建高產量的L-蘋果酸工程菌株具有一定的參考價值。

