缺氧肝癌源性外泌體miR-1260b對腫瘤相關巨噬細胞M2亞型的影響及其機制
楊曄妮 趙梓吟 王有鵬 孫洪發 張順 韓冰
(青島大學附屬醫院,山東 青島 266003 1 肝膽胰外科;2 器官移植中心)
肝細胞癌(hepatocellular carcinoma,HCC)的發病率在全球人群中位居第6位[1],確診時間晚、高復發率和高死亡率是造成HCC患者不良預后的重要原因。研究顯示瘤內缺氧是進展期HCC的關鍵特征,缺氧除可通過調節缺氧誘導因子(HIF)引起肝癌細胞適應性缺氧等的一系列變化,還具有影響腫瘤細胞分泌的外泌體對免疫細胞中的巨噬細胞傳遞信號的作用[2-3]。
外泌體是一類粒徑30~150 nm的含有RNA和蛋白的盤狀囊泡,可在不同類型細胞之間起通訊作用[4]。研究發現,外泌體中膜蛋白凋亡誘導因子6相互作用蛋白(Alix)高表達,而基本不表達鈣連接蛋白。缺氧環境可以影響肝癌細胞分泌和傳遞外泌體,從而影響腫瘤細胞與腫瘤微環境中其他細胞,包括腫瘤相關巨噬細胞(TAM)的通訊[5-7]。
本課題組先前的實驗發現,SOCS5可以調節HIF-1α依賴性的線粒體損傷,進一步促進HCC的進展[3]。但是在缺氧環境下,肝癌細胞是如何通過外泌體轉運核酸物質到達巨噬細胞,以及誘導免疫抑制的具體機制目前尚不清楚。本研究通過構建人HCC97H(MHCC97H)細胞缺氧模型,探討缺氧肝癌細胞源性外泌體miR-1260b對巨噬細胞M2亞型的影響及其機制,旨在為HCC的免疫治療提供新的治療靶點。
1 材料和方法
1.1 材料與試劑
MHCC97H細胞和人單核白血病細胞(THP-1)均購自中國科學院上海生命科學研究院,并通過短串聯重復序列(STR)分析驗證了細胞的真實性;2.5 g/L胰蛋白酶溶液、高效RIPA裂解液、蛋白酶抑制劑混合液、蛋白磷酸酶抑制劑混合物購自北京索萊寶科技有限公司,TRIzol購自美國Invitrogen公司。
1.2 研究方法
1.2.1細胞培養和處理 97H細胞置于完全培養基(含體積分數0.10的胎牛血清、100 kU/L青霉素和100 mg/L鏈霉素的高糖DMEM)中,在37 ℃、含體積分數0.05的CO2培養箱當中進行培養。待97H細胞融合度達70%~80%后,在完全培養基中分別加入0、100 μmol/L濃度的CoCl2,培養24 h后提取RNA,實時熒光定量PCR方法(RT-qPCR)方法檢測細胞中HIF-1α的相對表達量,若HIF-1α穩定高表達且兩種濃度間有顯著差異時,則為細胞缺氧模型構建成功[8-9],可用于后續實驗。
將THP-1細胞置于THP-1專用培養基(武漢普諾賽生命科技有限公司)中,和97H細胞相同條件進行培養,培養至對數生長期以后進行實驗。取THP-1細胞計數并接種于含有專用培養基的6孔板中,每孔約1×106個細胞,分別向專用培養基中加入濃度0、100 μg/L的丙二醇甲醚醋酸酯(PMA)(美國MedChemExpress生物科技有限公司),分別為THP-1組和THP-1+PMA組,繼續培養24 h,然后使用RT-qPCR方法檢測兩組THP-1細胞中CD11b相對表達量,此時在THP-1+PMA組中得到的細胞即為M0巨噬細胞。然后于培養了24 h的THP-1+PMA組培養基中再加入100 μg/L的IL-4/IL-13,繼續培養72 h以后,得到M2巨噬細胞(M2組)[10]。
1.2.2細胞共培養 將M0巨噬細胞鋪至孔徑為0.4 μm的共培養板的上室內,分別將融合度達到70%~80%的97H細胞,以及細胞缺氧模型構建成功97H細胞鋪至共培養板的下室,分別為97H-N+M0組和97H-H+M0組,共培養48 h以后,采用RT-qPCR方法檢測上述兩組以及M2組巨噬細胞中TNF-α、CD163和CD206的相對表達量。
將M0巨噬細胞鋪至孔徑為0.4 μm的共培養板上室內,待97H細胞融合度達70%~80%時,分別轉染miR-1260b NC(97H-NC+M0組)和miR-1260b Mimic(97H-Mimic+M0組),并將其鋪至共培養板下室,共培養48 h,采用RT-qPCR方法檢測兩組細胞中TNF-α和CD206相對表達量。
將融合度達到70%~80%的97H細胞轉染miR-1260b Inhibitor后,再加入100 μmol/L濃度的CoCl2缺氧處理24 h,即為97H-H-1260 IN組細胞。將M0巨噬細胞鋪至孔徑為0.4 μm的共培養板上室內,將上面獲得的97H-H-1260 IN組細胞(97H-H-1260 IN+M0組)以及融合度達到70%~80%的97H細胞(97H-N+M0組)和細胞缺氧模型構建成功97H細胞(97H-H+M0組)鋪至共培養板下室,繼續培養48 h,RT-qPCR方法檢測上述4組M0巨噬細胞中TNF-α和CD206相對表達量。
1.3 外泌體的提取、鑒定及示蹤
將97H細胞置于完全培養基中,待細胞融合度達到70%~80%時,分別向完全培養基中加入0、100 μmol/L的CoCl2,培養24 h后,將培養基更換為DMEM培養基(含體積分數0.10無外泌體胎牛血清),分別為exo-N組和exo-H組,培養48 h后,采用低溫差速離心方法[11]提取exo-N組和exo-H組細胞上清液中的外泌體,并重懸于50~100 μL的PBS中。
取濃度為100 g/L的exo-N組外泌體顆粒,以Dil橙紅色熒光染料進行標記。加至沒有染料標記的M0巨噬細胞培養基中,共同孵育24 h后,利用熒光顯微鏡觀察M0巨噬細胞內的熒光反應,若外泌體被巨噬細胞吞噬則出現橙紅色熒光顆粒。
取exo-N組和exo-H組的20 μL的外泌體顆粒懸液滴至電鏡銅網柵中,停留1 min,磷鎢酸溶液負染固定1~10 min,濾紙吸干后室溫自然晾干,在生物透射電子顯微鏡下觀察外泌體的大小和形狀,并拍照。使用納米顆粒跟蹤分析儀(NTA)的ZetaVIEW S/N 252軟件分析外泌體顆粒的大小。
取exo-N組和exo-H組外泌體顆粒,設置濃度100 g/L,加至M0細胞培養基中,分別為exo-N+M0組和exo-H+M0組,培養48 h以后,通過RT-qPCR方法檢測兩組細胞中CD206相對表達量。
1.4 細胞轉染
參考文獻[12]的方法,向M0巨噬細胞內轉染miR-1260b NC、miR-1260b Mimic、miR-1260b NC-Inhibitor、miR-1260b Inhibitor,分別為M0-NC組、M0-Mimic組、M0-NC IN組、M0-IN組,向M2巨噬細胞轉染miR-1260b NC、miR-1260b Inhibitor,分別為M2-NC IN組和M2-IN組。采用RT-qPCR方法檢測以上各組巨噬細胞中TNF-α以及CD206的表達。miR-1260b NC引物的序列為:5′-UUCU-CCGAACGUGUCACGUTT-3′;miR-1260b Mimic引物的序列為:5′-AUCCCACCACUGCCACCAU-GGUGGCAGUGGUGGGAUUU-3。miR-1260b NC-Inhibitor引物的序列為:5′-CAGUACUUUUGUG-UAGUACAA-3′;miR-1260b Inhibitor引物的序列為:5′-AUGGUGGCAGUGGUGGGAU-3′。
1.5 RT-qPCR方法檢測外泌體中miR-1260b相對表達量
按照試劑盒說明書的要求,用TRIzol試劑提取exo-N組和exo-H組外泌體顆粒中的RNA,利用Nano Drop分光光度計檢測提取的RNA濃度以及純度,用TaKaRa(日本寶日醫生物技術有限公司)的SYBR?Premix Ex Taq TM Ⅱ進行RT-qPCR。PCR反應體系共20 μL,包括10 μL的PCR Master Mix、1 μg cDNA以及適宜濃度的DEPC水和引物。以U6為內參。引物委托由上海生工生物工程有限公司合成,miR-1260b的特異性引物為:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACT-GGATACGACAAAATA-3′,正向引物為:5′-CG-CGATCCCACCACTGC-3′,反向引物為:5′-AGTGCAGGGTCCGAGGTATT-3′;U6的特異性引物為:5′-GTCGTATCCAGTGCAGGGTCCGA-GGTATTCGCACTGGATACGACAAAATA-3′,正向引物為:5′-CTCGCTTCGGCAGCACA-3′,反向引物為:5′-AACGCTTCACGAATTTGCGT-3′。
1.6 Western blot方法檢測97H細胞和外泌體中Alix和鈣連接蛋白的表達水平
97H細胞融合度達到70%~80%時,使用RIPA裂解液、蛋白酶和磷酸酶抑制劑裂解97H細胞(97H組),提取蛋白混合物。對新鮮提取的exo-N組和exo-H組的外泌體顆粒同時使用上述試劑進行裂解,提取蛋白混合物。采用BCA-蛋白定量法對樣品中的蛋白進行定量以后,使用SDS-PAGE凝膠分離蛋白,利用電場裝置將分離的蛋白轉移至PVDF膜上,嚴格膜封閉后,一抗4 ℃下孵育過夜。與同種酶偶聯的山羊抗兔IgG-HRP(上海愛必信生物科技有限公司)抗體結合后,加入ECL發光溶液顯色后,采用成像儀檢測目標蛋白的相對表達量。所用的抗體有抗-Alix、抗-Calnexin(1∶1 000,上海艾博抗貿易有限公司)、抗-GAPDH(1∶1 000,上海愛必信生物科技有限公司)。
1.7 統計學處理
2 結 果
2.1 缺氧97H細胞對巨噬細胞極化的影響
RT-qPCR技術檢測結果顯示,THP-1組以及THP-1+PMA組細胞中CD11b基因的相對表達量分別為1.001±0.059、3.931±0.027,兩組比較差異具有顯著性(t=78.14,P<0.05)。
M2組、97H-N+M0組及97H-H+M0組巨噬細胞中CD163、CD206和TNF-α基因的相對表達量比較,差異均有顯著性(F=319.90~494.20,P<0.05),各組間兩兩比較差異均有顯著性(t=14.23~46.88,P<0.05)。見表1。
表1 3組細胞中CD163、CD206和TNF-α基因相對表達量比較
2.2 缺氧肝細胞癌分泌的外泌體對巨噬細胞的攝取和極化產生的影響
Western blot方法結果顯示,與97H組比較,exo-N組和exo-H組提取的蛋白混合物中高表達Alix,基本不表達鈣聯蛋白(圖1)。生物透射電子顯微鏡以及NTA結果顯示,外泌體顆粒呈雙凹圓盤狀微小囊泡,直徑30~150 nm,見圖2。
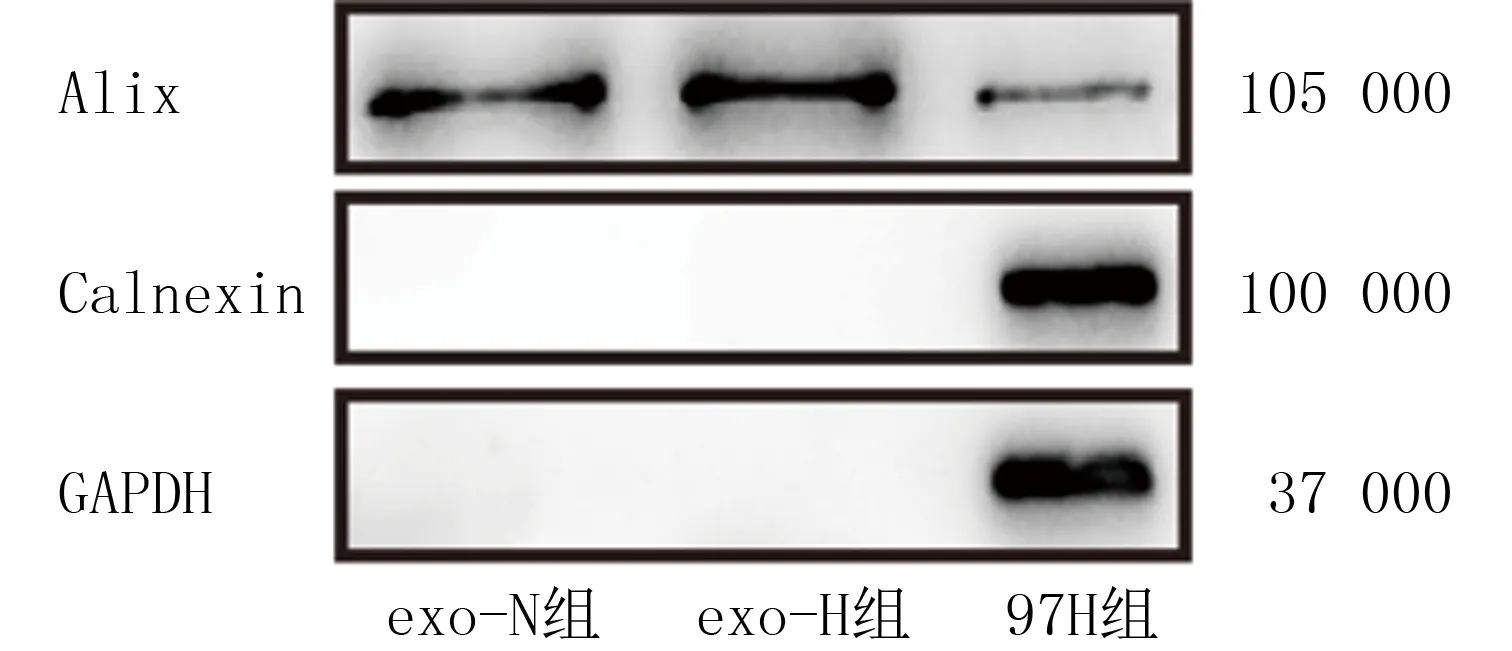
圖1 缺氧肝癌細胞源性外泌體中Alix和鈣聯蛋白表達情況
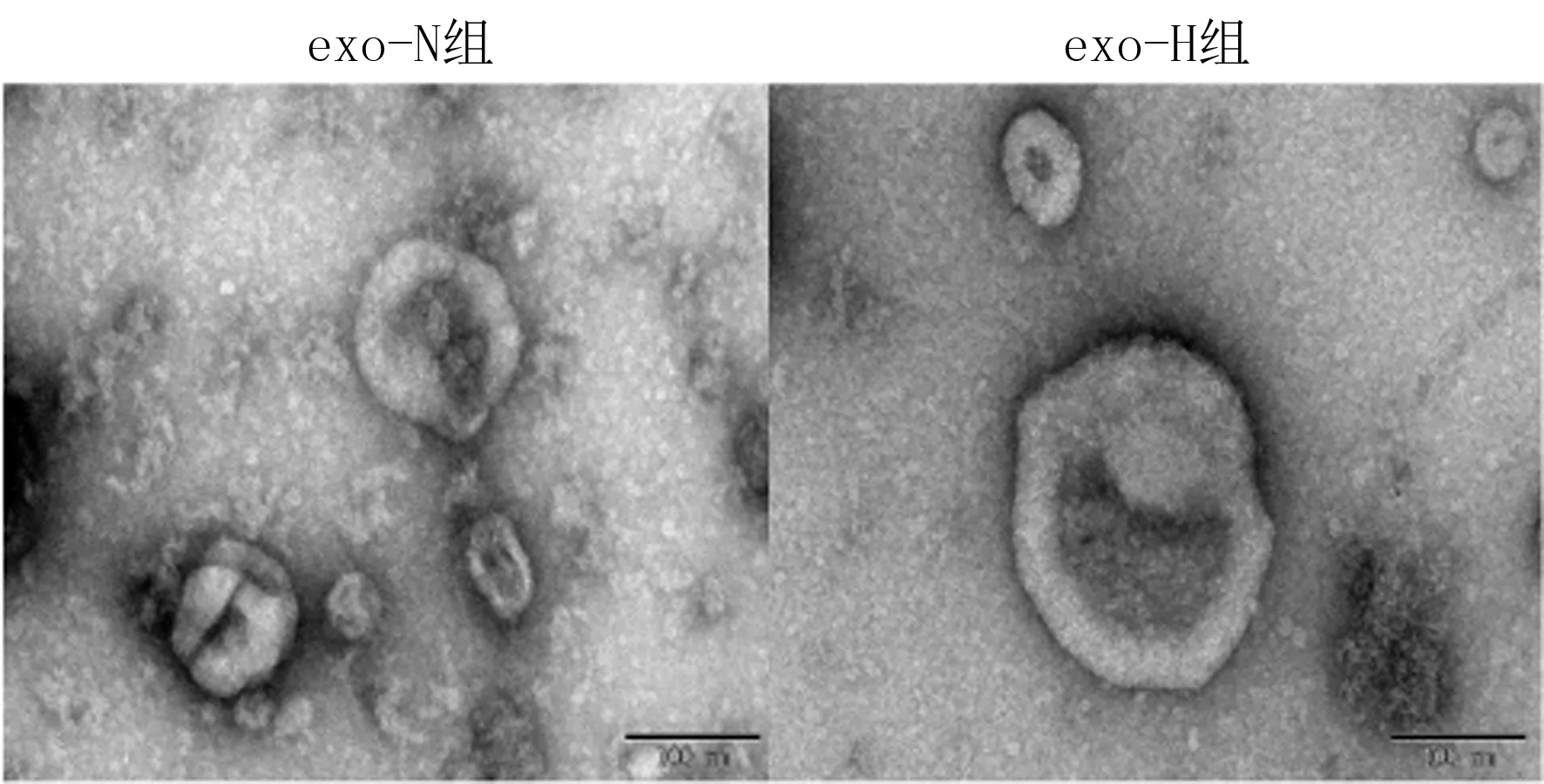
圖2 缺氧肝癌細胞源性外泌體的形態(200倍)
RT-qPCR檢測的結果顯示,exo-N+M0組和exo-H+M0組M0巨噬細胞中CD206基因的相對表達量分別為1.000±0.010、2.852±0.188,兩組比較差異具有顯著性(t=17.06,P<0.05)。熒光顯微鏡下觀察顯示M0巨噬細胞內出現帶有橙紅色熒光的顆粒(圖中白色箭頭指示處),表示外泌體被M0巨噬細胞吞噬。見圖3。
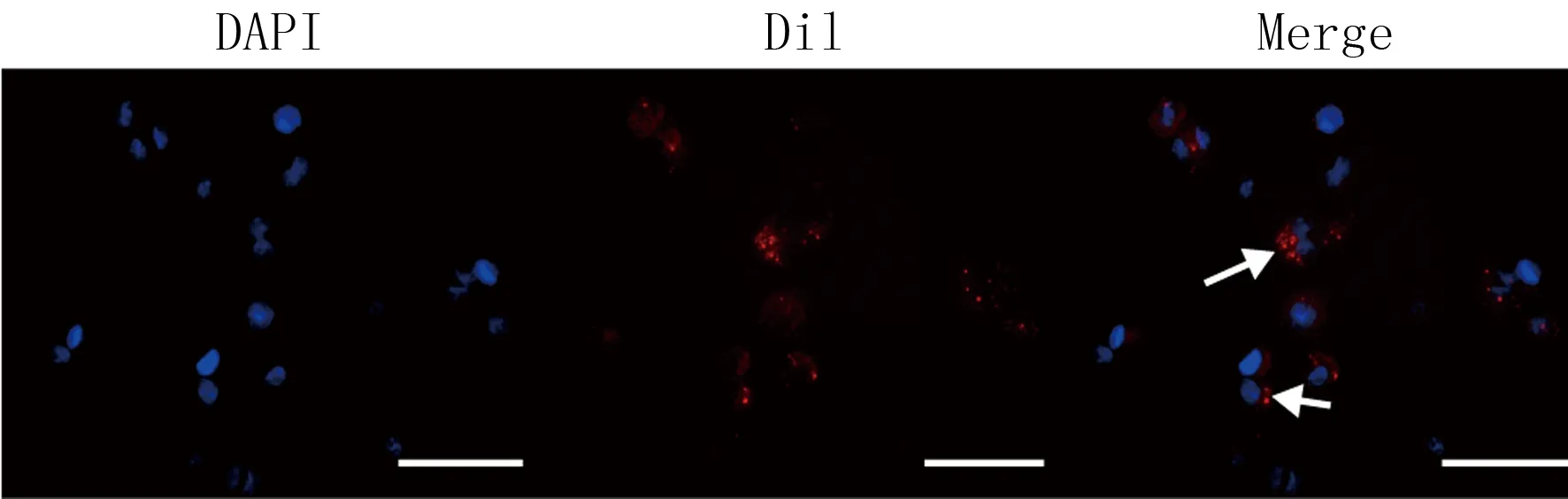
圖3 缺氧肝癌細胞源性外泌體Dil熒光染色(50倍)
2.3 缺氧97H細胞來源的外泌體miR-1260b對M2巨噬細胞極化的影響
RT-qPCR技術檢測結果顯示,exo-N和exo-H組外泌體中的miR-1260b基因的相對表達量分別為1.000±0.007、2.133±0.162,兩組比較差異有顯著性(t=12.09,P<0.05)。M0-NC組與M0-Mimic組的miR-1260b基因的相對表達量分別為1.000±0.038、32.903±0.570,CD206基因的相對表達量分別為1.001±0.049、1.325±0.337,TNF-α基因的相對表達量分別為1.000±0.021、0.705±0.058,M0-Mimic組與M0-NC組比較,miR-1260b、CD206基因的相對表達量顯著高表達(t=96.70、8.82,P<0.05),而TNF-α基因的相對表達量顯著降低(t=8.22,P<0.05)。
M2-NC IN組與M2-IN組中miR-1260b基因的相對表達量分別為1.000±0.035、0.052±0.002,CD206基因的相對表達量分別為1.002±0.069、1.000±0.021,TNF-α基因的相對表達量分別為1.000±0.008、3.428±0.249,M2-IN與M2-NC IN組比較,miR-1260b基因的相對表達量顯著降低,TNF-α基因的相對表達量則顯著增高(t=47.31、16.88,P<0.05),CD206基因的相對表達量比較無顯著差異(P>0.05)。
2.4 miR-1260b Mimic/Inhibitor對缺氧97H細胞誘導M2巨噬細胞的調節作用
RT-qPCR檢測結果顯示,M0-NC+M0組與97H-Mimic+M0組M0巨噬細胞中的CD206基因的相對表達量分別為1.005±0.125、5.037±0.227,TNF-α基因相對表達量則分別為1.001±0.056、0.278±0.017,兩組比較,CD206和TNF-α相對表達量具有顯著差異(t=26.95、21.45,P<0.05)。
97H-N+M0組、97H-H+M0組以及97H-H-1260 IN+M0組M0巨噬細胞中的CD206基因的相對表達量則分別為1.001±0.053、3.209±0.576、0.652±0.038,TNF-α基因的相對表達量分別為1.003±0.049、0.456±0.025、1.089±0.026,各組間CD206和TNF-α比較差異均有顯著性(F=36.50、44.07,P<0.05),其中,與97H-H+M0組比較,97H-H-1260 IN+M0組M0巨噬細胞中CD206基因的相對表達量顯著降低,TNF-α基因的相對表達量顯著升高(t=9.09、12.54,P<0.05)。
3 討 論
我國是HCC高發國家,據統計人群中HCC發病率高達18.2/10萬[13-14]。TAM是腫瘤微環境中主要的免疫細胞,可以極化為M1或M2亞型,M2巨噬細胞具有促進腫瘤細胞進展的作用[15]。不同的巨噬細胞亞型均具有特異性標志物,例如M0巨噬細胞以CD11b基因高表達為特征,M1巨噬細胞高表達TNF-α,而M2巨噬細胞則高表達CD206、CD163[10,16]。研究發現,缺氧環境下腫瘤細胞的外泌體中富含免疫調節蛋白和趨化因子[17],還包含有能促進M2巨噬細胞極化的miRNA分子。
研究發現,免疫細胞中的M2巨噬細胞可以通過上調PD-L1或者是分泌抗炎細胞因子IL-10抑制CD8+T細胞、CD4+T細胞等免疫細胞活性,以此重塑免疫微環境,從而促進肝癌細胞的免疫逃逸[18-20]。除此之外,M2巨噬細胞有促進血管和淋巴管生成、腫瘤細胞的增殖和轉移等作用,有促癌的作用,而M1巨噬細胞則具有抗癌的作用。因此探索缺氧腫瘤細胞通過分泌外泌體誘導M2-TAM極化的具體機制,找到控制TAM由M2轉化為M1表型的具體靶向分子,對于提高HCC患者的預后至關重要。目前在黑色素瘤、膠質瘤、胰腺癌、肺癌多種腫瘤中,均被證實缺氧腫瘤細胞可以通過誘導M2巨噬細胞極化調節腫瘤進展[17,21-23]。本研究結果顯示,缺氧97H細胞可以促進M2巨噬細胞極化,并高表達基因CD206、CD163,與WANG等[24]研究結果一致。同時本研究通過體外實驗首次證實,在M0巨噬細胞中轉染miR-1260b Mimic可以有效地誘導M2巨噬細胞極化,而靶向抑制miR-1260b的表達則可以有效控制巨噬細胞M2亞型轉化為M1亞型。總之,本研究發現缺氧肝癌細胞來源的miR-1260b可以誘導M2巨噬細胞極化。
miRNA是一類不具有蛋白質編碼功能的內源性小分子RNA,主要通過特異性識別mRNA的3′非編碼區靶向降解mRNA,從而影響基因的表達水平,發揮調節細胞穩態的作用[25]。研究發現,相較于癌旁組織,miR-1260b在HCC組織當中高表達,miR-1260b可以通過抑制G蛋白信號調節因子從而促進肝癌細胞的增殖,即miR-1260b具有促瘤效應[26-27]。體外研究發現,向巨噬細胞培養基中加入ERK抑制劑后,巨噬細胞內miR-1260b表達顯著上調,miR-1260b可能是影響M2巨噬細胞極化的重要分子[28]。由此可以推測,在缺氧97H細胞影響巨噬細胞極化的這一過程中,miR-1260b可能是促進巨噬細胞M2標記物CD206基因高表達的原因。并且,miR-1260b還被發現是缺氧肝癌細胞分泌的外泌體中的差異性分子[29]。因此可以推斷,外泌體源性miR-1260b可能是缺氧環境下肝癌細胞調節M2巨噬細胞極化的主要分子。本研究通過提取以及分離缺氧97H細胞的外泌體,探究了miR-1260b對M2巨噬細胞極化的影響機制。本研究成功提取了外泌體顆粒,此顆粒已經過NTA分析、生物透射電子顯微鏡觀察和Western blot方法驗證。然后,本研究將缺氧肝癌源性外泌體顆粒與巨噬細胞共培養后,RT-qPCR檢測結果顯示,缺氧腫瘤源性外泌體可以誘導M0巨噬細胞高表達M2巨噬細胞標志物CD206。本研究還發現缺氧97H細胞來源的外泌體高表達miR-1260b基因,由此可以推測,miR-1260b極有可能是缺氧97H細胞通過外泌體誘導M2巨噬細胞極化的關鍵靶分子。
miRNA Mimic/Inhibitor是通過化學合成的方法合成的特定miRNA模擬物/抑制劑,可利用細胞轉染的方式進入細胞內增強或削弱內源miRNA的調控作用,以此進行功能獲得性/缺失性研究。為了進一步探究miR-1260b在誘導M2巨噬細胞亞型極化中的作用,本研究向M0巨噬細胞內轉染miR-1260b Mimic,結果顯示M2巨噬細胞亞型標志物CD206高表達,然而在M2巨噬細胞內轉染miR-1260b Inhibitor后,結果顯示,可以顯著上調M1巨噬細胞亞型標志物TNF-α的表達,而對CD206的調節作用不明顯,提示miR-1260b可能是缺氧97H細胞源性外泌體中導致M2巨噬細胞極化的主要調節分子,并且在M2巨噬細胞中抑制miR-1260b的表達以后可以有逆轉M2巨噬細胞亞型轉化為M1亞型的可能性。同時,本研究還發現,轉染了miR-1260b Mimic的肝癌細胞共培養M0巨噬細胞后,可以誘導M0巨噬細胞向M2巨噬細胞的極化。而轉染了miR-1260b Inhibitor的缺氧97H細胞,相較于缺氧97H細胞共培養M0巨噬細胞后,可以有效逆轉缺氧97H細胞誘導M2巨噬細胞極化。
綜上所述,本研究結果顯示,缺氧97H細胞可以通過外泌體誘導M2巨噬細胞極化,并且缺氧肝癌細胞源性外泌體中的miR-1260b被首次發現是導致M2巨噬細胞極化發生免疫抑制的關鍵分子,為HCC免疫治療方面的研究提供了理論支持。
作者聲明:韓冰、楊曄妮、趙梓吟參與了研究設計;楊曄妮、王有鵬、孫洪發和張順參與了論文的寫作和修改。所有作者均閱讀并同意發表該論文。所有作者聲明不存在利益沖突。

