雙氫青蒿素對肝纖維化大鼠腸道菌群及NLRP3炎性小體的影響
任海霞,郭永澤,李淑霞,王建華,郭曉會,平付敏,王恩雨,單鐵強
(1. 河北工程大學附屬醫院,河北 邯鄲 056002;2. 秦皇島市海港醫院,河北 秦皇島 066000)
肝纖維化為肝臟受到各種化學、生物等有害因素損傷時,肝內組織對其損傷所進行的反應性修復所致的一種病理改變,反復或長期損傷會造成肝組織內的富含纖維結締組織的修復灶增多,肝臟質地變硬,即發展為肝硬化[1]。因此,肝纖維化為各種慢性肝臟疾病進展成肝硬化的中間階段,倘若對其不進行及時合理治療,會繼續惡化為肝癌或者肝臟功能衰竭[2]。由于肝纖維化起病誘因繁雜,發病機制尚不明晰,目前尚無特效防治藥物。近年來研究認為,肝病的發生和進展與腸道內的菌群數量和種類密切相關[3]。由于肝臟和膽管的胚芽起源于前腸,這種同源性決定了二者出生后功能上的互補作用。除此之外,腸內正常或異常菌群的代謝產物也會運送到肝臟,影響著肝臟組織結構的完整和功能的正常運行[4]。雙氫青蒿素為中草藥青蒿素的還原產物,具有改善多種組織纖維化、減輕炎癥反應及保護腸道菌群穩態等作用[5-6]。基于雙氫青蒿素的這些功效,本實驗通過觀察肝纖維化大鼠腸道菌群、肝組織中纖維化指標及NOD樣受體蛋白3(NLRP3)炎性小體相關蛋白表達情況,探討了雙氫青蒿素對肝纖維化的影響及可能作用機制,為防治肝纖維化的新藥開發提供新策略。
1 實驗材料與方法
1.1實驗動物 Sprague Dawley品系SPF級雄性大鼠30只,12周齡,體重200~250 g,購自河北醫科大學實驗動物中心,許可證號: SCXK(冀) 2021-6011。飼養于溫度為(22±2)℃、濕度為50%~60%、無特殊病原體的動物房中,自由攝入水和飼料,動物實驗方法、處置手段符合人類公認的道德倫理標準和國際慣例。
1.2主要藥物、試劑 雙氫青蒿素源自西安展迅生物公司(ZX-ZWTQW-0002),預先溶于0.6%的二甲基亞砜溶液中,置于冰箱冷藏,給藥時用適量的生理鹽水調配為所需濃度。Ⅰ型膠原、α-平滑肌肌動蛋白(α-SMA)、NLRP3、半胱氨酸天門冬氨酸酶1(Caspase-1)、白細胞介素-1β(IL-1β)一抗、二抗試劑購自上海莼試生物公司,細菌基因組DNA提取試劑盒(DP328-02,西安齊岳生物公司),SYBR?Premix Ex TaqTM(RR420A,上海拓然生物科技有限公司)。
1.3實驗方法 將大鼠隨機分為假手術組、肝纖維化組及雙氫青蒿素組,每組10只。肝纖維化組和雙氫青蒿素組參考文獻[7-8]方法建立肝纖維化模型:腹腔注射30 mg/kg戊巴比妥鈉麻醉大鼠,剖開下腹中部,完全暴露膽總管及其相連的部分十二指腸,將膽總管與周圍組織分離,用手術線結扎后縫合腹部切口;假手術組分離膽總管與周圍組織,留線而不結扎,縫合腹部切口。手術過程無菌操作,術后常規飼養。自術后第15天起,雙氫青蒿素組大鼠給予20 μg/g的雙氫青蒿素溶液5 mL灌胃,假手術組和肝纖維化組大鼠給予含0.6%的二甲基亞砜生理鹽水5 mL灌胃,均1次/d,連續灌胃2周。
1.4檢測指標及方法
1.4.1肝組織病理形態 末次灌胃結束后第2天,腹腔注射戊巴比妥鈉麻醉各組大鼠,取部分肝臟,4%多聚甲醛固定后,進行脫水、透明、包埋,切為5 μm厚的組織片,然后依次經過脫蠟、濃度遞減酒精至水、堿性蘇木精染色、自來水漂洗、酸性伊紅染色、自來水漂洗、透明及晾干封片,顯微鏡下觀察肝組織形態。
1.4.2腸道菌群含量 取各組大鼠盲腸里存留的內容物0.2 g,放入無菌離心管里,存于液氮中,利用DNA檢測盒分離出符合標準純度的全部DNA,明確DNA的含量,置于-80 ℃冰箱中。采用16S rDNA分析乳酸桿菌、雙歧桿菌、大腸桿菌的基因序列,設計3種菌群的引物序列。大腸桿菌的正向引物序列為5’-CCCTTATTGTTAGTTGCCAT-3’,反向引物為5’-ACTCGTTGTACTTCCCATTG-3’,乳酸桿菌正向引物為5’-CACCGCTACACATGGAG-3’,反向引物為5’-AGCAGTAGGGAATCTTCCA-3’,雙歧桿菌正向引物為5’-TCGCGTCYGGTGTGAAAG-3’,反向引物為5’-CCACATCCAGCRTCCAC-3v。根據熒光定量檢測試劑盒的要求制備所需的擴增反應試劑和設置相應合適的反應條件。最后以2-△△CT方法計算目標細菌量。
1.4.3肝組織中相關蛋白表達情況 采用Western blot法檢測:取各組大鼠適量肝組織,研磨機中磨為漿液, 4 ℃下滴加適量裂解液充分裂解,分離其中的總蛋白并進行定量。少許蛋白中滴加適量上樣緩沖液混勻,浸入沸水中進行熱變性,移置預先制備的固態凝膠孔中,設置電泳槽恒壓狀態下進行電泳,利用轉膜儀將膠中的指定蛋白移至薄膜中,浸入無脂奶粉溶液作用2h,分別浸入配好濃度的Ⅰ型膠原(1∶500)、α-SMA(1∶500)、NLRP3(1∶600)、Caspase-1(1∶800)、IL-1β(1∶600)一抗溶液,4℃冰箱中過夜,洗膜后浸入濃度1∶800的二抗溶液,室溫作用2 h,洗膜。在避光的條件下滴加顯影試劑,定影后掃描膜中蛋白條帶的灰度值,采用Image J軟件計算每組的平均值。
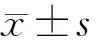
2 結 果
2.1各組大鼠肝臟組織形態 假手術組大鼠肝小葉輪廓可辨,小葉內的細胞呈索狀排列,未見變性與壞死,小葉周圍的匯管區結締組織和管道結構正常。肝纖維化組大鼠肝小葉輪廓破壞,其內可見面積不等的壞死區域,中性粒細胞、淋巴細胞數量增多,匯管區面積增大,其內的結締組織增生、小膽管數量增多;與肝纖維化組比較,雙氫青蒿素組大鼠肝小葉內的壞死區面積縮小,中性粒細胞、淋巴細胞數量減少,匯管區結締組織和小膽管數量均減少。見圖 1。

圖1 各組大鼠肝臟組織HE染色表現(×200)
2.2各組大鼠腸道菌群定量 與假手術組比較,肝纖維化組腸道內大腸桿菌相對表達量增加(P<0.05),雙歧桿菌、乳酸桿菌相對表達量減少(P均<0.05);與肝纖維化組比較,雙氫青蒿素組腸道內大腸桿菌相對表達量減少(P<0.05),雙歧桿菌、乳酸桿菌相對表達量增加(P均<0.05)。見表1。
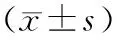
表1 各組大鼠腸道菌群中大腸桿菌、雙歧桿菌、乳酸桿菌相對表達量比較
2.3各組大鼠肝組織中Ⅰ型膠原、α-SMA蛋白表達情況 肝纖維化組肝組織中Ⅰ型膠原、α-SMA蛋白相對表達量均明顯高于假手術組(P均<0.05),雙氫青蒿素組肝組織中Ⅰ型膠原、α-SMA蛋白相對表達量均明顯低于肝纖維化組(P均<0.05)。見圖2和表2。
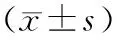
表2 各組大鼠肝組織中纖維化因子蛋白相對表達量比較

圖2 各組大鼠肝組織中纖維化因子蛋白表達灰色條帶
2.4各組大鼠肝組織中NLRP3炎性小體相關蛋白表達情況 肝纖維化組肝組織中NLRP3、Caspase-1、IL-1β蛋白相對表達量均明顯高于假手術組(P均<0.05),雙氫青蒿素組肝組織中NLRP3、Caspase-1、IL-1β蛋白相對表達量均明顯低于肝纖維化組(P均<0.05)。見圖3和表3。
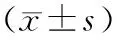
表3 各組大鼠肝組織中NLRP3炎性小體相關蛋白相對表達量比較

圖3 各組大鼠肝組織中NLRP3炎性小體相關蛋白表達灰色條帶
3 討 論
肝纖維化是許多慢性肝臟疾病進展為肝硬化的共有病程階段,其具有可逆性的特點,但其發病機制尚在探索中,至今無特效的防治措施[9]。本實驗采用結扎膽總管的方法制備肝纖維化模型,因膽總管結扎造成肝外膽管阻塞,膽汁淤積在肝內的小膽管內,短期內造成小膽管代償性的管腔擴張和增生,持續一段時間后,膽汁溢出至肝實質中,壓迫其周圍的血管,肝細胞缺乏氧氣和營養先后出現變性、壞死,肝小葉的正常結構遭到破壞;肝星狀細胞受刺激后表型和活性發生變化,表達α-SMA增多并分泌大量的I型膠原等基質成分[10-11],小葉周圍的結締組織異常增生,并伸入到小葉內部,圍繞在壞死的肝細胞周圍,肝組織形成纖維化改變。
本實驗中肝纖維化組大鼠肝組織損傷,肝組織中Ⅰ型膠原、α-SMA蛋白表達增加,說明該造模方法可造成肝纖維化;雙氫青蒿素組肝組織損傷較輕,肝組織中Ⅰ型膠原、α-SMA蛋白表達量減少,說明雙氫青蒿素可逆轉肝纖維化。
目前研究證實,肝臟疾病的發生、進展與腸道菌群的種類、數量密切相關[12-13]。肝臟與腸道在結構、功能方面均存在著相互聯系,正常生理狀態下,腸肝的這種相互作用維護著腸道菌群的穩態,對機體起到一種免疫防御作用。膽汁是重要的腸道菌群調節物質,膽管結扎造成膽汁代謝紊亂,不僅損傷肝組織結構和功能,而且也損傷腸道內的黏膜屏障,增加毒性物質如有害細菌及其產物、內毒素等透過此屏障進入門靜脈運送到肝臟的機會,進一步加重肝組織的炎癥和纖維化病變,使其病程加速進展[14-15]。Alaish等[16]研究發現,小鼠行膽總管結扎術后14 d其腸道內的菌群種類及數量均發生了變化。楊博文等[17]的實驗顯示雄性小鼠結扎膽總管后2周,腸道內的特定菌群數量發生變化,肝臟功能降低,肝組織發生纖維化病變。本實驗結果顯示,肝纖維化組大鼠腸道內大腸桿菌的含量增加,雙歧桿菌、乳酸桿菌的含量減少,證實肝纖維化可導致腸道菌群變化;雙氫青蒿素組大腸桿菌的含量減少,雙歧桿菌、乳酸桿菌的含量增加,提示雙氫青蒿素可調節腸道菌群。
NLRP3炎性小體為和炎癥反應密切相關的復合體,其成員主要有NLRP3、ASC接頭蛋白以及Caspase-1酶前體[18]。它常位于機體各組織中的單核吞噬細胞系統、嗜中性粒細胞及淋巴細胞的胞質中,當這些細胞遇到相應的刺激時,通過對應的信號轉導途徑會使此炎性小體合成和激活[19-20]。此小體激活后引發的組織炎性反應通路為促進肝纖維化發展的重要信號途徑,此途徑中釋放的活性IL-1β為炎性反應中起重要作用的生物因子,在組織炎癥的早期階段可造成肝組織結構損傷以及功能降低,加速肝纖維化的進展[21-22]。在采用血吸蟲誘導的小鼠肝纖維化組織里,發現NLRP3、Caspase-1及IL-1β的含量均增加,肝星狀細胞大量活化且數目增加,這說明NLRP3炎性小體的活化在肝纖維化病程進展中起關鍵作用,而采用一些方法抑制此炎性小體的表達和活性后,肝纖維化的程度減輕[23-24]。本實驗結果顯示,肝纖維化組肝組織中NLRP3、Caspase-1、IL-1β蛋白表達量明顯升高,而雙氫青蒿素組NLRP3、Caspase-1、IL-1β蛋白表達量均明顯降低。說明肝纖維化與NLRP3炎性小體活化密切相關,雙氫青蒿素可能通過抑制NLRP3炎性小體活化而減輕肝纖維化。
綜上所述,雙氫青蒿素可能通過調節肝纖維化大鼠腸道菌群,拮抗NLRP3炎性小體活化而減輕肝纖維化程度。
利益沖突:所有作者均聲明不存在利益沖突。

