異氟醚通過TLR4/JNK信號通路干預心肌梗死大鼠室性心律失常的作用機制研究
樊帥帥,宋磊軍,藺 聰
心肌梗死(myocardial infarction,MI)指因冠狀動脈狹窄或堵塞引起的心肌持續(xù)性缺血、缺氧性壞死[1]。心律失常及傳導障礙是心肌梗死的主要病理癥狀,也是導致心肌梗死發(fā)病率及死亡率增加的主要因素之一[2]。減少心肌梗死誘發(fā)的心律失常,對緩解心肌梗死病死率有重要意義。異氟醚是心臟搭橋手術(shù)過程中的常用麻醉劑,研究發(fā)現(xiàn)異氟醚對缺血心肌組織有保護作用且能降低惡性心律失常病人的病死率[3-5]。因此,異氟醚可能為緩解心肌梗死心律失常的潛在藥物,但其具體作用機制尚不明確。研究發(fā)現(xiàn),多種炎性因子不僅可造成心肌細胞炎性損傷,還可影響心肌細胞動作電位的改變及傳導,與心肌梗死后心律失常的發(fā)生發(fā)展密切相關(guān)[6]。Toll樣受體4(Toll-like receptor 4,TLR4)及c-Jun N末端激酶(c-Jun N-terminal kinase,JNK)通路是調(diào)控炎癥反應的關(guān)鍵通路,且參與調(diào)控心肌梗死后心肌細胞L-型鈣電流、細胞過度攣縮等過程,與心律失常的發(fā)生發(fā)展密切相關(guān)[7-8]。本研究建立大鼠心肌梗死模型,從TLR4/JNK信號通路探究異氟醚影響心肌梗死大鼠心律失常的可能機制。
1 材料與方法
1.1 實驗材料
1.1.1 動物及細胞來源 6~7周齡無特定病原體(SPF)級SD大鼠120只,體質(zhì)量180~200 g,購自甘肅中醫(yī)藥大學[許可證號為:SCXK(甘)2020-0001]。本實驗經(jīng)醫(yī)院動物護理和使用委員會(IACUC)批準(編號:105062)。
1.1.2 實驗試劑及儀器 異氟醚(貨號:JKLN010784a,上海經(jīng)科化學科技有限公司);蘇木精-伊紅(HE)及Masson染色試劑盒(貨號:AG1120、GMS80012,上海吉至生化科技有限公司、深圳子科生物科技有限公司);四氮唑紅染色法(TTC)染色試劑盒(貨號:YT8005,北京伊塔生物科技有限公司);Fluo-3/AM鈣熒光指示劑(貨號:70-F1243,杭州聯(lián)科生物技術(shù)股份有限公司);磷酸肌酸激酶(CK)試劑盒(貨號:XG-E98764,上海西格生物科技有限公司);磷酸肌酸激酶同工酶(CK-MB)試劑盒(貨號:GOY13667,上海谷研實業(yè)有限公司);乳酸脫氫酶(LDH)試劑盒(貨號:YS-E8189,上海研生實業(yè)有限公司);兒茶酚抑素(CST)及超敏C-反應蛋白(hs-CRP)等酶聯(lián)免疫吸附法(ELISA)試劑盒(貨號:BS-E11100R1,E02680,江蘇博深生物科技有限公司及上海瓦蘭生物科技有限公司);TLR4、JNK2、腫瘤壞死因子-α(TNF-α)、白細胞介素-β(IL-β)、核轉(zhuǎn)錄因子-κB(NF-κB)、磷酸化NF-κB(p-NF-κB)、鈣調(diào)蛋白激酶Ⅱ(CaMKⅡ)等抗體(均購自美國abcam公司,貨號:ab13556,ab76125、ab183218、ab254360、ab220803、ab239882、ab181052);PowerLab數(shù)據(jù)采集系統(tǒng)購自澳大利亞ADInstruments公司;Langendorff心臟灌流裝置購自濟南千司生物技術(shù)有限公司;L-420F生物機能實驗系統(tǒng)購自成都泰盟科技有限公司。
1.2 研究方法
1.2.1 大鼠心肌梗死模型建立及分組給藥 參照文獻[9]中的方法于大鼠左側(cè)第3肋、第4肋間開胸,暴露心臟,結(jié)扎左冠狀動脈前降支建立心肌梗死模型,當大鼠左心室心尖變白、心電圖ST段異常抬高或降低,表明造模成功。共造模成功100只大鼠,隨機分為模型組、異氟醚組、ad-TLR4組、ad-NC組、異氟醚+ad-TLR4組,每組20只。另選取大鼠20只,只暴露心臟,分離左冠狀動脈前降支但不結(jié)扎作為假手術(shù)組。所有大鼠術(shù)后連續(xù)3 d肌肉注射青霉素8×105U防止感染。參照文獻[4]中的方法,異氟醚組用麻醉呼吸機于術(shù)前30 min及術(shù)后每天給予異氟醚1.0個最低肺泡氣濃度(MAC)吸入(時間為30 min)進行干預處理;ad-TLR4組及ad-NC組于術(shù)前30 min及術(shù)后第3天,經(jīng)尾靜脈注射攜帶TLR4過表達序列的腺病毒載體溶液(50 μmol/L)及TLR4陰性對照序列的腺病毒載體溶液(50 μmoL/L);異氟醚+ad-TLR4組在異氟醚組基礎(chǔ)上于術(shù)前30 min及術(shù)后第3天經(jīng)尾靜脈注射給予攜帶TLR4過表達序列的腺病毒載體溶液(50 μmoL/L);假手術(shù)組及模型組于術(shù)前30 min及術(shù)后每天,用麻醉呼吸機給予等量不含異氟醚的空氣給予輔助呼吸。各組均于術(shù)后第7天給藥結(jié)束進行后續(xù)試驗。
1.2.2 血清學指標檢測 各組大鼠于術(shù)后第7天,麻醉取腹主動脈血3 mL,用自動生化分析儀聯(lián)合試劑盒法檢測血清CK、CK-MB、LDH水平,按ELISA試劑盒說明書方法檢測CST、hs-CRP水平。
1.2.3 心電圖參數(shù)及心律失常相關(guān)指標檢測 體表心電圖及離體灌流監(jiān)測記錄心電圖參數(shù)及心律失常相關(guān)指標。術(shù)后第7天,各組隨機選取大鼠6只,參照文獻[10]中的方法,通過Ⅱ?qū)?lián)體記錄2 h心電圖變化,并采用PowerLab數(shù)據(jù)分析系統(tǒng)記錄和分析QT間期、QTC間期、QRS波時限變化。分離心臟、4 ℃改良臺式液中去除殘血,將主動脈套在Langendorff心臟灌流裝置上灌流15 min(8 mL/min灌注流速,37 ℃恒溫,5.86 kPa恒壓,新鮮K-H液+95%氧氣+二氧化碳混合氣體逆行灌流),采用2個鉑金電機分別連接肺動脈圓錐及心尖部,通過L-420F生物機能實驗系統(tǒng),觀察記錄分析心律失常相關(guān)指標如單相動作電位時程(APD)復極至50%(APD 50)時程、90%(APD 90)時程、APD電交替、心室有效不應期(ERP)、室性心律失常誘發(fā)率等指標變化。
1.2.4 TTC染色法檢測心肌梗死面積 術(shù)后第7天,隨機選取各組大鼠6只,麻醉處死,取完整心臟,按TTC染色試劑盒說明書方法進行染色后,檢測心肌梗死面積(梗死部位為白色)。
1.2.5 HE及Masson染色檢測心肌組織病理變化 麻醉后處死剩余大鼠,取心臟,于冰上去除大血管及周圍組織,取左心室心肌組織分成3部分,一部分于液氮中冷凍后于-80 ℃冰箱保存?zhèn)溆?另一部分置于-80 ℃冰箱保存;剩余部分迅速置于4%多聚甲醛中固定24 h,透明、浸蠟、包埋后切成5 μm切片,取部分切片按HE及Masson試劑盒說明書方法染色后,置于顯微鏡下觀察組織病理變化。
1.2.6 免疫組化法檢測左心室組織TLR4、JNK2陽性表達水平 取1.2.5剩余切片,脫蠟及抗原修復后,加入一抗抗體(TLR4、JNK2,1∶200)37 ℃孵育3 h,加入二抗抗體IgG(1∶500)室溫孵育、蘇木精復染后,于顯微鏡下觀察拍照,并采用Image J軟件分析單位面積內(nèi)陽性表達的平均光密度值。
1.2.7 Ca2+熒光探針Fluo-3/AM法檢測心肌組織細胞Ca2+濃度 取液氮中冷凍后-80 ℃冰箱保存的心肌組織標本,制成20 μm冷凍切片,按Fluo-3/AM鈣熒光指示劑說明書方法染色后,用激光共聚焦顯微鏡在488~500 nm激發(fā)波長下,觀察心肌組織Ca2+的熒光強度,采用Image-RroPlus 6.0圖像處理系統(tǒng),測定標本單位面積內(nèi)熒光強度,以熒光強弱代表心肌組織細胞內(nèi)Ca2+的水平。
1.2.8 蛋白免疫印跡法(Western Blot)法檢測左心室心肌組織中TNF-α、IL-β、NF-κB、p-NF-κB、CaMKⅡ蛋白表達 取1.2.5中-80 ℃冰箱保存的左心室心肌組織,4 ℃解凍后取100 mg,加入裂解液勻漿提取蛋白,二喹啉甲酸(BCA)法檢測蛋白濃度,取50 μg蛋白上樣,行電泳、轉(zhuǎn)膜反應,加入一抗TNF-α、IL-β、NF-κB、p-NF-κB、CaMKⅡ抗體(1∶800)、內(nèi)參β-actin(1∶1 000)抗體,4 ℃孵育過夜,加入羊抗兔辣根過氧化物酶(HRP)二抗(1∶1 500),37 ℃孵育1.5 h,增強化學發(fā)光法顯色后,用化學發(fā)光儀顯影曝光,以Image J軟件分析蛋白相對表達水平。
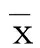
2 結(jié) 果
2.1 各組大鼠一般行為變化比較 假手術(shù)組大鼠無死亡、行為活動正常。模型組、ad-NC組、異氟醚+ad-TLR4組大鼠均有2只死亡,且活動量減少。異氟醚組大鼠無死亡,活動量有所增加。ad-TLR4組大鼠有4只死亡,活動量及飲食進一步減少。
2.2 各組大鼠心肌梗死面積比較 與假手術(shù)組比較,模型組大鼠心肌梗死面積增加(P<0.05)。與模型組比較,異氟醚組大鼠心肌梗死面積較少(P<0.05),ad-TLR4組大鼠心肌梗死面積進一步增加(P<0.05)。與異氟醚組比較,ad-TLR4組、ad-NC組、異氟醚+ad-TLR4組大鼠心肌梗死面積均增加(P<0.05)。與ad-TLR4組比較,異氟醚+ad-TLR4組、ad-NC組大鼠心肌梗死面積減少(P<0.05)。詳見圖1、表1。
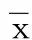
表1 各組大鼠心肌梗死面積比較(±s) 單位:%

圖1 大鼠心肌梗死面積TTC染色圖
2.3 各組大鼠心肌損傷血清標志物水平比較 與假手術(shù)組比較,模型組大鼠CK、CK-MB、LDH水平均升高(P<0.05)。與模型組比較,異氟醚組CK、CK-MB、LDH水平均降低(P<0.05);ad-TLR4組CK、CK-MB、LDH水平均進一步升高(P<0.05)。與異氟醚組比較,ad-TLR4組、ad-NC組、異氟醚+ad-TLR4組CK、CK-MB、LDH水平均升高(P<0.05)。與ad-TLR4組比較,異氟醚+ad-TLR4組、ad-NC組CK、CK-MB、LDH水平均降低(P<0.05)。詳見表2。
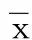
表2 各組大鼠心肌損傷血清標志物水平比較(±s) 單位:U/L
2.4 各組大鼠血清CST、hs-CRP水平比較 與假手術(shù)組比較,模型組大鼠血清CST、hs-CRP水平均升高(P<0.05)。與模型組比較,異氟醚組大鼠血清CST、hs-CRP水平均降低(P<0.05);ad-TLR4組大鼠血清CST、hs-CRP水平均進一步升高(P<0.05)。與異氟醚組比較,ad-TLR4組、ad-NC組、異氟醚+ad-TLR4組CST、hs-CRP水平均升高(P<0.05)。與ad-TLR4組比較,異氟醚+ad-TLR4組、ad-NC組CST、hs-CRP水平均降低(P<0.05)。詳見表3。
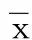
表3 各組大鼠血清CST、hs-CRP水平比較(±s) 單位:pg/mL
2.5 各組大鼠心電圖參數(shù)比較 與假手術(shù)組比較,模型組大鼠心電圖參數(shù)QT間期、QTC間期、QRS波時限均延長(P<0.05)。與模型組比較,異氟醚組大鼠心電圖參數(shù)QT間期、QTC間期、QRS波時限均縮短(P<0.05);ad-TLR4組大鼠心電圖參數(shù)QT間期、QTC間期、QRS波時限均進一步延長(P<0.05)。與異氟醚組比較,ad-TLR4組、ad-NC組、異氟醚+ad-TLR4組大鼠心電圖參數(shù)QT間期、QTC間期、QRS波時限均延長(P<0.05)。與ad-TLR4組比較,異氟醚+ad-TLR4組、ad-NC組大鼠心電圖參數(shù)QT間期、QTC間期、QRS波時限均縮短(P<0.05)。詳見表4。
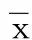
表4 各組大鼠QT間期、QTC間期、QRS波時限變化比較(±s) 單位:ms
2.6 各組大鼠ERP、APD 50、APD 90、APD電交替及室性心律失常誘發(fā)率比較 與假手術(shù)組比較,模型組大鼠ERP、APD 50、APD 90、APD電交替均延長,室性心律失常誘發(fā)率升高(P<0.05)。與模型組比較,異氟醚組大鼠ERP、APD 50、APD 90、APD電交替均縮短,室性心律失常誘發(fā)率降低(P<0.05);ad-TLR4組大鼠ERP、APD 50、APD 90、APD電交替均進一步延長,室性心律失常誘發(fā)率進一步升高(P<0.05)。與異氟醚組比較,ad-TLR4組、ad-NC組、異氟醚+ad-TLR4組ERP、APD 50、APD 90、APD電交替均延長,室性心律失常誘發(fā)率升高(P<0.05)。與ad-TLR4組比較,異氟醚+ad-TLR4組、ad-NC組ERP、APD 50、APD 90、APD電交替均縮短,室性心律失常誘發(fā)率均降低(P<0.05)。詳見表5。
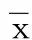
表5 各組大鼠ERP、APD 50、APD 90、APD電交替及室性心律失常誘發(fā)率比較(±s)
2.7 各組大鼠心肌組織病理變化比較 假手術(shù)組心肌細胞結(jié)構(gòu)正常。模型組HE染色可見心肌組織細胞間隙縮小、纖維組織增生、炎性浸潤明顯;Masson染色可見心肌組織膠原纖維沉積嚴重。異氟醚組大鼠心肌內(nèi)纖維組織增生、炎性浸潤及膠原沉積等病理損傷緩解明顯。ad-TLR4組大鼠心肌內(nèi)纖維組織增生、炎性浸潤及膠原沉積等病理損傷進一步加重。ad-NC組、異氟醚+ad-TLR4組大鼠心肌組織病理變化與模型組相近。詳見圖2。

圖2 各組大鼠心肌HE及Masson染色圖(×200)
2.8 各組大鼠心肌組織Ca2+水平、TLR4及JNK2陽性表達比較 免疫熒光顯示,假手術(shù)組心肌組織細胞有少量顯綠色熒光。免疫組化染色顯示,TLR4及JNK2在心肌組織細胞胞漿中呈弱陽性表達。與假手術(shù)組比較,模型組大鼠心肌組織細胞Ca2+水平熒光染色強度、TLR4及JNK2陽性表達均升高(P<0.05)。與模型組比較,異氟醚組大鼠Ca2+水平熒光染色強度、TLR4及JNK2陽性表達均降低(P<0.05);ad-TLR4組大鼠Ca2+水平熒光染色強度、TLR4及JNK2陽性表達均進一步升高(P<0.05)。與異氟醚組比較,ad-TLR4組、ad-NC組、異氟醚+ad-TLR4組大鼠心肌組織細胞Ca2+水平熒光染色強度、TLR4及JNK2陽性表達均升高(P<0.05)。與ad-TLR4組比較,異氟醚+ad-TLR4組、ad-NC組大鼠心肌組織細胞Ca2+水平熒光染色強度、TLR4及JNK2陽性表達均降低(P<0.05)。詳見圖3、表6。
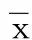
表6 各組大鼠心肌組織Ca2+水平、TLR4及JNK2陽性表達比較(±s)

圖3 各組大鼠心肌組織Ca2+熒光染色、TLR4及JNK2免疫組化染色圖(×400)
2.9 各組大鼠心肌組織TNF-α、IL-β、NF-κB、p-NF-κB、CaMKⅡ蛋白表達比較 與假手術(shù)組比較,模型組大鼠TNF-α、IL-β、p-NF-κB/NF-κB、CaMKⅡ蛋白表達均升高(P<0.05)。與模型組比較,異氟醚組大鼠TNF-α、IL-β、p-NF-κB/NF-κB、CaMKⅡ蛋白表達降低(P<0.05);ad-TLR4組大鼠TNF-α、IL-β、p-NF-κB/NF-κB、CaMKⅡ蛋白表達均進一步升高(P<0.05)。與異氟醚組比較,ad-TLR4組、ad-NC組、異氟醚+ad-TLR4組TNF-α、IL-β、p-NF-κB/NF-κB、CaMKⅡ蛋白表達均升高(P<0.05)。與ad-TLR4組比較,異氟醚+ad-TLR4組、ad-NC組TNF-α、IL-β、p-NF-κB/NF-κB、CaMKⅡ蛋白表達均降低(P<0.05)。詳見圖4、表7。
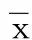
表7 各組大鼠心肌組織TNF-α、IL-β、p-NF-κB/NF-κB、CaMKⅡ蛋白表達比較(±s)

圖4 各組心肌組織TNF-α、IL-β、p-NF-κB、NF-κB、CaMKⅡ蛋白表達條帶圖(A為假手術(shù)組;B為模型組;C為異氟醚組;D為ad-TLR4組;E為異氟醚+ad-TLR4組;F為ad-NC組)
3 討 論
心肌梗死是心血管系統(tǒng)常見疾病,多以冠狀動脈狹窄及堵塞為誘因[11]。本研究結(jié)扎大鼠左心室冠狀動脈前降支,模擬人心肌梗死模型后發(fā)現(xiàn),大鼠出現(xiàn)死亡現(xiàn)象,且心肌損傷標志物CK、CK-MB、LDH水平升高及心肌梗死面積增大,心肌組織炎性浸潤及心肌纖維化損傷加重,提示造模成功。心肌梗死一段時間后,可引起心肌細胞電生理紊亂、代謝紊亂及心律失常的發(fā)生[12]。Wu等[13]研究表明,心律失常是心肌梗死的常見并發(fā)癥,也是導致心肌梗死病人死亡率增加的關(guān)鍵誘因。心電圖及血清學指標是臨床診斷心肌梗死后心律失常的主要方法。Zang等[14]研究顯示,QT間期延長可反映心室復極延緩,導致心室肌傳導性和自律性改變,引起心室易損期延長,誘發(fā)各種室性心律失常,導致心源性猝死的發(fā)生,且QT間期延長與心肌梗死室性心律失常的發(fā)生密切相關(guān)。魏澗琦等[15-16]研究表明,惡性心律失常的發(fā)生隨CST、hs-CRP水平的升高而升高,CST、hs-CRP可能作為心肌梗死病人心律失常的潛在生物學指標。本研究結(jié)果顯示,心肌梗死大鼠心電圖參數(shù)QT間期、QTC間期、QRS波時限均延長,血清CST、hs-CRP水平也異常升高,預示心肌梗死大鼠出現(xiàn)心律失常。異氟醚為手術(shù)中常用麻醉劑,研究證實,其對心肌缺血損傷有一定的保護作用[17]。臨床研究顯示,異氟醚預處理可延緩心臟手術(shù)病人QT期延長,延緩心肌梗死病人QT離散性猝死[3,5]。本研究結(jié)果顯示,異氟醚預處理后,大鼠心肌梗死面積及心肌損傷程度在得到明顯改善的同時,大鼠心電圖參數(shù)QT間期、QTC間期、QRS波時限均縮短,血清CST、hs-CRP水平也明顯降低,提示異氟醚預處理可明顯緩解心肌梗死大鼠心律失常的發(fā)生。
APD電交替是惡性心律失常的決定性因素[18]。研究顯示,炎性因子與心肌梗死心律失常的發(fā)生密切相關(guān)[6]。TNF-α可使動作電位滯留在平臺期,使APD延長,造成傳導異常及心律失常的發(fā)生[9]。Wang等[19]研究發(fā)現(xiàn),心肌缺血犬左側(cè)星狀神經(jīng)節(jié)內(nèi)注射IL-β可降低ERP,改變復極化離散度,誘導室性心律失常的發(fā)生。Liu等[20]研究發(fā)現(xiàn),降低炎性因子IL-β表達,可降低心肌細胞內(nèi)Ca2+濃度,降低跨膜電位,改善心臟傳導功能,降低室性心律失常的發(fā)生率。本研究發(fā)現(xiàn),大鼠心肌組織中IL-β、TNF-α水平升高的同時,APD延長、ERP升高、心肌細胞內(nèi)Ca2+升高,提示心肌梗死心律失常發(fā)生可能與炎性因子分泌水平升高有關(guān)。異氟醚預處理后,大鼠IL-β、TNF-α水平降低,APD縮短,ERP降低,心肌細胞內(nèi)Ca2+降低,提示異氟醚降低心肌梗死大鼠心律失常的作用,可能與抑制炎性因子水平的升高有關(guān)。
TLR4及JNK通路可調(diào)控炎性因子表達,參與心肌梗死心肌損傷過程,且與心律失常的發(fā)生發(fā)展關(guān)系密切。研究表明,TLR4可與髓樣分化蛋白88(MyD88)結(jié)合,激活胞內(nèi)轉(zhuǎn)導通路,促進NF-κB、JNK等多種轉(zhuǎn)導通路表達參與細胞凋亡、炎性反應等生理過程[21]。蔡文科等[22]研究發(fā)現(xiàn),心肌缺血后,心臟應激反應可激活TLR4介導NF-κB下游炎性因子如IL-β、TNF-α的釋放,誘導心肌缺血的發(fā)生,且TLR4/NF-κB通路激活還可能與內(nèi)源性Ca2+釋放水平及心肌細胞收縮力增強、心律失常發(fā)生風險增加有關(guān)。Yan等[8]研究發(fā)現(xiàn),JNK激活可硬性影響舒張期細胞內(nèi)Ca2+活性,調(diào)控CaMKⅡ表達,促進心室收縮及心房顫動的發(fā)生而加重心律失常發(fā)生的風險。本研究結(jié)果顯示,IL-β、TNF-α水平及Ca2+升高的同時,TLR4、JNK在心肌細胞胞漿中表達顯著升高,其下游調(diào)控因子p-NF-κB、CaMKⅡ表達也顯著升高,進一步上調(diào)TLR4表達后,心肌梗死大鼠死亡、心肌梗死面積及與心律失常有關(guān)的心電圖指標及血清學指標均進一步升高,APD、ERP升高、心肌細胞內(nèi)Ca2+等均進一步升高,提示上調(diào)TLR4可促進心肌梗死大鼠心肌損傷及心律失常的發(fā)生。異氟醚組大鼠出現(xiàn)TLR4、JNK、p-NF-κ-B、CaMKⅡ通路蛋白表達降低,提示異氟醚降低心肌梗死大鼠心律失常作用,可能與抑制TLR4/JNK通路激活有關(guān)。另外,異氟醚組大鼠心肌梗死面積、死亡及心肌損傷程度,心肌組織中IL-β、TNF-α水平以及APD、ERP和心肌細胞內(nèi)Ca2+水平較ad-TLR4組和ad-NC組低,且上調(diào)TLR4可逆轉(zhuǎn)異氟醚的上述作用。
綜上所述,異氟醚可能通過抑制TLR4/JNK通路激活,降低炎癥水平及細胞內(nèi)Ca2+釋放水平,減少心律失常的發(fā)生并緩解心肌梗死大鼠心肌損傷。但心律失常相關(guān)機制復雜,涉及多條通路、多個細胞因子共同調(diào)節(jié),異氟醚降低心肌梗死大鼠心律失常作用的還需繼續(xù)深入研究。

