多組學分析LARP1在泛癌中的表達及其與患者預后、腫瘤微環境的關系
劉 鑫,胡福境,蘇 穎,曾毅飛,潘芳蓮,覃桂聰
(廣西醫科大學附屬武鳴醫院消化內科,廣西 南寧 530199)
RNA 結合蛋白(RBP) 具有高度動態的時空調控作用和重要的生物學功能,它們通過轉錄后控制RNA 的加工和運輸,包括調節RNA 剪接、聚腺苷酸化、mRNA 穩定性、mRNA 定位和翻譯,對維持轉錄組穩定至關重要[1]。人類RBPs 約有2000 種,占蛋白質編碼基因的7.5%。越來越多的研究表明,RBPs 介導的RNA 修飾在癌癥進展中具有重要作用,它們可在不同類型的癌癥中異常表達,同時可調節癌基因和抑癌基因的表達和功能[2]。La 相關蛋白1 (LARP1) 是一種進化保守的RNA 結合蛋白,屬于LARP 超家族的一員。它在果蠅體內首次被發現,被證明可與聚腺苷酸結合蛋白(PABP) 結合,是胚胎發育和生育所必需的RNA 結合蛋白。研究表明,LARP1 是哺乳動物雷帕霉素靶蛋白(mTOR) 通路與TOP mRNA 調控之間的重要的鏈接蛋白,是mTORC1 的底物,通過它的多個結構域如LaM、RRM-L、PABP 結合域、DM15 域的mRNA 結合,既可以調節以5′末端寡核苷酸( 5′TOP)基序為特征的mRNA 的穩定性和轉譯,也可與某些5′TOP mRNA 的3′ 端多聚A 尾結合調節mRNA 的功能[3]。在宮頸癌、乳腺癌、肝癌、肺癌等多種癌癥中,LARP1 的高表達與臨床轉歸之間的關系密切[4-6]。雖然研究表明LARP1 在多種腫瘤中均有促癌的作用,但目前仍缺乏它在泛癌中作用及相關機制的分析。因此,本研究運用多種數據庫對LARP1 的功能進行了系統分析,利用多組學數據證明LARP1 是影響患者腫瘤發生和臨床預后的關鍵分子,也是泛癌微環境中的關鍵調控因子。
1 資料與方法
1.1 基于TIMER 數據庫分析LARP1 在腫瘤組織中的表達譜
TIMER 2.0(http://timer.cistrome.org/)是一個分析各種癌癥中免疫細胞浸潤的在線資源數據庫。該數據庫采用反卷積方法作為統計方法,可從基因表達譜中推斷腫瘤組織中免疫細胞的浸潤豐度。本研究主要是應用Cancer Exploration 模塊中的 Gene_DE 模塊分析LARP1 在33 種TCGA 數據庫腫瘤組織中的表達。
1.2 不同腫瘤組織中LARP1 蛋白的表達水平以及啟動子甲基化水平
應用UALCAN 數據庫(http://ualcan.path.uab.edu/)分析LARP1 在乳腺癌 (BRCA)、卵巢癌 (OV)、結腸癌(COAD)、腎透明細胞癌(KIRC)、子宮內膜癌(UCEC)和肺腺癌 (LUAD)組織中的表達情況及甲基化情況。
1.3 LARP1 基因在 腫瘤中的改變情況
應用cBioPortal 數據庫(https://www.cbioportal.org/)分析LARP1 在腫瘤中的改變情況。
1.4 分析LARP1 與腫瘤臨床病理分期的關系
應用R 語言(3.6.3 版本)ggplot2(3.3.3 版本)R 包對TCGA 數據庫中的腫瘤數據進行分析,應用多重假設檢驗(Dunn’s test) 法分析LARP1 在不同腫瘤分期中的意義。
1.5 預后分析
根據Kaplan-Meier 曲線分析29 種癌癥中LARP1表達與患者預后〔包括總生存期(OS)、疾病特異性生存期(DSS)〕之間的關系。應用單因素生存分析法計算危險比(HRs) 和95% 置信區間。
1.6 腫瘤中LARP1 與免疫細胞浸潤的相關性
采用TCGA 數據庫的數據,應用R 語言(3.6.3 版本)GSVA 包(1.34.0 版本)(H?nzelmann et al, 2013) 中的ssGSEA 分析各種腫瘤中LARP1 與24 種免疫細胞浸潤的相關性,結果以熱圖顯示。
1.7 腫瘤中LARP1 與免疫檢查點的相關性分析
采用SangerBox 數據庫,對LARP1 蛋白表達水平與免疫檢查點基因表達水平的相關性進行分析。在UCSC(https://xenabrowser.net/) 數據庫中下載經統一標準化的泛癌數據集:TCGA TARGET GTEx(PANCAN,N=19131,G=60499), 進一步從中提取LARP1 基因和60 個兩類免疫檢查點途徑基因Inhibitory(24)、Stimulatory(36),對每一個表達值進行log2(x+0.001) 變換,計算LARP1 與免疫途徑標記基因的pearson 相關性。
2 統計分析
采用R 軟件包(3.6.3 版本)進行統計學分析。采用Mann-Whitney U 檢驗法分析LARP1 mRNA 在泛癌中的表達情況,將Survival 包(3.2-10 版本)用于生存治療分析,采用Bonferroni 法校正的顯著性水平多重假設檢驗(Dunn’s test) 法分析LARP1 與病理分期的相關性,將GSVA 包(1.34.0 版本) 用于免疫浸潤關聯性分析。
3 結果
3.1 泛癌中LARP1 mRNA 的表達水平
TIMER 數據庫分析結果顯示,相較于正常組織,LARP1 在 BLCA、BRCA、CHOL、COAD、HNSC、KICH、LIHC、LUAD、LUSC、PRAD、STAD中的表達明顯升高,差異有統計學意義(P<0.05);在GBM、KIRP、THCA 中的表達明顯減低(P<0.05)。見圖1。
3.2 不同腫瘤組織中LARP1 蛋白的表達水平以及DNA 甲基化水平
利用UALCAN 數據庫 CPTAC 模塊分析 9 種癌組織中LARP1 蛋白的表達水平。與癌旁正常組織比較,LIHC、OV、COAD、BRCA、KIRC、LUAD 、UCEC組織中 LARP1 蛋白的表達水平明顯升高 (P<0.01),GBM 和PAAD 組織中LARP1 蛋白的表達水平明顯降低(P<0.01)( 見圖2)。DNA 甲基化分析也發現,在 BRCA、CHOL、COAD、LUAD、UCEC 等腫瘤組織中LARP1 DNA 甲基化水平顯著降低(見圖3)。

圖2 CPTAC 數據庫分析LARP1 蛋白在腫瘤和正常組織中的表達水平
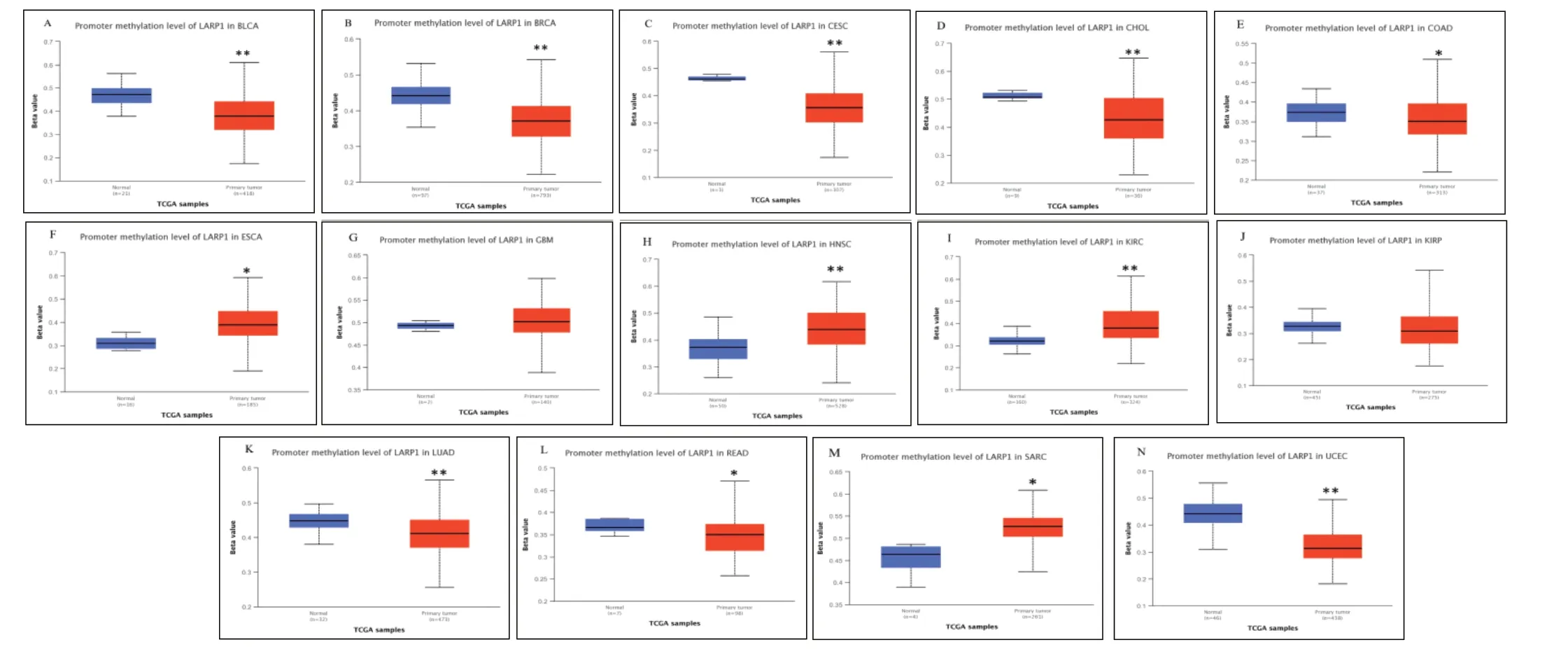
圖3 TCGA 數據庫分析LARP1 蛋白在腫瘤中LARP1 啟動子甲基化的水平
3.3 LARP1 基因在腫瘤中的改變情況
使用cBioPortal (TCGA, pan-cancer Atlas)數據庫研究LARP1 基因在泛癌中改變情況的結果顯示,子宮內膜癌LARP1 基因突變率最高,達7.51% ;幾乎所有的腫瘤中都存在LARP1 基因突變的情況(見圖4a),LARP1 基因突變明顯影響腫瘤患者的總體生存率(見圖4b)。
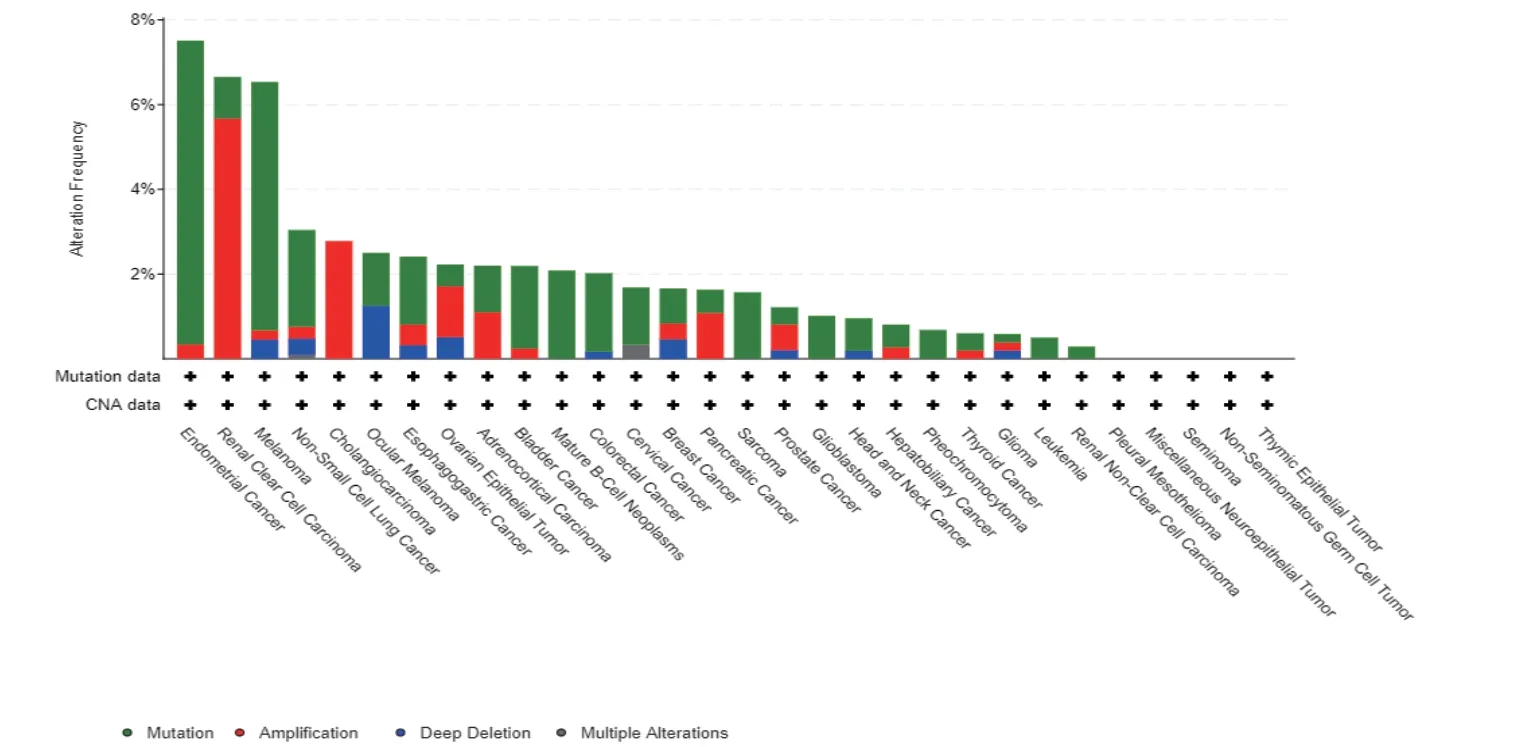
圖4a LARP1 基因在泛癌中的改變情況

圖4b LARP1 基因改變對腫瘤患者總體生存率的影響
3.4 LARP1 與腫瘤病理分期的關系
應用R 語言(3.6.3 版本)ggplot2(3.3.3 版本)R 包對TCGA 數據庫中的不同病理分期(Stage Ⅰ、Ⅱ、Ⅲ、Ⅳ)的腫瘤數據進行分析,觀察LARP1 與腫瘤分期的關系,結果發現LARP1 表達升高與LIHC、LUAD、SKCM、LUSC、ACC、STAD、THCA 病理分期明顯相關(見圖5)。

圖5 LARP1 與腫瘤病理分期的關系
3.5 LARP1 表達與癌癥患者預后之間的關系
生存分析結果顯示,LARP1 與ACC、BRCA、CESC、HNSC、KIRC、LAML、LGG、LIHC、LUAD、LUSC、OV、PAAD、SKCM、UCEC、UVM 患者的總生存期明顯相關;其中LARP1 的高表達與ACC、BRCA、CESC、LGG、LIHC、LUAD、LUSC、OV、PAAD、SKCM、UCEC、UVM、HNSC 預后差明顯相關(見圖6a)。疾病特異性生存期(DSS)方面的結果顯示LARP1的表達情況影響了ACC、BRCA、CESC、KIRC、KIRP、LGG、LIHC、LUAD、LUSC、OV、PAAD、SKCM、UVM 13 種腫瘤的DSS(見圖6b)。
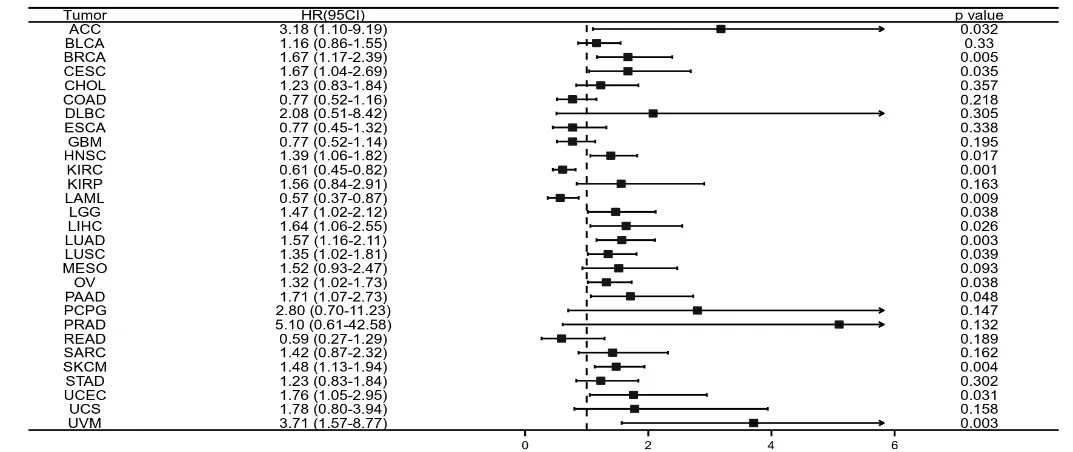
圖6a LARP1 表達與腫瘤OS 的關系

圖6b LARP1 表達與腫瘤DSS 的關系
3.6 LARP1 與免疫細胞浸潤的關系
R 語言分析結果顯示,LARP1 的表達水平與ACC、BLCA、BRCA、CESC、COAD 等19 種腫瘤組織中免疫細胞(活化的樹突狀細胞、B 細胞、CD8+T淋巴細胞、細胞毒性細胞、樹突狀細胞、嗜酸性粒細胞、免疫性樹突狀細胞、巨噬細胞、肥大細胞、中性粒細胞、NK 細胞亞群CD56bright、NK 細胞亞群CD56dim、NK 細胞、漿細胞樣DC 細胞、T 淋巴細胞、輔助性T淋巴細胞、中央記憶性T 淋巴細胞、濾泡輔助性T 淋巴細胞、γδT 細胞、Th1 細胞、Th17 細胞、Th2 細胞和調節性T 淋巴細胞)的表達水平有明顯的相關性(0 <r<1,P<0.01)。其中與輔助性T 淋巴細胞、中央記憶性T 淋巴細胞、Th2 細胞在大多數腫瘤中呈正相關(見圖7)。
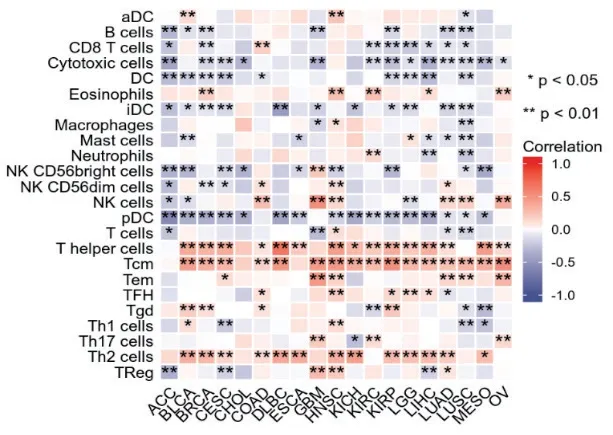
圖7 各種腫瘤中LARP1 表達與免疫細胞浸潤的相關性
3.7 LARP1 蛋白表達水平與免疫檢查點基因表達的相關性
采用SangerBox 數據庫,對LARP1 蛋白表達水平與免疫檢查點基因表達水平的相關性進行分析,結果如圖8 所示。LARP1 在眾多腫瘤中與刺激性和抑制性免疫檢查點的表達均有顯著的相關性。
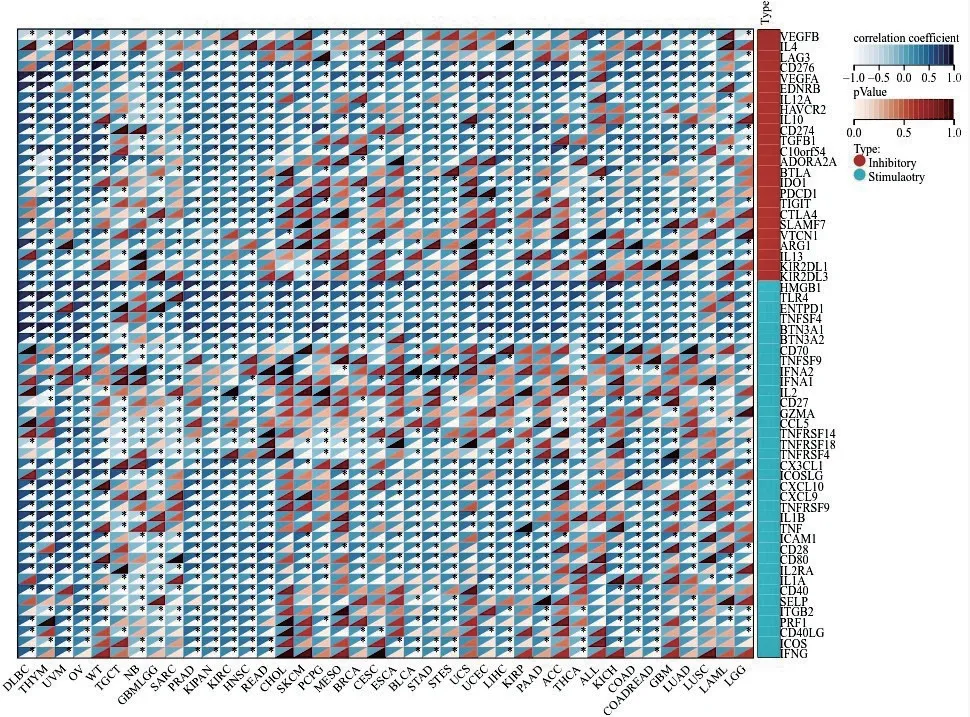
圖8 LARP1 蛋白表達水平與免疫檢查點基因表達水平的相關性
4 討論
目前,腫瘤仍然是威脅人類健康的主要疾病之一,世界范圍內發病率排名前三的腫瘤是乳腺癌、肺癌、結腸癌[7]。針對惡性腫瘤的治療方式主要有手術、化療、放療以及基于檢查點的免疫療法、分子靶向治療,早期發現和有效治療是改善癌癥患者預后的重要前提。腫瘤患者個體化的精準治療是提高患者預后的關鍵,其中分子靶向藥物治療療效顯著,副作用小,但藥效的個體差異較大。免疫檢查點蛋白(ICP) 的鑒定是免疫學中最熱門的研究課題之一。ICP 能夠以環境依賴性的方式調節多種免疫功能。針對癌癥患者的ICP 治療,常用的藥物是ICP 的抑制劑,它可以阻斷免疫檢查點對腫瘤細胞的保護作用,克服傳統癌癥治療的局限性,相關實驗中已經取得了較好的效果,有數種藥物已經應用于臨床[8]。因此,單基因的泛癌生物信息學分析有助于研究不同癌癥之間的異同,研究其與免疫細胞及免疫檢查點的關系,可為癌癥預防和個性化靶向治療及免疫治療策略的設計提供依據。
通過分析,我們發現RNA 結合蛋白LARP1 在BLCA、BRCA、CHOL、COAD、HNSC 等多種腫瘤與正常組織中存在明顯的表達差異,且與腫瘤的分期和預后存在明顯的相關性。目前國內的多個研究已證實LARP1 的表達與卵巢癌、肺癌、胃癌、結腸癌及膽囊癌的預后明顯相關,隨著研究的深入,LARP1 有望成為評估特定腫瘤患者預后的一個潛在的重要標志物。
DNA 甲基化是一種在表觀遺傳基因表達調控、基因組印記、X 染色體失活、轉座子沉默和基因組穩定性方面發揮重要作用的化學修飾過程,異常DNA甲基化模式是腫瘤細胞的特點之一;基因啟動子的DNA 高甲基化使基因轉錄受抑,常導致癌細胞中抑癌基因的沉默或失活[9]。分析發現在BRCA、CHOL、COAD、LUAD、UCEC 等腫瘤組織中,LARP1 DNA甲基化水平顯著降低,同時這些腫瘤中的LARP1 呈高表達,故DNA 甲基化與LARP1 表達的關系值得進一步研究。除此之外,在眾多腫瘤中都存在LARP1基因突變、擴增和深度缺失等情況,LARP1 基因的這些改變似乎能改善腫瘤的總體死亡率,LARP1 基因改變對不同類型腫瘤的影響有待深入研究。
腫瘤微環境(TME)包括腫瘤中的所有非癌性宿主細胞,包括成纖維細胞、內皮細胞、神經元、脂肪細胞、適應性和先天免疫細胞(如T 淋巴細胞、NK細胞、巨噬細胞等),以及其非細胞成分,包括細胞外基質(ECM) 和可溶性產物,如趨化因子、細胞因子、生長因子和細胞外囊泡。TME 在癌癥特征的獲得和維持中發揮著重要作用,如維持增殖信號、抵抗細胞死亡、誘導血管生成、激活侵襲和轉移、引發腫瘤促炎、避免免疫破壞[10]。針對TME 中成分的治療,是腫瘤治療的一個新方向,例如靶向成纖維細胞表面FAPα特異性抗原的西羅株單抗和在研多種針對腫瘤相關巨噬細胞的藥物均已取得可喜的臨床和實驗結果[11]。我們通過分析發現,LARP1 在腫瘤中與樹突狀細胞、輔助性T 淋巴細胞、NK 細胞、巨噬細胞等多種免疫細胞存在相關性,其中與輔助性T 淋巴細胞、中央記憶性T 淋巴細胞、Th2 細胞在大多數腫瘤中呈正相關。我們分析各種腫瘤中LARP1 與免疫檢查點的關系發現,在大多數腫瘤中,LARP1 與刺激性和抑制性免疫均呈正相關,這顯示了腫瘤免疫環境的復雜性,說明LARP1 參與了腫瘤生存、發展的免疫調控作用,對其具體機制的研究具有重要意義。
5 結論
通過泛癌分析發現,LARP1 在多種腫瘤中異常表達,與多種腫瘤患者的預后密切相關;與多種癌癥中活化的樹突狀細胞、B 細胞、CD8+T 淋巴細胞、細胞毒性細胞、嗜酸性粒細胞、免疫性樹突狀細胞、巨噬細胞、肥大細胞等免疫細胞的浸潤相關。在多種癌癥中,均可觀察到LARP1 甲基化減少,LARP1 的表達與免疫檢查點標記物的表達顯著相關。進一步研究LARP1 在癌癥中的分子機制對癌癥的診治具有非常重要的意義。

