髓源性生長因子對高糖環境BMSCs成骨分化的影響及其機制
趙喜強,逯文華,尚利強,黨瑞杰,安 然,何 鑫
據不完全統計,全球范圍內糖尿病患者約為5.37億,預計到2030年將達到6.43億[1]。糖尿病狀態下由于炎癥因子、高血糖等因素的影響,常導致骨代謝紊亂,嚴重影響缺牙患者的口腔種植修復[2]。在糖尿病的高糖環境下,骨髓間充質干細胞(bone-marrow mesenchymal stem cells,BMSCs)的干性和成骨功能會受到抑制,引起口腔種植體周圍骨的重塑障礙[3]。因此,尋找一種能夠改善高糖抑制BMSCs成骨能力的藥物是目前亟待解決的問題。
髓源性生長因子(myeloid-derived growth factor,MYDGF)來源于單核巨噬細胞,在心血管疾病、骨質疏松癥、糖尿病等多種疾病模型中表現出良好的治療效果[4-7]。Wang等[6]發現,MYDGF能夠通過促進胰高血糖素樣肽1的分泌來維持糖尿病小鼠的血糖穩態。劉翠等[8]體外研究發現,正常糖狀態下MYDGF能夠增強糖尿病小鼠 BMSCs的成骨分化能力。以上預示著MYDGF可能是糖尿病骨代謝事件的保護因子。然而,MYDGF在高糖環境中對BMSCs成骨分化的作用及具體機制尚不清楚。本實驗初步探討MYDGF對高糖環境中BMSCs成骨分化的影響及其分子機制。
1 材料與方法
1.1 材料與儀器 24 h內SD大鼠乳鼠(SPF級,北京斯貝福公司)10只;重組 MYDGF蛋白(百奧萊博,中國);α-MEM培養液、裂解液(賽維爾,中國);胎牛血清(Gibco,美國);成骨誘導培養液(賽業,中國);堿性磷酸酶(alkaline phosphatase,ALP)檢測試劑盒(碧云天,中國);Trizol、PVDF膜、ECL發光液(普利萊,中國);兔單抗 β-actin、鼠單抗 β-catenin(Proteintech,美國);兔多抗 p-GSK3β(Abcam,美國);CD11b-FITC、CD29-FITC、CD45-FITC、CD90-FITC抗體(BD Biosciences,美國);引物序列(上海生工,中國)。細胞培養箱、超凈工作臺(博科,中國);恒溫水浴鍋(瑪瑞特,中國); 低速離心機(中科中佳,中國);電泳儀、轉膜儀(六一,中國)。
1.2 BMSC分離、培養 超凈工作臺中分離SD乳鼠雙側股骨,剪開骨髓腔后通過α-MEM 培養液稀釋骨髓,骨髓液離心(1000 r/min,5 min)后棄上層脂肪組織及上清。重懸管底細胞沉淀,接種到細胞培養瓶中,細胞培養箱中培養。待細胞生長匯合至80%時,傳代并繼續培養。
1.3 BMSCs鑒定 取P3代BMSCs并將其密度調整為1×106個/ml,按照1 ml/管的方法分裝至EP管。向EP管中加入5 μl的熒光標記抗體或PBS,抗體包括CD11b、CD29、CD45、CD90。4 ℃條件下孵育40 min,離心后重懸BMSCs,上機檢測BMSCs表面標記物。
1.4 ALP活性檢測 細胞分組:(1)NG組 (BMSCs培養于成骨誘導培養液);(2)HG組(成骨誘導培養液中加入44 mmol/L葡萄糖)[9];(3)MYDGF組(在HG組基礎上加入100 ng/ml MYGDF)[8],每組設3復孔。各組細胞成骨誘導7 d后,裂解提取上清。根據ALP檢測試劑盒說明書方法分別加入檢測緩沖液、標準品和細胞裂解液。37 ℃條件下孵育10 min后加入終止液,酶標儀測定吸光度OD值(波長405 nm)。
1.5 RT-qPCR檢測成骨相關基因 細胞分組同上。通過RT-qPCR檢測各組細胞的成骨細胞特異性轉錄因子(osterix,OSX)、Runt相關轉錄因子(runt-related transcription factor 2,RUNX2)及Ⅰ型膠原(collagen type Ⅰ,COL-Ⅰ)mRNA表達情況。各組細胞成骨誘導7 d后,提取細胞總RNA并測定RNA 純度,隨后逆轉錄RNA合成cDNA,按照 95 ℃反應10 min(預變性),95 ℃反應15 s、60 ℃ 反應1 min的順序進行40個循環的PCR擴增。數據處理時以NG組為參照。
1.6 Wnt/β-catenin信號通路檢測 細胞分組如下:NG組,HG組,MYDGF組,MYDGF+Dkk1組(在MYDGF組基礎上加入10 μg/ml 通路抑制劑Dkk1)[10],每組設3復孔。各組細胞成骨誘導7 d后,提取細胞總蛋白,將蛋白變性后加樣,電泳結束后轉膜,室溫下封閉1 h,將膜浸入一抗孵育,4 ℃過夜后再將膜浸入二抗封閉,最后于膜上滴加ECL發光液顯影,曝光。使用 Image-J定量分析曝光后的條帶。
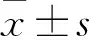
2 結 果
2.1 BMSCs的分離培養和鑒定 貼壁法提取BMSCs,BMSCs形態多呈梭形及紡錘形,旋渦狀生長。BMSCs高表達間充質干細胞表面抗原為CD29(91.6%)、CD90(94.2%),低表達造血干細胞表面抗原為CD11b(0.75%)、CD45(1.55%)。
2.2 MYDGF促進高糖環境中BMSCs的ALP活性 各組細胞成骨誘導7 d后,與NG組相比,HG組ALP活性顯著降低[(0.169±0.018)vs.(0.078±0.012);P<0.05];與HG組相比,MYDGF組ALP活性顯著升高[(0.141±0. 019)vs.(0.078±0.012);P<0.05],而NG組和MYDGF組的ALP活性差異無統計學意義[(0.169±0.018)vs.(0.141±0.019)]。
2.3 MYDGF促進高糖環境中BMSCs的成骨相關基因表達 細胞成骨誘導7 d后,與NG組相比,HG組OSX、RUNX2、COL-I的mRNA水平均明顯降低(P<0.05);與HG組相比, MYDGF組OSX、RUNX2、COL-I的mRNA水平均顯著升高(P<0.05,表1)。

表1 不同處理組BMSCs成骨相關基因表達水平
2.4 MYDGF激活Wnt/β-catenin信號通路 各組細胞成骨誘導7 d后,Western blot結果如圖3和表 2所示:與NG組相比,HG組p-GSK3β和 β-catenin 蛋白水平顯著降低(P<0.05);與HG組相比,MYDGF組的p-GSK3β和β-catenin蛋白水平明顯上升(P<0.05);在加入Dkk1后,MYDGF促進p-GSK3β和β-catenin蛋白表達的作用受到抑制(P<0.05,表2)。

表2 不同處理組BMSCs的p-GSK3β和β-catenin蛋白表達水平
3 討 論
種植修復已成為缺牙患者恢復正常牙列的重要選擇,高血糖會影響種植體周圍的骨愈合及種植體的穩定性,還會在種植體骨結合過程中損害骨質量,增加種植體周圍炎的發生風險,最終可能導致口腔種植的失敗[11,12]。
越來越多的研究表明,骨骼除具有結構作用和造血功能外,還可以作為內分泌器官調節機體的糖代謝[6,13,14]。MYDGF 是一種骨髓來源的細胞因子,能有效維持機體的糖穩態,有望成為糖尿病治療的新藥物[6]。研究表明,MYDGF能夠緩解高糖誘導的H9C2細胞的損傷,對心臟功能具有保護作用[15],能增強糖尿病小鼠 BMSCs的成骨功能[8],但MYDGF對于高糖誘導的BMSCs細胞的影響未見報道。因此本實驗通過高糖誘導BMSCs,探討MYDGF對高糖環境中BMSCs成骨分化的影響。
BMSCs是存在于骨髓組織的多能成體干細胞,在骨代謝過程中發揮重要作用[16]。當骨組織受到損傷后,機體分泌的細胞因子會聚集到BMSCs周圍,刺激其增殖和分化為成骨細胞,從而促進骨組織的愈合和修復[17]。與健康人的BMSCs相比,糖尿病患者的BMSCs的成骨分化能力明顯降低[18]。因此,提高BMSCs的骨向分化能力是促進糖尿病患者種植體骨整合的關鍵要素。研究表明,MYDGF能夠通過抑制破骨細胞的形成和促進成骨細胞的分化來保護骨量[7]。本實驗的研究結果同樣表明,MYDGF能夠促進高糖環境中BMSCs的成骨分化。
本實驗證實了MYDGF能夠顯著升高高糖環境中BMSCs的ALP活性。作為早期成骨標志物,ALP活性的增高說明BMSCs正在向成骨細胞分化[19]。OSX是成骨細胞特異性表達的轉錄因子,RUNX2是早期成骨標志物;而COL-I參與調控成骨過程中細胞外基質的分泌和礦化,是OSX和RUNX2成骨過程中的下游調控靶點[20, 21]。因此,本實驗選擇OSX、RUNX2和COL-I作為BMSCs的靶基因,來驗證各組BMSCs的成骨分化水平。本實驗RT-qPCR結果表明,高糖環境能夠下調BMSCs 的成骨相關基因(OSX、 RUNX2和COL-I)的表達,而加入MYDGF后,OSX、 RUNX2和COL-I的mRNA表達水平均出現上調,說明MYDGF能夠彌補高糖環境對BMSCs成骨分化的負面影響。
Wnt/β-catenin信號通路是參與骨形成的重要調控通路[22]。GSK3β是經典Wnt通路上游的負性因子,GSK3β磷酸化水平在Wnt 通路被激活時升高,從而抑制 β-catenin 的降解,導致β-catenin在胞質中堆積,隨后積聚入核后調控基因的轉錄[23]。對于糖尿病機體而言,局部組織細胞處于高糖環境下,Wnt/β-catenin信號通路在其中仍有重要作用。Zhang等[24]研究發現,高糖環境能夠抑制β-catenin,從而影響干細胞的增殖、遷移等能力。此外,Deng等[25]研究表明,Exendin-4抑制糖尿病小鼠骨丟失的能力與Wnt/β-catenin信號通路有關。本實驗結果表明,高糖環境下p- GSK3β和β-catenin的蛋白表達水平降低,而MYDGF顯著增加了高糖環境中p-GSK3β和β-catenin的蛋白水平;在添加通路抑制劑Dkk1后,MYDGF促進p-GSK3β和β-catenin的蛋白表達能力下降,表明Wnt/β-catenin信號通路受到抑制。進一步證實MYDGF促進高糖環境中BMSCs的成骨分化作用可能與Wnt/β-catenin信號通路的激活有關。
綜上所述,本實驗發現MYDGF在體外能夠促進高糖環境中BMSCs的成骨分化,且這一效應可能與Wnt/β-catenin信號通路的激活有關,但其具體機制尚需進一步研究。

