卵巢子宮內膜異位癥中Vaspin、Visfatin的表達情況及在預后判斷中的價值*
鄧 鳳,易旺軍,吳 櫻,劉 洋,陳 怡
長沙市第三醫院/湖南中醫藥大學附屬長沙醫院婦產科,湖南長沙 410015
子宮內膜異位癥是指子宮外出現子宮內膜腺體和間質等子宮內膜樣組織。卵巢子宮內膜異位癥(OEM)是較常見的子宮內膜異位癥類型,主要表現為痛經、盆腔疼痛及不孕等,嚴重影響女性身體健康[1]。OEM的標準診斷方法是腹腔鏡檢及組織學檢查,治療上以腹腔鏡手術切除異位病變組織為主,但術后容易出現復發,術后3年復發率為20%~50%[2]。深入研究OEM的發病機制,尋找新的預后相關血清標志物,有助于臨床診治。內臟脂肪組織來源的絲氨酸蛋白酶抑制劑(Vaspin)是絲氨酸蛋白酶抑制劑家族的成員,主要存在于內臟及皮下脂肪組織中[3]。近年來發現,Vaspin作為一種脂肪因子,通過促進胰島素抵抗,參與妊娠期糖尿病的發生、發展[4]。內脂酶(Visfatin)也被稱為煙酰胺磷酸核糖基轉移酶,催化煙酰胺與5-磷酸核糖基-1-焦磷酸縮合產生煙酰胺單核苷酸。Visfatin參與包括新陳代謝、應激反應和衰老等多種重要的生物過程[5]。目前OEM中脂肪細胞因子Vaspin、Visfatin的表達及臨床意義尚不清楚。本研究通過檢測OEM患者和健康對照人群的血清Vaspin、Visfatin水平,分析這兩項指標的臨床價值。
1 資料與方法
1.1一般資料 將2017年8月至2019年5月本院收治的86例OEM患者納入研究作為OEM組。納入標準:(1)經病理檢查確診為OEM,符合中華醫學會婦產科學分會制定的《子宮內膜異位癥診治指南》[6];(2)臨床及隨訪資料完整;(3)患者均為初次診治,入院前無治療史。排除標準:(1)合并系統性紅斑狼瘡,類風濕性關節炎等自身免疫性疾病;(2)伴有卵巢囊腫、既往有盆腔手術史;(3)術前6個月內無內異癥相關激素類藥物治療史。年齡23~44歲,平均(30.96±5.61)歲;體重指數為(22.08±3.18)kg/m2;囊腫大小(5.94±2.03)cm;術后妊娠25例;術后用藥49例;OEM分期參考美國生殖醫學學會(ASRM)的標準[7],Ⅰ~Ⅱ期43例,Ⅲ~Ⅳ期43例。以視覺模擬評分量表(VAS)對痛經程度進行評估,其中輕度疼痛(VAS評分1~3分)41例,中度疼痛(VAS評分4~7分)25例,重度疼痛(VAS評分8~10分)20例。選取同期于本院進行健康體檢的64例育齡期健康女性作為對照組,年齡23~43歲,平均(30.78±6.14)歲;體重指數(21.21±3.21)kg/m2。兩組年齡、體重指數等比較,差異無統計學意義(P>0.05)。患者及家屬對本研究均知情同意并簽署知情同意書,本研究經本院倫理委員會審核批準。
1.2方法
1.2.1血清Vaspin、Visfatin的檢測 采用酶聯免疫吸附法(ELISA)檢測受試者血清Vaspin、Visfatin水平。OEM組于入院時采集靜脈血標本,對照組于健康體檢時采集靜脈血標本5 mL,以3 000 r/min離心10 min,分離上層血清。人Vaspin ELISA試劑盒購自上海聯祖生物科技公司,檢測范圍54~1 000 pg/mL,檢測下限20 pg/mL。人Visfatin ELISA試劑盒購自上海齊態生物科技公司,檢測范圍3.75~120 ng/mL,檢測下限0.2 pg/mL。檢測操作嚴格按照試劑盒說明書進行。反應結束后用酶標儀測量450 nm 波長下的吸光度值(A450),繪制標準曲線,計算樣品濃度,每個樣品重復檢測3次。
1.2.2術后治療 30例OEM患者術后接受促性腺激素釋放激素激動劑(GnRH-a)治療,方案:從術后第3天至第5天開始,應用亮丙瑞林3.75 mg或戈舍瑞林3.6 mg,皮下注射,每月注射1次,共用6次。19例OEM患者術后接受口服避孕藥治療,方案:術后月經來潮第1天開始服用達英-35,1片/天,連續服用21 d為一個周期,停藥間隔1周再進行下一個周期服藥,共6個周期。
1.2.3隨訪 所有患者自出院后開始隨訪,每3個月電話或門診隨訪1次,隨訪3年,隨訪內容為患者OEM術后復發情況,記錄無復發生存時間。隨訪截至2021年2月1日,隨訪期間失訪1例,失訪率1.16%(1/86)。OEM復發的判斷標準[8]:術后病灶縮小或消失,癥狀緩解后再次出現臨床癥狀,癥狀進行性加重,且出現新的內異癥病灶。
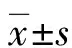
2 結 果
2.1OEM組和對照組血清Vaspin、Visfatin水平比較 OEM組患者血清Vaspin、Visfatin水平分別為(218.01±31.66)、(34.38±6.75)ng/mL,對照組這兩項指標水平分別為(421.50±50.47)、(11.61±4.50)ng/mL。與對照組比較,OEM組患者血清Vaspin水平較低,Visfatin水平較高,差異有統計學意義(t=30.254、23.385,P<0.001)。
2.2血清Vaspin、Visfatin水平與OEM患者ASRM分期及痛經嚴重程度的關系 不同ASRM分期的OEM患者血清Vaspin、Visfatin比較,差異均有統計學意義(P<0.05)。與ASRM分期Ⅰ~Ⅱ期患者比較,Ⅲ~Ⅳ期患者的血清Vaspin水平較低,Visfatin水平較高。不同疼痛程度的OEM患者血清Vaspin、Visfatin水平比較差異均無統計學意義(P>0.05)。見表1。
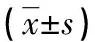
表1 血清Vaspin、Visfatin與OEM患者ASRM分期及痛經嚴重程度的關系
2.3OEM復發影響因素的單因素分析 與未復發組比較,復發組ASRM分期Ⅲ~Ⅳ期患者比例較高,術后妊娠、術后用藥患者比例及Vaspin水平較低,Visfatin水平較高,差異均有統計學意義(P<0.05);未復發組和復發組年齡、體重指數、囊腫大小、疼痛程度等方面比較,差異均無統計學意義(P>0.05)。見表2。

表2 OEM復發組和無復發組臨床參數比較或n)
2.4多因素Logistic回歸分析影響OEM復發的因素 以隨訪過程中患者是否發生OEM術后復發作為因變量(發生=1,未發生=0),將ASRM分期(Ⅲ~Ⅳ期=1,Ⅰ~Ⅱ期=0)、術后妊娠(有=1,無=0)、術后用藥(有=1,無=0)、Vaspin、Visfatin作為自變量,進行多因素Logistic回歸分析。結果顯示,ASRM分期Ⅲ~Ⅳ期、Vaspin水平降低、Visfatin水平升高是OEM患者術后復發的獨立危險因素,術后妊娠和術后用藥是OEM患者術后復發的保護因素。見表3。

表3 多因素Logistic回歸分析影響OEM復發的因素
2.5血清Vaspin、Visfatin單獨及聯合檢測對OEM復發的預測效能 血清Vaspin、Visfatin單獨及聯合檢測對OEM術后復發預測的曲線下面積(95%CI)分別為0.890(0.820~0.959)、0.838(0.767~0.908)及0.931(0.878~0.985),聯合檢測的預測效能高于血清Vaspin、Visfatin單項指標檢測(Z=3.098、4.640,P=0.002、<0.001)。見表4、圖1。

圖1 ROC曲線分析血清Vaspin、Visfatin單獨及聯合檢測對OEM復發的預測效能

表4 血清Vaspin、Visfatin單獨及聯合檢測對OEM復發的診斷效能
2.6Vaspin、Visfatin表達對OEM患者無復發生存的影響 以OEM患者血清Vaspin、Visfatin水平的平均值為界,將OEM患者分為Vaspin高表達組(n=42)和低表達組(n=44),Visfatin高表達組(n=41)和低表達組(n=45)。Vaspin高表達組和低表達組無復發生存率分別為80.95%(34/42)、45.45%(20/44),Vaspin低表達組累積無復發生存情況差于Vaspin高表達組,差異有統計學意義(Log-Rankχ2=4.079,P=0.041)。Visfatin高表達組和低表達組無復發生存率分別為53.66%(22/41)、71.11%(32/45),Visfatin高表達組累積無復發生存情況差于Visfatin低表達組,差異有統計學意義(Log-Rankχ2=6.601,P=0.010)。見圖2。

圖2 Kaplan-Meier法分析Vaspin、Visfatin表達對OEM患者無復發生存的影響
3 討 論
子宮內膜異位癥中的促炎癥介質包括白細胞介素(IL)-6、腫瘤壞死因子-α,它們的表達異常增加,可引起血管內皮功能障礙,誘導細胞錯配修復功能異常,促進卵巢子宮內膜異位癥的惡性轉化[9-10]。脂肪細胞因子是由白色脂肪組織分泌的蛋白質,影響機體新陳代謝、免疫、內分泌系統和炎癥調節[11]。脂肪細胞因子是影響子宮內膜異位癥發生的重要因素,其能夠影響機體的抗炎和促炎過程,參與子宮內膜異位癥疾病的發生、發展[12]。
Vaspin是一種新型脂肪細胞因子,具有胰島素增敏的作用,參與機體脂質代謝的調節,在糖尿病、多囊卵巢綜合征和不孕癥等疾病中發揮重要的作用[13-14]。子宮內膜異位癥患者脂質代謝存在紊亂的現象[3],因此,筆者推測Vaspin可能與OEM疾病發生、發展關系密切。有學者在子宮內膜異位癥患者中發現血清Vaspin mRNA水平明顯下調[12],這與本研究中OEM組患者血清Vaspin水平降低的結果一致,但本研究是在蛋白水平進行檢測,結果更為準確。本研究中血清Vaspin水平與ASRM分期有關,提示Vaspin水平的降低參與了OEM疾病進展。有研究報道,Vaspin能夠促進細胞中AKT蛋白的磷酸化水平,抑制核因子kappa B的激活,減弱促炎性細胞因子如IL-1β及黏附因子如上皮型鈣黏素的表達[15]。此外,Vaspin還能夠通過抑制CCAAT/增強子結合蛋白α的轉錄,抑制腫瘤壞死因子α及IL-6的表達和分泌,促進3T3-L1前脂肪細胞的分化和脂質積累[16]。因此,OEM中Vaspin的表達降低導致其抗炎作用顯著降低,促進OEM疾病的發生、發展。OEM雖然是一種良性疾病,但具有侵襲、浸潤和轉移的特點。本研究中,Vaspin水平降低是OEM復發的獨立危險因素,而且Vaspin低表達患者無復發生存情況較差,提示Vaspin是新的評估OEM術后復發的血清標志物。有研究報道,Vaspin能夠通過結合并抑制葡萄糖調節蛋白78介導的內質網應激,抑制細胞增殖,遷移和侵襲能力[17]。因此,Vaspin低表達會導致異位的子宮內膜細胞侵襲遷移能力增強,腹腔鏡術中部分肉眼不可見的細微病灶不能去除,增加術后復發風險。
Visfatin是一種煙酰胺磷酸核糖基轉移酶,可分泌到細胞外,并作為一種炎性細胞因子,參與糖尿病、惡性腫瘤等多種疾病的病理過程。本研究中,OEM患者血清Visfatin水平明顯升高,與既往研究報道一致[12]。OEM中Visfatin高表達的機制與OEM炎癥微環境中炎癥因子的作用有關。有學者發現,促炎性細胞因子如IL-6和Toll樣受體的激活能夠顯著上調Visfatin的表達[18]。此外,ASRM分期Ⅲ~Ⅳ期的OEM患者血清Visfatin水平較高,提示Visfatin可促進OEM的發生、發展。有研究發現,Visfatin能夠誘導核因子kappa B的轉錄,進而激活下游促炎性細胞因子腫瘤壞死因子α和基質金屬蛋白酶2的表達,導致局部炎癥程度加重,促進異位內膜組織的浸潤深度,導致ASRM分期進展[19]。本研究中,Visfatin水平升高是OEM患者術后復發的危險因素,表明Visfatin有助于評估OEM患者的預后。有學者發現,Visfatin能夠通過促進轉錄因子Snail-1的表達,促進細胞間質性標志N型鈣黏素的表達,抑制E-鈣黏素的表達,促進異位內膜細胞的遷移和侵襲能力[20]。此外,Visfatin高表達的患者OEM分期較高,術中病灶難以徹底清除,術中殘留風險較大,從而增加術后復發風險。本研究發現,血清Vaspin、Visfatin聯合檢測對OEM患者術后OEM復發有較高的預測效能,聯合檢測的靈敏度及特異度分別為0.807、0.853。臨床中,醫生可以對不同復發風險的OEM患者采取個體化治療方案和隨訪方案,以減少疾病復發和患者的痛苦。
綜上所述,OEM患者Vaspin水平降低,Visfatin水平升高,兩者與OEM患者ASRM分期有關,是OEM患者術后復發的獨立危險因素。Vaspin低表達和Visfatin高表達的OEM患者無復發生存情況較差,血清Vaspin、Visfatin聯合檢測對OEM患者術后復發具有較高的預測效能。但本研究樣本量有限,未能對治療前后Vaspin、Visfatin的動態變化進行監測,有待今后擴大樣本量深入研究兩者的臨床應用價值。

