假臭草來源植物內生真菌生物轉化(+)-檸檬烯產物分析
摘要:
為了篩選能夠生物轉化(+)-檸檬烯的微生物,將7株假臭草內生真菌作為生物催化劑,在30 ℃,150 r·min-1下發酵6 d后,添加體積分數為0.5%的(+)-檸檬烯繼續轉化4 d,并采用薄層層析、氣相色譜-質譜聯用和核磁共振技術分析產物.結果表明:各真菌生物轉化(+)-檸檬烯的主要產物為(1S,2S,4R)-檸檬烯-1,2-二醇、環氧檸檬烯、(1S,2R,4R)-檸檬烯-1,2-二醇等;菌株Alternaria Nees PS08生成唯一產物(1S,2S,4R)-檸檬烯-1,2-二醇,質量濃度達到(2.46±0.16) g·L-1.
關鍵詞:
(+)-檸檬烯; 假臭草; 植物內生真菌; (1S,2S,4R)-檸檬烯-1,2-二醇
中圖分類號: Q 53文獻標志碼: A?? 文章編號: 1000-5013(2023)04-0495-07
Analysis of Biotransformation Products of (+)-Limonene by Plant Endophytic Fungi From Praxelis clematidea
YANG Daomao
(College of Chemical Engineering, Huaqiao University, Xiamen 361021, China)
Abstract:
In order to screen microorganisms of biotransformation of (+)-limonene, seven endophytic fungi from Praxelis clematidea were used as biocatalysts. After 6 days of fermentation under 30 ℃ and 150 r · min-1, 0.5% volume fraction of (+)-limonene was added for further 4 days, the products were analyzed by Thin Layer Chromatography, Gas Chromatography-Mass Spectrometry and Nuclear Magnetic Resonance technology. The results showed that the main products of biotransformation of (+)-limonene by various fungi were (1S,2S,4R)-limonene-1,2-diol, limonene epoxide, (1S,2R,4R)-limonene-1,2-diol, etc.. The strain Alternaria Nees PS08 produced only product (1S,2S,4R)-limonene-1,2-diol, and its mass concentration reached (2.46±0.16) g·L-1.
Keywords: (+)-limonene; Praxelis clematidea; plant endophytic fungi; (1S,2S,4R)-limonene-1,2-diol
(+)-檸檬烯為檸檬精油的主要成分,屬于柑橘加工過程中的副產物.由于結構簡單、價格低廉,有多個可以催化的位點[1],(+)-檸檬烯一直是理想的生物轉化底物模型.能轉化(+)-檸檬烯的微生物種類多樣,如假單胞屬細菌(Pseudomonas sp.)[2-3],尖孢鐮刀菌152b[4]、指狀青霉菌[5-6]、黑曲霉[7]、解脂耶氏酵母[8-9].雖然在生物催化劑的篩選領域取得了巨大的進展,但微生物的低轉化效率[10]和巨大的篩選工作量嚴重影響生物轉化的推廣與應用,如ROTTAVA等[11]從405株菌株中只發現8株菌株能夠轉化(+)-檸檬烯.針對該問題,有學者指出植物內生真菌是一個很有發展前景的篩選來源.植物內生真菌因為需要與宿主植物一起共進化來適應環境的變化,使其可能會產生豐富的酶來適應宿主[12],如海藻來源內生真菌Botryosphaeria sp.[13]能將外消旋樟腦轉化為6-endo-羥基樟腦、6-exo-羥基樟腦等產物,火炬松來源內生真菌Phomopsis sp.能轉化(+)-檸檬烯合成香芹酮和檸檬烯-1,2-二醇,如果底物為柑橘皮提取物,則生成單一產物檸檬烯-1,2-二醇[14],內生真菌Aspergillus fumigatus [15]能轉化硫利達嗪.因此,利用植物內生真菌進行生物轉化是可行的[16].
假臭草(Praxelis clematidea (Griseb.) R. M. King & H. Rob.)屬于菊科植物,原產南美,現入侵亞洲和大洋州等地.由于假臭草對土壤肥力吸收力強,嚴重影響果樹的生長,此外,它能分泌一種有毒的惡臭味,影響家畜覓食,屬于入侵植物.研究發現假臭草花精油對柑橘木虱具有驅避和致死活性[17],且其總黃酮類化合物對金黃葡萄球菌有抑菌活性[18].
目前,尚未見到假臭草內生真菌用于生物轉化(+)-檸檬烯的相關報道.基于此,本文以分離自假臭草內生真菌為生物轉化劑,考察其生物轉化產物.
1 材料與方法
1.1 藥品與儀器
(+)-檸檬烯(日本東京化成工業株式會社);石油醚(60~90 ℃)、無水乙醇、乙酸乙酯(上海市國藥試劑有限公司);(1S,2S,4R)-(+)-二戊烯-1,2-二醇((1S,2S,4R)-檸檬烯-1,2-二醇,CAS號:38630-75-0,美國Sigma-Aldrich公司);氘代甲醇(廣東省廣州賽迪菲生物科技有限公司).以上試劑均為分析純.0.22 μm濾膜(天津市津騰實驗設備有限公司);100目硅膠、GF254型薄層層析硅膠板(50 mm×200 mm,山東省青島海洋化工廠分廠).
ZQZY-75CN型振蕩培養箱(上海支楚儀器有限公司);XH-C型旋渦混合器(江蘇省金壇市白塔新寶儀器廠);SW-CJ-1FD型潔凈工作臺(江蘇省蘇州安泰空氣技術有限公司);H1650型醫用離心機(湖南湘儀實驗室儀器開發有限公司);Agilent 8860 GC System-5977B型氣質聯用儀器(帶G4513A自動進樣器,美國安捷倫科技有限公司);EYELA N-1100型旋轉蒸發儀(日本東京理化器械株式會社);Bruker-500 MHz型核磁共振譜儀(瑞士布魯克公司,由華僑大學分析測試中心提供).
1.2 微生物與培養基
7株植物內生真菌(Alternaria Nees PS01,Alternaria Nees PS06,Alternaria Nees PS07,Alternaria Nees PS09,Alternaria Nees PS10,Alternaria Nees PS18,Diaporthe amygdali PS08)由華僑大學化工學院王奇志博士饋贈.
培養基均采用沙保氏培養基:蛋白胨10 g·L-1,葡萄糖40 g·L-1(pH值為4.0~6.0).
1.3 檢測方法
薄層層析(TLC)方法:展開劑為V(石油醚)∶V(乙酸乙酯)=7∶3,顯色劑采用體積分數為1%的香草醛濃硫酸溶液.
氣相色譜-質譜聯用(GC-MS):Agilent HP-5 ms型色譜柱(30 m×250 μm ×0.25 μm),載氣為氦氣,進樣量為1 μL.溫度程序:60 ℃保持1 min,20 ℃·min-1升溫到300 ℃,保持13 min.MS離子源溫度為230 ℃,MS四極桿溫度為150 ℃,質譜掃描范圍(m/z)為60~800.
2 實驗步驟
2.1 菌株活化與發酵
各測試菌株接種于裝有馬鈴薯葡萄糖瓊脂培養基的培養皿(直徑為90 mm)上,在30 ℃恒溫培養箱中培養6 d后,存于4 ℃冰箱中備用.
每株菌挑取一接種環菌絲接種于裝有100 mL培養基的250 mL錐形瓶中,在28 ℃,150 r·min-1條件下培養6 d.
2.2 生物轉化(+)-檸檬烯及產物分析
生物轉化流程參考海洋真菌的生物轉化流程并做細微調整[19],具體流程為:在每株菌培養了6 d的100 mL發酵液中,加入1 mL經0.22 μm濾膜過濾除菌的(+)-檸檬烯-乙醇溶液(檸檬烯溶于等體積乙醇,檸檬烯的最終體積分數為0.5%),在28 ℃,150 r·min-1條件下繼續培養4 d.
轉化結束,發酵液用布氏漏斗過濾后,取3 mL濾液轉移到150 mm×15 mm的試管中,用等體積乙酸乙酯萃取;然后,將萃取相轉移到干燥的150 mm×15 mm的試管中,并用無水硫酸鈉脫水;最后,取萃取相進行TLC和GC-MS檢測.
2.3 菌株PS18轉化產物結構鑒定
鑒于TLC檢測結果,選取包含2個轉化產物的菌株PS18,按照節2.2的生物轉化流程制備轉化產物.具體流程為:配制2.5 L發酵培養基,分裝于25瓶250 mL錐形瓶中.后續的發酵與轉化步驟參考節2.1,2.2.轉化結束,將發酵液用布氏漏斗過濾,等體積乙酸乙酯萃取濾液2次后,合并萃取液,用旋轉蒸發儀于40 ℃,真空度-0.1 MPa下蒸發有機溶劑,最終獲得轉化產物3.33 g.
取少量乙酸乙酯完全溶解轉化產物后,用100目硅膠拌樣陰干,隨后采用干法上玻璃色譜柱(300 mm×25 mm),洗脫劑體系采用V(石油醚)∶V(乙酸乙酯)為14∶2~14∶4
進行洗脫,每個梯度洗脫體積為200 mL以上,并用TLC跟蹤洗脫結果.最終獲得化合物PS18-1(1.56 g),PS18-2(0.87 g),用氘代甲醇溶解后進行核磁共振檢測.
2.4 各菌株轉化產物的質量濃度檢測
建立檸檬烯-1,2-二醇標準曲線.實驗步驟為:用乙酸乙酯溶解標準品并配制8.600 0 g·L-1母液,采用逐步稀釋的方法,將母液稀釋成不同質量濃度,隨后采用節1.3的方法獲得檸檬烯-1,2-二醇的峰面積-質量濃度的關系圖.
挑取各菌株的菌絲接種于裝有100 mL培養基的250 mL錐形瓶中,每株菌重復3次,后續發酵和生物轉化步驟參考節2.1,2.2.最后,依據標準曲線求出各菌株轉化產物的平均質量濃度.
3 實驗結果與討論
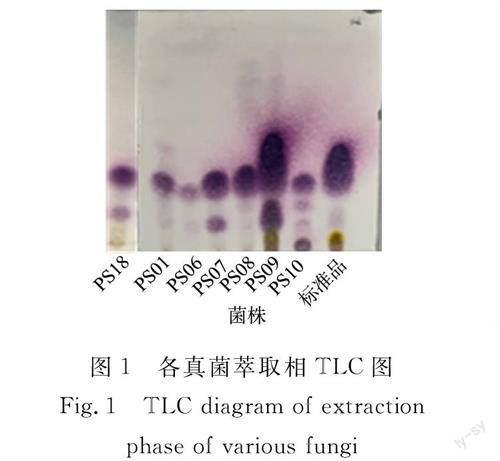
3.1 各菌萃取液TLC分析
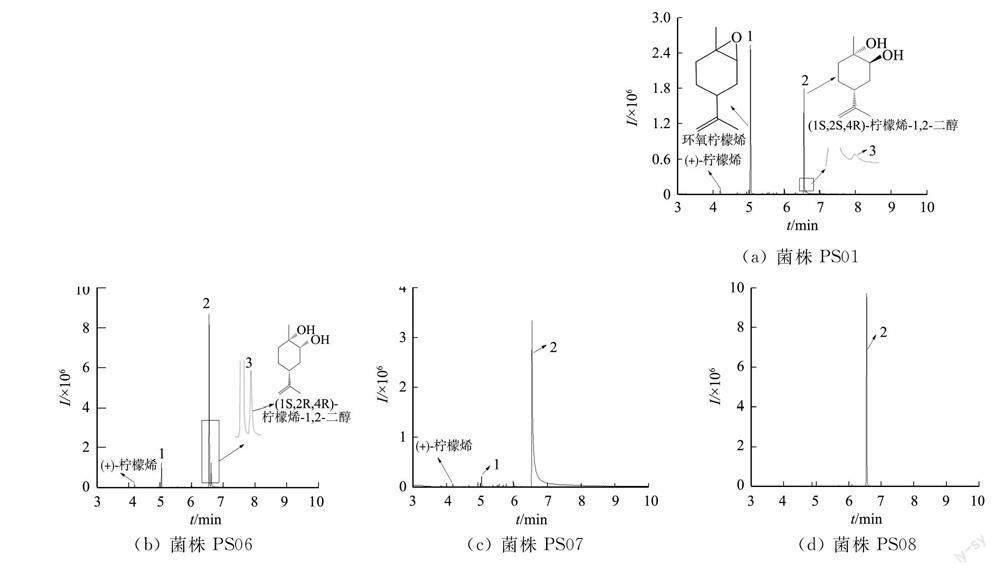
將各真菌的萃取相進行TLC檢測,結果如圖1所示.
由圖1可知:菌株PS01,PS06和PS08的條帶僅發現1個主要斑點,且比移值(Rf)與標準品((1S,2S,4R)-檸檬烯-1,2-二醇)一致;菌株PS07,PS18的條帶明顯多出1個斑點.從真菌測序結果可知,除了菌株PS08歸屬于扁桃腐皮殼菌(D. amygdali),其余菌株歸屬于鏈格孢屬(A. Nees),但轉化產物卻不相同,說明轉化產物與種屬之間不存在必然的聯系.
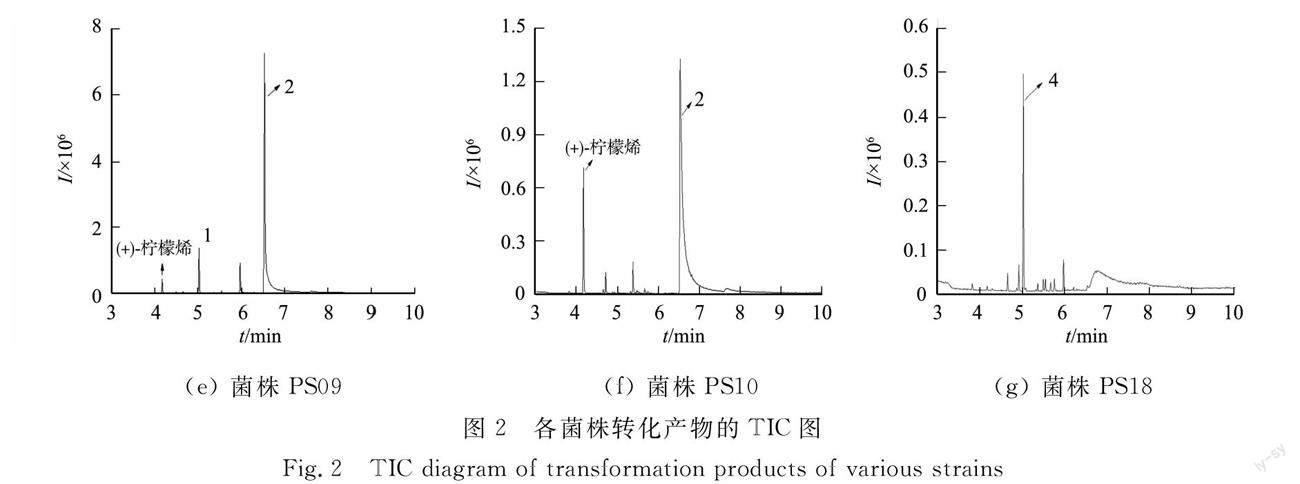
3.2 轉化產物GC-MS檢測
各菌株轉化產物總離子色譜(TIC)圖,如圖2所示.圖2中:I為強度;t為時間.
檢索NIST 17.0數據庫可知,峰1匹配環氧檸檬烯(limonene oxidde),屬于檸檬烯-1,2-二醇前體物質[20-22];峰2匹配化合物檸檬烯-1,2-二醇,保留時間與標準品一致;峰3匹配結果與峰2一致,推測為峰2的同分異構體;峰4未檢索到匹配的化合物.
3.3 轉化產物結構鑒定
化合物PS18-1,PS18-2的TLC圖和TIC圖,如圖3所示.
經數據庫檢索,化合物PS18-1,PS18-2均匹配為檸檬烯-1,2-二醇,結合TLC結果,推測二者為同分異構體.
化合物PS18-1碳譜13C NMR(500 MHz,CD3OD)的化學位移(δ)為151.44,108.98,74.41,71.70,38.79,35.13,34.38,27.63,27.41,21.08.該碳譜化學位移與文獻報道的化合物2((1S,2S,4R)-檸檬烯-1,2-二醇)完全一致[23],也與化合物2a的碳譜化學位移相同[24].化合物PS18-1的氫譜1H NMR(500 MHz,CD3OD)的化學位移(δ)為3.55(dd,J = 2.3,2.0,1H,H-2),1.63(m,H-3),1.91(ddd,1Heq,13.2,13.2,2.6,H-3),2.27(m,1H,H-4),1.48(m,Hax-5),1.60(m,Heq-5),1.49(m,1Hax,H-6),1.73(m,1Heq,H-6),1.20(s,3H,H-7),4.71(bs,1H,H-9),4.68(bs,1H,H-9),1.72(s,3H,H-10).該數據與化合物2的氫譜數據一致[23].
綜上,化合物PS18-1歸屬于(1S,2S,4R)-檸檬烯-1,2-二醇.化合物PS18-1和化合物2的碳譜圖和氫譜圖,如圖4所示.
化合物PS18-2碳譜13C NMR(500 MHz,CD3OD)的化學位移(δ)為150.11,109.39,77.83,74.45,45.23,39.79,37.87,29.77,21.02,18.91.該碳譜數據與化合物1((1S,2R,4R)-檸檬烯-1, 2-二醇)數據完全相同[23].化合物PS18-2的氫譜1H NMR(500 MHz,CD3OD)的化學位移(δ)為3.50(dd,J = 4.6,11.8,1H,H-2), 1.30(m,Hax-3), 1.83(m,1Heq,H-3), 2.06(dddd,1H,12.4,12.4,3.5,3.4,H-4),1.47(dddd,17.5,14.8,14.8,3.5,Hax-5),1.75(m,Heq-5),1.25(m,1Hax,H-6),1.63(m,1Heq,H-6),1.15(s,3H,H-7),4.71(bs,1H,H-9),4.69(bs,1H,H-9),1.72(s,3H,H-10),該數據與化合物1的氫譜數據一致[23].
綜上,PS18-2歸屬為(1S,2R,4R)-檸檬烯-1,2-二醇.PS18-2與化合物1的碳譜圖和氫譜圖,如圖5所示.
由圖3,4,5可知:Rf較高的斑點為(1S,2S,4R)-檸檬烯-1,2-二醇,Rf較低的斑點為(1S,2R,4R)-檸檬烯-1,2-二醇.文獻[25]報道檸檬烯轉化為檸檬烯-1,2-二醇時,需要通過FAD結合單加氧酶(FAD-binding monooxygenase)生成檸檬烯環氧化物(limonene-1,2-epoxide),再通過環氧化物水解酶(epoxide hydrolase)生成檸檬烯-1,2-二醇.通過比較7株植物內生真菌的轉化產物,可得以下2個結論.1) 來源于不同種屬植物內生真菌的環氧化物水解酶存在差異,如D. amygdali PS08和A. Nees PS18,前者生成(1S,2S,4R)-檸檬烯-1,2-二醇,后者額外生成(1S,2R,4R)-檸檬烯-1,2-二醇,與文獻[26]報道的氯過氧化物酶轉化(+)-檸檬烯生成檸檬烯-1,2-二醇類似,該酶在氯離子存在下生成2種手性產物.2) 即使是來源于同一種屬植物內生真菌的環氧化物水解酶也可能存在差異,如A. Nees PS01與A. Nees PS06生成(1S,2S,4R)-檸檬烯-1,2-二醇,而A. Nees PS07,A. Nees PS09和A. Nees PS18則額外生成(1S,2R,4R)-檸檬烯-1,2-二醇.因此,該轉化機制可能需要進一步完善.
3.4 產物的測量
檸檬烯-1,2-二醇標準曲線,如圖6所示.圖6中:S為峰面積;ρ為檸檬烯-1,2-二醇的質量濃度.
由圖6可得標準曲線方程為S=129 971.734 13ρ-15 963.437 46,R2=0.993.
依此標準曲線,各菌株產(1S,2S,4R)-檸檬烯-1,2-二醇的質量濃度,如圖7所示.
由圖7可知:各菌株產(1S,2S,4R)-檸檬烯-1,2-二醇的質量濃度為0.36~2.46 g·L-1.其中,菌株PS08產量最高,達到(2.46±0.16) g·L-1,實驗結果與文獻[14]吻合.
4 結束語
轉化產物檸檬烯-1,2-二醇(檸檬甘油)屬于一種比較重要的檸檬烯含氧衍生物.研究表明,該化合物具有抗癌[27-29]和抗炎活性[28],也可作為合成其他生物活性物質前體[30-32].由于該化合物存在4種立體構型[24],手性不同的純萜類對映體其藥理活性(抗微生物活性、毒性或氣味特性)存在差異[33],如(1S,2R,4R)-檸檬烯-1,2-二醇和(1S,2S,4R)-檸檬烯-1,2-二醇對新生隱球菌(Cryptococcus neoformans)的最小抑制濃度分別為184,1 470 μmol·L-1[23].因此,4種構型的化合物生物活性數據有待進一步挖掘.
采用假臭草來源植物內生真菌轉化(+)-檸檬烯,轉化單一且產量達克級,轉化效果較理想.
參考文獻:
[1] 臺亞楠,董曼,任婧楠,等.檸檬烯微生物轉化的研究進展[J].食品科學,2014,35(17):272-277.DOI:10.7506/spkx1002-6630-201417052.
[2] SPEELMANS G,BIJLSMA A,EGGINK G.Limonene bioconversion to high concentrations of a single and stable product, perillic acid, by a solvent-resistant Pseudomonas putida strain[J].Applied Microbiology and Biotechnology,1998,50(5):538-544.DOI:10.1007/s002530051331.
[3] MIRATA M A,HEERD D,SCHRADER J.Integrated bioprocess for the oxidation of limonene to perillic acid with Pseudomonas putida DSM 12264[J].Process Biochemistry,2009,44(7):764-771.DOI:10.1016/j.procbio.2009.03.013.
[4] MOLINA G,BUTION M L,BICAS J L,et al.Comparative study of the bioconversion process using R-(+)- and S-(-)-limonene as substrates for Fusarium oxysporum 152B[J].Food Chemistry,2015,174(1):606-613.DOI:10.1016/j.foodchem.2014.11.059.
[5] ADAMS A,DEMYTTENAERE J C R,DE KIMPE N.Biotransformation of (R)-(+)- and (S)-(-)-limonene to α-terpineol by Penicillium digitatum: Investigation of the culture conditions[J].Food Chemistry,2003,80(4):525-534.DOI:10.1016/S0308-8146(02)00322-9.
[6] DEMYTTENAERE J C R,VANOVERSCHELDE J,DE KIMPE N.Biotransformation of (R)-(+)- and (S)-(-)-citronellol by Aspergillus sp. and Penicillium sp., and the use of solid-phase microextraction for screening[J].Journal of Chromatography A,2004,1027(1/2):137-146.DOI:10.1016/j.chroma.2003.08.090.
[7] PARSHIKOV I A,SUTHERLAND J B.The use of Aspergillus niger cultures for biotransformation of terpenoids[J].Process Biochemistry,2014,49(12):2086-2100.DOI:10.1016/j.procbio.2014.09.005.
[8] FERRARA M A,ALMEIDA D S,SIANI A.et al.Bioconversion of R-(+)-limonene to perillic acid by the yeast Yarrowia lipolytica[J].Brazilian Journal of Microbiology,2013,44(4):1075-1080.DOI:10.1590/S1517-838220140 05000008.
[9] VESPERMANN K A C,PAULINO B N,BARCELOS M C S,et al.Biotransformation of α- and β-pinene into flavor compounds[J].Applied Microbiology and Biotechnology,2017,101(5):1805-1817.DOI:10.1007/s00253-016-8066-7.
[10] BICAS J L,FONTANILLE P,PASTORE G M,et al.A bioprocess for the production of high concentrations of R-(+)-α-terpineol from R-(+)-limonene[J].Process Biochemistry,2010,45(4):481-486.DOI:10.1016/j.procbio.2009.11.007.
[11] ROTTAVA I,CORTINA P F,GRANDO C E,et al.Isolation and screening of microorganisms for R-(+)-limonene and (-)-β-pinene biotransformation[J].Applied Biochemistry and Biotechnology,2010,162(3):719-732.DOI:10.1007/s12010-009-8872-9.
[12] RODRIGUEZ P,GONZALEZ D,GIORDANO S R.Endophytic microorganisms: A source of potentially useful biocatalysts[J].Journal of Molecular Catalysis B: Enzymatic,2016,133(1):S569-S581.DOI:10.1016/j.molcatb.2017.02.013.
[13] DE JESUS H C R,JELLER A H,DEBONSI H M,et al.Multiple monohydroxylation products from rac-camphor by marine fungus Botryosphaeria sp.isolated from marine alga Bostrychia radicans[J].Journal of the Brazilian Chemical Society,2017,28(3):498-504.DOI:10.21577/0103-5053.20160262.
[14] BIER M C,MEDEIROS A B,SOCCOL C R.Biotransformation of limonene by an endophytic fungus using synthetic and orange residue-based media[J].Fungal Biology,2017,121(2):137-144.
[15] BORGES K B,BORGES W D E S,PUPO M T,et al.Endophytic fungi as models for the stereoselective biotransformation of thioridazine[J].Applied Microbial and Cell Physiology,2007,77(3):669-674.DOI:10.1007/s00253-007-1171-x.
[16] DEMYTTENAERE J C R,WILLEMEN H M.Biotransformation of linalool to furanoid and pyranoid linalool oxides by Aspergillus niger[J].Phytochemistry,1997,47(6):1029-1036.DOI:10.1016/s0031-9422(98)80066-6.
[17] 王奇志,劉育梅,李書明,等.假臭草花精油的化學組成及對柑橘木虱的驅避和致死活性[J].昆蟲知識,2018,55(1):117-125.
[18] 王偉,代光明,李書明,等.假臭草總黃酮超聲波輔助提取工藝優化及抑菌活性[J].天然產物研究與開發,2017,29(8):1343-1361.
[19] 楊道茂,陳煌.近海海洋真菌生物轉化(+)-檸檬烯[J].華僑大學學報(自然科學版),2020,41(1):67-71.DOI:10.11830/ISSN.1000-5013.201904020.
[20] MAROSTICA M R,PASTORE G M.Biotransformation of limonene: A review of the main metabolic pathways[J].Quimica Nova,2007,30(2):382-387.DOI:10.1590/S0100-40422007000200027.
[21] 張璐璐,范剛,何進,等.檸檬烯微生物轉化及其相關酶的研究進展[J].食品工業科技,2019,40(12):317-326.DOI:10.13386/j.issn1002-0306.2019.12.051.
[22] FONTANILLE P,GROS J B,LARROCHE C.Biotransformations with crude enzymes and whole cells[M]∥Pandey A,et al.Enzyme Technology.New York:Asiatech Publishers Inc,2006.
[23] LEITO S G,MARTINS G R,MARTNEZ-FRUCTUOSO L,et al.Absolute stereochemistry of antifungal limonene-1,2-diols from Lippia rubella[J].Revista Brasileira de Farmacognosia,2020,30(4):537-543.DOI:10.1007/s43450-020-00081-x.
[24] MORIKAWA H,YAMAGUCHI J I,SUGIMURA S I,et al.Systematic synthetic study of four diastereomerically distinct limonene-1,2-diols and their corresponding cyclic carbonates[J].Beilstein Journal of Organic Chemistry,2019,15:130-136.DOI:10.3762/bjoc.15.13.
[25] SALES A,MOREIRA R C,PASTORE G M,et al.Establishment of culture conditions for biotransformation of R-(+)-limonene to limonene-1,2-diol by Colletotrichum nymphaeae CBMAI[J].Process Biochemistry,2019,78:8-14.DOI:10.1016/j.procbio.2019.01.022.
[26] GUILA S,VAZQUEZ-DUHALT R,TINOCO R,et al.Stereoselective oxidation of R-(+)-limonene by chloroperoxidase from Caldariomyces fumago[J].Green Chemistry,2008,10(6):647-653.DOI:10.1039/B719992A.
[27] LEE T K,ROH H S,YU J S,et al.Pinecone of pinus koraiensis inducing apoptosis in human lung cancer cells by activating caspase-3 and its chemical constituents[J].Chemical Biodiversity,2016,14(4):e1600412.DOI:10.1002/cbdv.201600412.
[28] LAPPAS C M,LAPPAS N T.D-Limonene modulates T lymphocyte activity and viability[J].Cellular Immunology,2012,279(1):30-41.DOI:10.1016/j.cellimm.2012.09.002.
[29] ALEXANDRINO T D,DE MEDEIROS T D M,RUIZ A L T G,et al.Structural properties and evaluation of the antiproliferative activity of limonene-1,2-diol obtained by the fungal biotransformation of R-(+)- and S-(-)-limonene[J].Chirality,2022,34(6):887-893.DOI:10.1002/chir.23439.
[30] BLAIR M,TUCK K L.A new diastereoselective entry to the (1S,4R)- and (1S,4S)-isomers of 4-isopropyl-1-methyl-2-cyclohexen-1-ol, aggregation pheromones of the ambrosia beetle Platypus quercivorus[J].Tetrahedron: Asymmetry,2009,20(18):2149-2153.DOI:10.1016/j.tetasy.2009.08.009.
[31] LEUNG A E,RUBBIANI R,GASSER G,et al.Enantioselective total syntheses of the proposed structures of prevezol B and evaluation of anti-cancer activity[J].Organic and Biomolecular Chemistry,2014,12(41):8239-8246.DOI:10.1039/C4OB01662A.
[32] LEUNG A E,BLAIR M,FORSYTH C M,et al.Synthesis of the proposed structures of Prevezol C[J].Organic Letters,2013,15(9):2198-2201.
[33] SILVA A C R D,LOPES P M,AZEVEDO M M B D,et al.Biological activities of α-pinene and β-pinene Enantiomers[J].Molecules,2012,17(6):6305-6316.DOI:10.3390/molecules17066305.
(責任編輯: 錢筠 ??英文審校: 劉源崗)
收稿日期: 2023-02-03
通信作者: 楊道茂(1975-),男,講師,博士,主要從事微生物生物轉化的研究.E-mail:ydmao@hqu.edu.cn.
基金項目: 國家級大學生科創項目(202110385039); 福建省個人和團隊科技員項目(2022年度); 華僑大學高層次人才科研啟動資金資助項目(Z15X0004)
http:∥www.hdxb.hqu.edu.cn

