Fe7S8/C材料電催化處理有機廢水的綜合實驗設計
肖娟,王毅,宋樹芹
(1.中山大學化學工程與技術學院,廣東 廣州 510275;2.中山大學材料科學與工程學院,廣東 廣州 510275)
0 引言
實驗教學是連接理論知識和實踐應用的紐帶[1]。傳統的實驗教學以教師講解、演示,學生觀察、自行實驗為主,這種教學模式無法充分調動學生自主學習與實驗的積極性,不能有效培養學生的科研實踐能力[1]。目前各高校與時俱進,以“科教融合、學術育人”理念為指導,改進實驗教學方法,增設科研項目型實驗,以期提高學生的綜合科研素養,為創新型人才的培養奠定堅實的基礎[2]。在此背景下,本實驗將自身科研成果融入到相應實驗教學中,設計了Fe7S8/C材料制備及電催化處理有機污染物的綜合實驗。
1 實驗背景
近年來,水污染導致水質惡化、缺水危機和生態環境破壞等問題,給人類和社會帶來諸多危害[3]。異相電芬頓技術利用陰極原位生成的H2O2與固態鐵基催化劑反應,產生具有強氧化性的羥基自由基(-OH),快速降解有機污染物,是一種極具應用前景的水處理技術。然而,該技術存在固相催化劑易團聚、Fe3+難還原、金屬離子溶出等問題。因此,提高催化劑的分散性和穩定性,加速Fe3+/Fe2+轉化以促進Fe2+再生是提高其芬頓活性的關鍵。
鐵基金屬有機骨架材料(Fe-MOF)一般是由含N、O等原子的多齒有機配體與鐵離子通過配位作用自組裝而成的多孔功能材料。以Fe-MOF為前驅體制備的具有多級孔結構、碳包覆、高分散的Fe/C納米顆粒,不僅有助于污染物吸附,還能夠提供更多的活性位點,在水處理領域顯示出巨大的應用潛力。
因此,本文將Fe-MOF衍生的Fe7S8/C催化劑與異相電芬頓技術相結合,研究其羅丹明B的降解性能。本實驗設計涵蓋了MOF材料合成及衍生技術、降解性能測試及數據分析,是一套完整的實驗教學體系。學生通過文獻調研和實驗操作,不僅能加深對相關基礎知識的理解,還能提升其綜合實驗技能,培養其科研創新意識。
2 實驗設計
2.1 實驗試劑與儀器
主要試劑:六水合三氯化鐵、對苯二甲酸、N,N-二甲基甲酰胺(DMF)、5,5-二甲基-1-吡咯啉-N-氧化物等;升華硫、硫脲、羅丹明B(RhB)、甲醇、硫酸、氫氧化鈉、無水硫酸鈉等。上述藥品均為分析純。石墨氈(GF),經多次乙醇、水洗后,干燥備用。
主要儀器:X射線衍射儀,掃描電子顯微鏡,透射電子顯微鏡,X射線光電子能譜儀,紫外可見分光光度計,電化學工作站。
2.2 Fe7S8/C/GF陰極材料的制備
(1) Fe-MOF:在100 mL聚四氟乙烯內襯中依次加入六水合三氯化鐵(1.352 g)、對苯二甲酸(0.831 g),N,N-二甲基甲酰胺(60.0 mL),攪拌均勻后置于不銹鋼釜中,在100 ℃反應24 h后,自然冷卻到室溫。將產物取出,離心分離,用DMF洗滌數次,在80 ℃真空干燥12 h,即得棕色粉末Fe-MOF。
(2) Fe7S8/C催化劑:將硫脲(2.000 g)、Fe-MOF前驅體(1.000 g)置于各自瓷舟中,分別將其放置于管式爐進氣端和出氣端,在N2氛圍下600 ℃煅燒1 h(升溫速率為10 ℃/min),得到黑色粉末t-Fe7S8/C。為了比較硫化作用對材料性能的影響,采用上述制備方法,不添加硫源,或添加升華硫,分別制得Fe3O4/C、s-Fe7S8/C催化劑。
(3) Fe7S8/C/GF電極:將催化劑(25.0 mg)置于水(1.20 mL)、乙醇(0.60 mL)和Naf ion(5 wt.% 杜邦公司)(0.20 mL)的混合溶液中,再經超聲分散后獲得漿液。將之均勻涂覆在預處理過的GF兩面,即得Fe7S8/C/GF。
2.3 電催化降解測試
采用Fe7S8/C/GF、鉑片、Ag/AgCl分別作為三電極體系的陰極、陽極和參比電極,在H池(采用質子交換膜將陰極和陽極隔開)中進行電催化降解實驗。反應溶液為含有硫酸鈉(0.1 M)的RhB溶液(20.0 mg/L),pH值約為5.6。向上述溶液中通入飽和氧氣后,并保持持續通氧,采用恒電壓模式(-0.5 V vs. Ag/AgCl),開啟反應。每隔一段時間取樣,在取出的樣品中加入過量的甲醇終止反應。采用紫外可見分光光度法在554 nm波長處實時監測RhB的濃度;采用草酸鈦鉀分光光度法和鄰菲啰啉顯色法分別測定反應液中的H2O2和鐵離子濃度。
3 實驗結果
3.1 材料結構與形貌表征
元素摻雜是常見的材料活化方法之一。本實驗在材料制備過程中引入升華硫、硫脲等,探索硫摻雜對材料結構和性能的影響,啟發學生思考材料合成、結構與性能之間的內在關聯。圖1(a)為Fe3O4/C、s-Fe7S8/C和t-Fe7S8/C材料的XRD圖。Fe3O4/C材料在30.2、35.5、37.1、43.1、57.0和62.6°處的衍射峰,分別對應Fe3O4(JCPDS No.19-0629)的(220)、(311)、(222)、(400)、(511)和(440) 晶面[4]。以升華硫或硫脲為硫源,Fe-MOF炭化產物的XRD衍射峰基本一致,均在30.1、34.1、43.9、53.3、57.3、65.0和71.3°處存在衍射峰,分別對應Fe7S8(JCPDS No. 52-1516)的(21)、(23)、(402)、(23)、(225)、(008)和(442)晶面[5]。
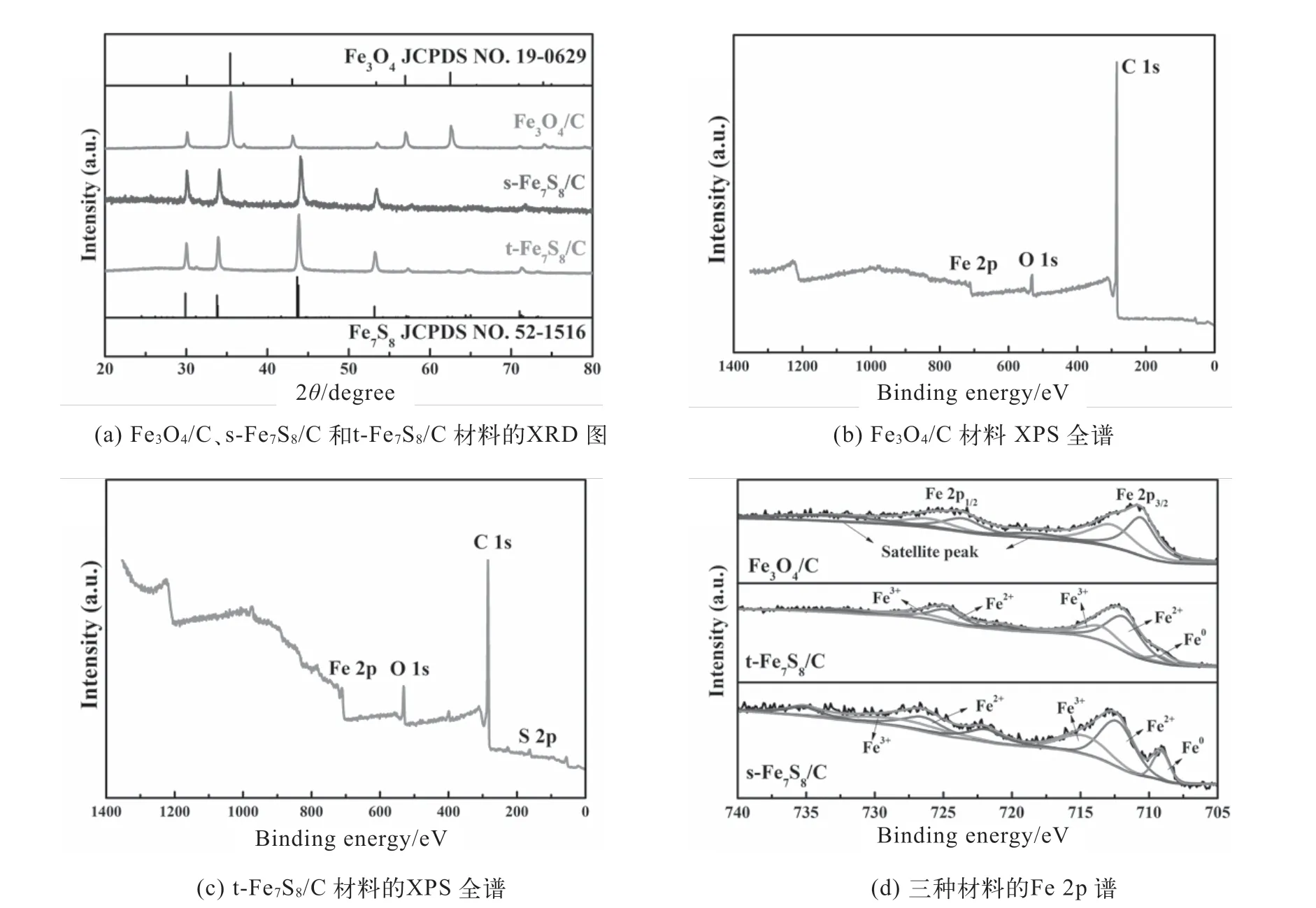
圖1 各材料的結構和成分分析譜圖
圖1(b)和1(c)是Fe3O4/C和t-Fe7S8/C的XPS全譜圖,如圖所示,Fe3O4/C具有C1s、O1s和Fe2p等典型峰;s-Fe7S8/C和t-Fe7S8/C均具有S2p、C1s、O1s和Fe2p等典型峰(以t-Fe7S8/C為例)。如圖1(d)所示,Fe3O4/C的Fe2p軌道電子結合能譜顯示了6個分別位于710.2/723.9、712.0/ 725.6和719.7/ 731.7 eV的譜峰,分別歸屬于Fe2+、Fe3+,以及它們的衛星峰[4-5];而s-Fe7S8/C和t-Fe7S8/C的Fe 2p譜圖中出現一個位于707.5 eV的新峰,對應于Fe0[5]。Fe3O4/C、s-Fe7S8/C和t-Fe7S8/C材料中Fe0、Fe2+和Fe3+的含量分別為0、53.8%、46.2%,5.9%、60.6%、33.5%和10.5%、54.1%、35.4%。XPS結果進一步證明已成功制備了鐵硫化物,以硫脲為硫源制備的t-Fe7S8/C具有更高的Fe0和Fe2+含量,推測其可能會具有較好的催化分解H2O2活性。
利用SEM和TEM對催化劑的微觀形貌進行分析,通過調控放大倍數,對催化劑進行多方位觀察。如圖2所示,s-Fe7S8/C和t-Fe7S8/C形貌相似,約100 nm的碳包覆的Fe7S8顆粒被分散在碳骨架中,t-Fe7S8/C中Fe7S8顆粒在碳骨架中的分散性更好。
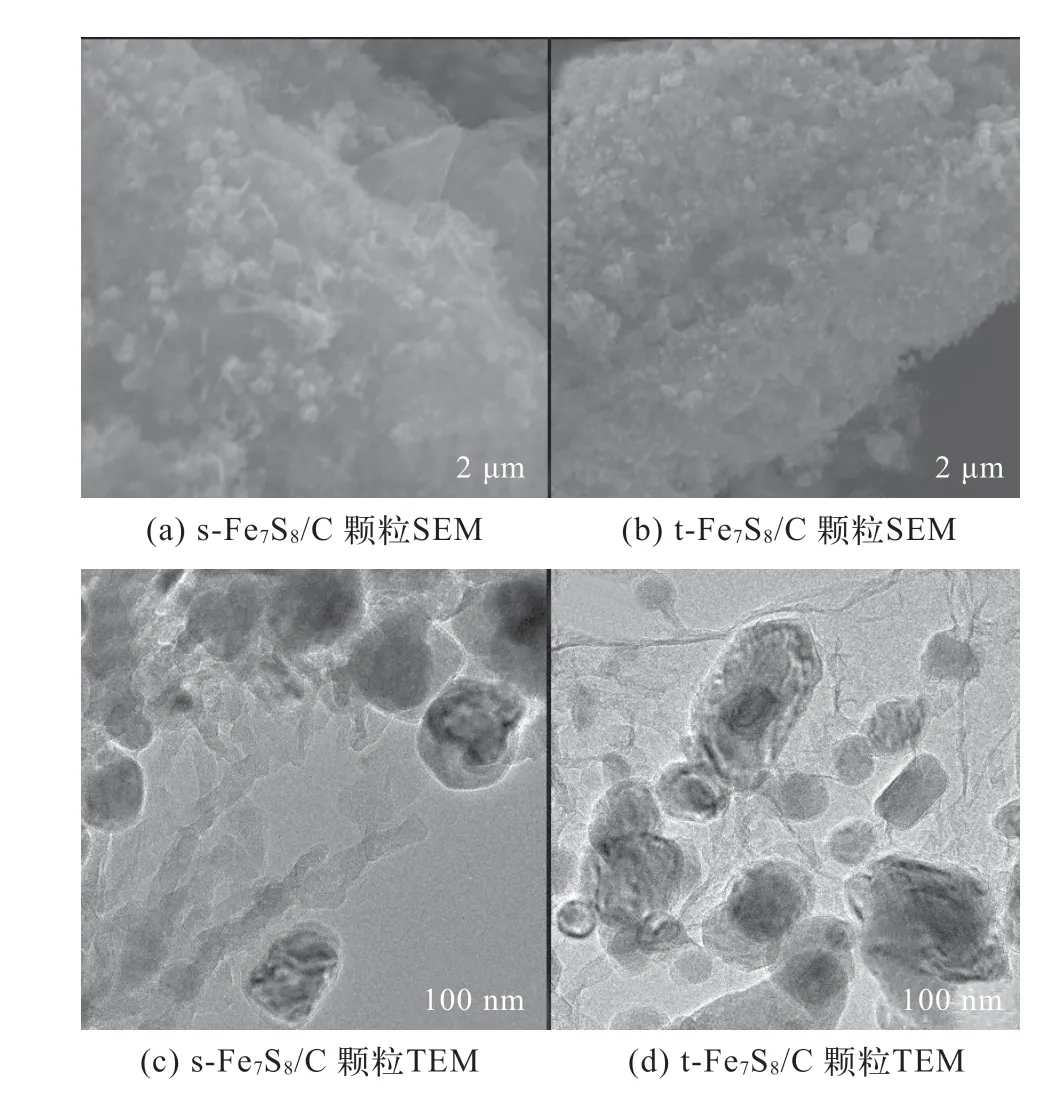
圖2 s-Fe7S8/C和t-Fe7S8/C材料的SEM和TEM圖
3.2 電催化降解性能分析
本實驗研究了上述三種催化劑的RhB電催化降解行為。如圖3(a)和3(b)所示,Fe3O4/C、s-Fe7S8/C和t-Fe7S8/C體系在反應1 h內對RhB去除率分別為81.80、94.92和98.64%;相應的反應速率常數分別為0.028、0.052和0.074 min-1。另外,分析了反應1 h時H2O2殘余量和鐵溶出情況,如圖3(c)所示。無RhB的t-Fe7S8/C體系反應1 h后H2O2殘余量為201.31 mg/L;加入RhB后,其H2O2殘余量顯著下降至15.70 mg/L,鐵溶出量僅為0.11 mg/L。s-Fe7S8/C體系的H2O2殘余量和鐵溶出量分別為10.36和0.16 mg/L,與t-Fe7S8/C體系相似,說明合成的鐵硫化物可快速分解H2O2,且具有較好的穩定性。圖3(d)是t-Fe7S8/C的循環降解圖,其經過5次循環降解RhB后,該催化劑的RhB去除率僅下降約5%,進一步說明t-Fe7S8/C具有良好的降解穩定性。
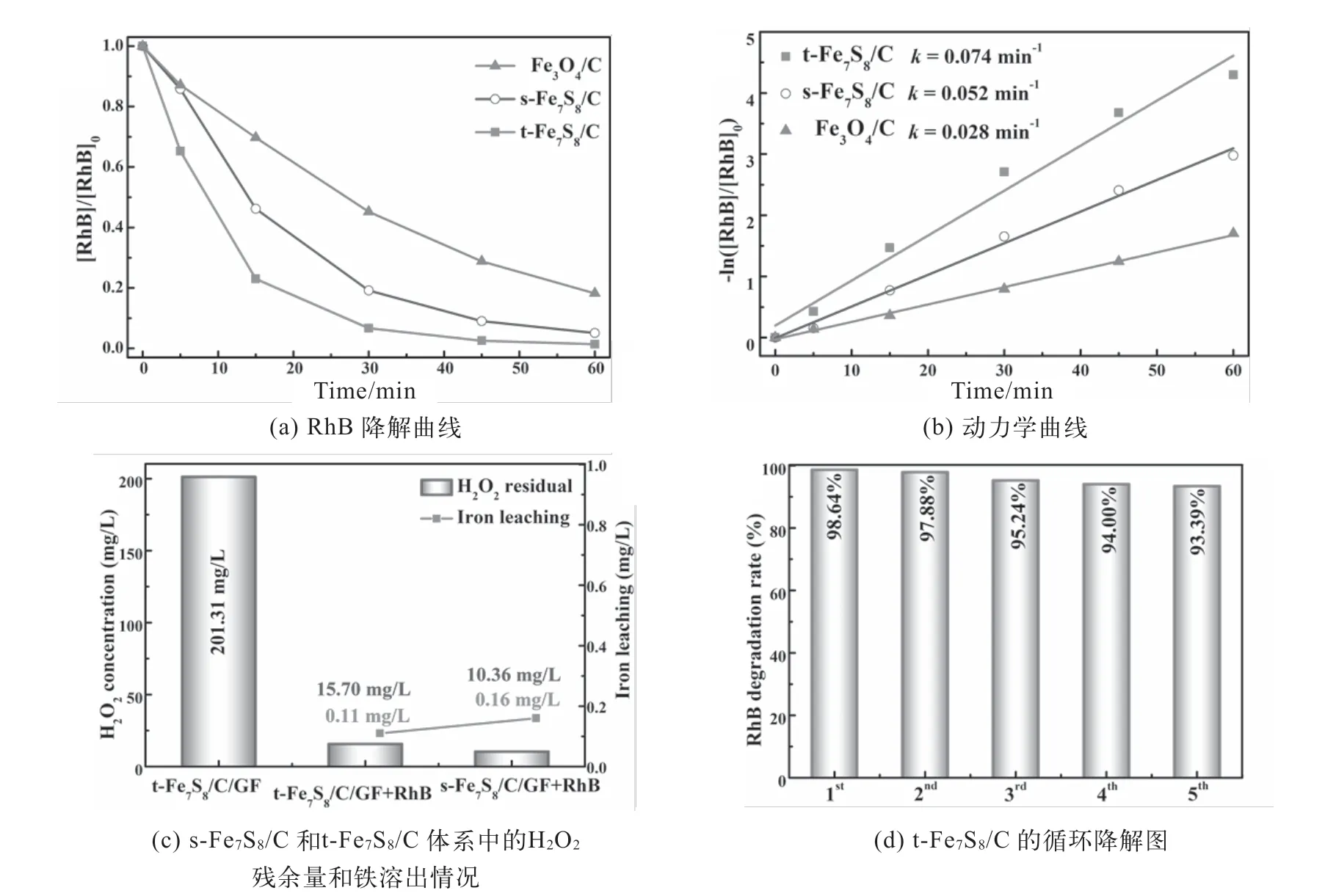
圖3 Fe3O4/C、s-Fe7S8/C和t-Fe7S8/C在H池體系中電催化性能分析圖
綜上所述,硫摻雜能有效解決Fe3+/Fe2+轉化受限問題,獲得的t-Fe7S8/C催化劑具有最佳的RhB降解性能和良好的穩定性。通過材料制備、材料物化表征及其在電Fenton處理廢水中的應用,讓學生深刻理解電催化體系中電極材料結構等對有機污染物降解的影響。
3.3 實驗教學特點
本實驗針對水環境污染與治理研究領域,結合學生的認知水平和教師的科研課題,選取熱門的MOF材料為研究對象,設計了Fe7S8/C材料的合成及其電催化降解RhB的綜合實驗。其教學學時為8 h,4人為一組,全班共分6組。每組的具體分工由組員討論而定,建議分工如下:1人負責XRD和XPS表征及數據分析;1人負責SEM和TEM表征及數據處理;2人負責降解性能測試及相關數據處理。以每組為單位,自行調研文獻,設計實驗方案,并以PPT的形式展示完整的實驗報告。
本實驗涉及到的基礎知識涵蓋廣泛,包括電極制備、材料表征、電催化反應體系搭建及有機污染物降解性能測試等內容,適用于化學、材料、 環境及相關專業學生的綜合實驗。學生通過這種科研反哺教學的體驗,了解MOF及其衍生材料合成和電化學水處理技術的同時,還感受到化學、材料學和環境學科等多學科交叉在材料制備和表征等方面的創造力和實用性。該綜合實驗有助于啟發學生觀察細節,探究科學本質,培養學生多方位的研究思維和追根求源的科研素養。
4 結語
本實驗以MOF材料為出發點,設計合成了Fe7S8/C/GF電芬頓陰極。本實驗所涉及材料制備與表征、電催化降解性能測試等,操作安全、易重復,將該實驗引入本科實驗教學中,實現了科研反哺教學,有效促進科教融合,能讓學生掌握相關理論知識和實驗技能的同時,激發學生對前沿科學的探索興趣和創新思維,有利于提升人才培養質量。

