某污染場地地下水中溶解性有機質組成特征及其自然衰減指示作用
趙萌,姜永海,賈永鋒,廉新穎,尚長健,臧永歌,馮帆,3*
1.環境基準與風險評估國家重點實驗室,中國環境科學研究院
2.國家環境保護地下水污染模擬與控制重點實驗室, 中國環境科學研究院
3.北京師范大學水科學研究院
監測自然衰減(monitored natural attenuation,MNA)是一種利用污染場地天然存在的修復能力來降低污染物濃度,減小污染物總量的地下水污染修復方法,生物降解作用是其中的重要機制[1-2]。應用監測自然衰減技術的場地要制定一系列的監測計劃以掌握場地污染羽狀態、降解進程和自然衰減能力等,然而目前自然衰減效果的主要評價方法如污染物濃度分析法、水文地球化學指標方法、穩定同位素分析方法和微宇宙實驗方法等,均不能快捷高效地識別出已發生的生物降解作用及其微生物活躍程度[3]。
溶解性有機質(DOM)是地下水環境中普遍存在的有機化合物的復雜混合體,它作為碳循環中的重要有機組成成分,在一定程度上反映地下水中有機污染物的來源、形態及微生物代謝能力[4],并且與水化學特征[5-7]及與以生物作用為主的自然衰減過程相關[8-9]。人類活動如垃圾填埋場滲濾液下滲、再生水補給、農業灌溉等均會增加地下水中的DOM 濃度,DOM 中類蛋白等小分子物質可以充當電子供體及微生物的能量來源,從而提高微生物活性,增加微生物代謝能力;DOM 中類腐殖質物質中具有氧化-還原活性的醌類化合物可以促進微生物參與的降解有機物的過程[10-11]。因此,研究地下水中DOM 的結構組成等特征,對闡明有機污染物在地下水中的降解轉化過程具有非常重要的意義。
目前針對DOM 結構組成和理化特征研究中,現代光譜技術已得到廣泛應用。熒光光譜技術(EEM)可以直觀地反映DOM 的熒光信息,應用熒光區域體積積分法(FRI)可以確定DOM 的結構和組成并對其進行半定量分析;紅外光譜法(FTIR)可用于確定有機物分子的官能團結構;熒光技術可用于監測水生生態系統中的石化污染物,如對石油殘留物濃度進行估算[12],Podgorski 等[13]證明了光學組合技術在評估地下水中石油衍生溶解有機物的自然衰減方面具有一定效用。
筆者將污染羽中的生物降解作用及其微生物活躍程度與DOM 表征相結合,以山東省某污染場地地下水為研究對象,通過分析DOM 組成及結構的空間變化規律,研究DOM 對地下水中有機污染自然衰減進程的指示能力,以期為地下水有機污染自然衰減的識別提供依據。
1 研究區與研究方法
1.1 研究區
研究場地為山東省某退役農藥廠生產區,該廠已停產近9年,在產期間主要生產各類農藥和氯堿產品,現生產區所有建筑已拆除。該場地位于山前沖積平原,其地形平坦,地表完整。區域氣候屬于暖溫帶半濕潤季風型大陸性氣候,全年平均氣溫為12.6~13.1 ℃,多年平均降水量為630~654 mm。
場地調查結果顯示,研究區域地層可劃分為雜填土(0~1.8 m)、粉質黏土(1.8~6.8 m,10.6~14.2 m)、粉土(6.8~10.6 m)和泥質膠結碎石層(14.2 m 以下)。該場地淺層地下水為孔隙水,屬于Na-Ca-Cl型,其流向為東北至西南。由于前期調查中發現原備料倉庫附近存在污染,故而于該備料倉庫與廠房處沿地下水流場方向設置4 個地下水監測井(圖1)。
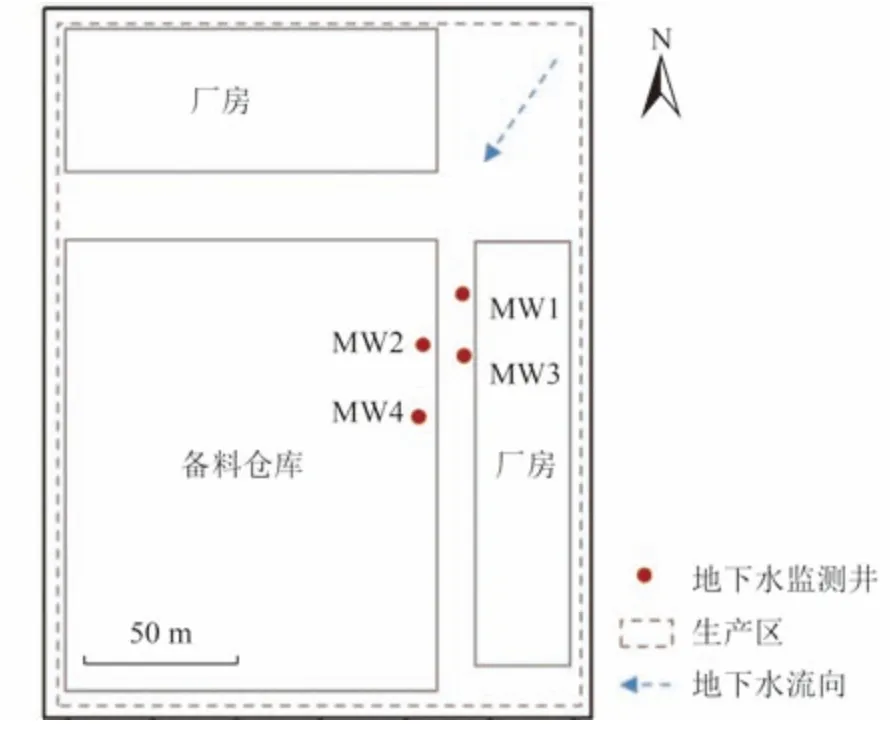
圖1 地下水流向及地下水監測井分布Fig.1 Groundwater flow direction and locations of the groundwater wells
1.2 樣品采集與分析
1.2.1 地下水樣品采集與處理
于2021年10 月采集地下水樣品。現場使用便攜式多參數測定儀進行水樣的常規物理化學指標測試,包括pH、溶解氧(DO)濃度、溶解性總固體(TDS)和氧化還原電位(ORP)。水樣經0.45 μm 的玻璃纖維濾膜過濾后置于4 ℃保存,待測。采用離子色譜儀(ICS 2000)測定水質常規離子Na+、Ca2+、K+、Mg2+、Cl-、和濃度;使用總有機碳分析儀測定地下水樣品中總有機碳(TOC)濃度;使用EDTA 容量法測定總硬度;使用高錳酸鹽法測定耗氧量。依據HJ 639—2012《水質 揮發性有機物的測定 吹掃捕集/氣相色譜-質譜法》和HJ 894—2017《水質 可萃取性石油烴(C10~C40)的測定 氣相色譜法》的要求采集、測定VOCs 和石油烴(C10~C40)濃度。
采用熒光分光光度計(F-7000)進行DOM 熒光測試,掃描間隔激發波長(Ex)=5 nm,發射波長(Em)=5 nm;三維熒光光譜測試設定Ex 為200~450 nm,Em 為250~600 nm,掃描速度2 400 nm/min;同步熒光光譜測試設定掃描波長為200~450 nm,波長差(Δλ) 為60 nm,掃描速度為240 nm/min。采用傅里葉紅外變換光譜儀(Tensor Ⅱ)進行水樣有機分子官能團的測試,以透射模式測試,光譜范圍為400~4 000 cm-1,掃描次數為16,分辨率為4 cm-1。
采用常用熒光特征參數熒光指數(FI)、生物指數(BIX)、腐殖化指數(HIX)和新鮮度指數(β∶α)分析DOM 的來源及特征。FI 為Ex=370 nm 時,Em 分別在450 和500 nm 處的熒光強度比值。BIX 為Ex=310 nm 時,Em 分別在380 和430 nm 處的熒光強度比值。HIX 為Ex=255 nm 時,Em 分別在434~480與300~346 nm 區域處的積分比值。β∶α為Ex=310 nm 時,Em=380 nm 的熒光強度與Em 在420~435 nm 區間最大熒光強度的比值。
依據HJ/T 164—2004《地下水環境監測技術規范》在采樣階段和實驗室分析階段均采取了相應的質量保證和控制措施,測試誤差保證在10%以內,合格率為100%。
1.2.2 DNA 提取與宏基因組測序
在現場使用真空泵及0.22 μm 無菌濾膜將4 L地下水樣品進行抽濾,所得濾膜立刻于-80 ℃冷凍保存。使用FastDNA?Spin Kit for Soil 試劑盒(MP Biomedicals,美國) 提取總基因組DNA,使用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′) 和806R(5′-GGACTACHVGGGTWTCTAAT-3′) 對16S rRNA 基因V3~V4 可變區進行PCR 擴增。分別用TBS-380 和NanoDrop2000 測定提取DNA 的濃度和純度,利用1%瓊脂糖凝膠電泳檢測抽提的基因組DNA。通過非接觸式超聲波破碎儀(Covaris M220)將DNA 剪切成約400 bp 片段。而后采用NEXTFLEX? Rapid DNA-Seq Kit 進行PE 文庫構建。宏基因組測序采用Illumina 公司的NovaSeq 6000 測序平臺進行。
使用Faslp軟件(http://opengene.org/fastp/,version 0.20.0)對原始測序序列進行質控,使用Megahit 軟件(http://www.I3-bionfo.com/products/megahit/,version 1.1.2)對原始測序序列進行測序數據組裝。使用MetaGene(http://metagene.cb.k.u-tokyo.ac.jp/)對拼接結果進行ORF 預測,選擇核酸長度≥100 bp 的基因,并將其翻譯為氨基酸序列。將所有樣品預測出來的基因序列,用CD-HIT 軟件(http://www.bioin formatics.org/cd-hit/,version 4.6.1)進行聚類,每個類取最長的基因作為代表序列,構建非冗余基因集。使用Diamond 軟件(https://github.com/bbuchfink/dia mond,version 0.8.35)將非冗余基因集序列與 eggNOG數據庫(http://eggnog.embl.de/,version 4.5)進行比對(比對類型:BLASTP)。以上數據使用美吉生物云在線平臺(www.majorbio.com)進行分析。
1.3 數據處理與分析
根據Chen 等[14]提出的FRI 法,將溶解性有機物的熒光區域分成5 個部分:1)區域Ⅰ,Ex 為200~250 nm、Em 為280~330 nm 的酪氨酸類蛋白區;2)區域Ⅱ,Ex 為200~250 nm、Em 為330~380 nm 的色氨酸類蛋白區;3)區域Ⅲ,Ex 為200~250 nm、Em 為380~550 nm 的類富里酸區;4)區域Ⅳ,Ex 為250~450 nm、Em 為280~380 nm 的溶解性微生物代謝副產物區;5)區域Ⅴ,Ex 為250~450 nm、Em 為380~550 nm 的類腐殖質區。熒光區域體積積分按各區域的有效數據采用離散積分公式進行積分計算,公式如下:
式中: Φi為區域i的熒光體積積分,a.u.·nm2,i為1~5;ΔλEx為激發波長間隔,nm;ΔλEm為發射波長間隔,nm;I(λEmλEx)為熒光強度,a.u.。
分區熒光體積積分占比(Pi)為區域i積分體積占總積分體積之比,計算公式如下:
采用Matlab2020b 軟件進行三維熒光光譜圖的繪制,運用Excel、Origin2021 軟件分析處理數據并繪制相關圖件。
2 結果與分析
2.1 場地有機污染分布特征
該污染場地4 個地下水監測井常規水質指標及特征污染物指標如表1 所示。由表1 可見,該場地地下水呈弱酸性,TDS、總硬度和耗氧量較高,主要有機污染物為石油烴、苯和氯乙烯。其中MW1 井有機污染最嚴重,另外3 個井的有機污染程度相對較輕。
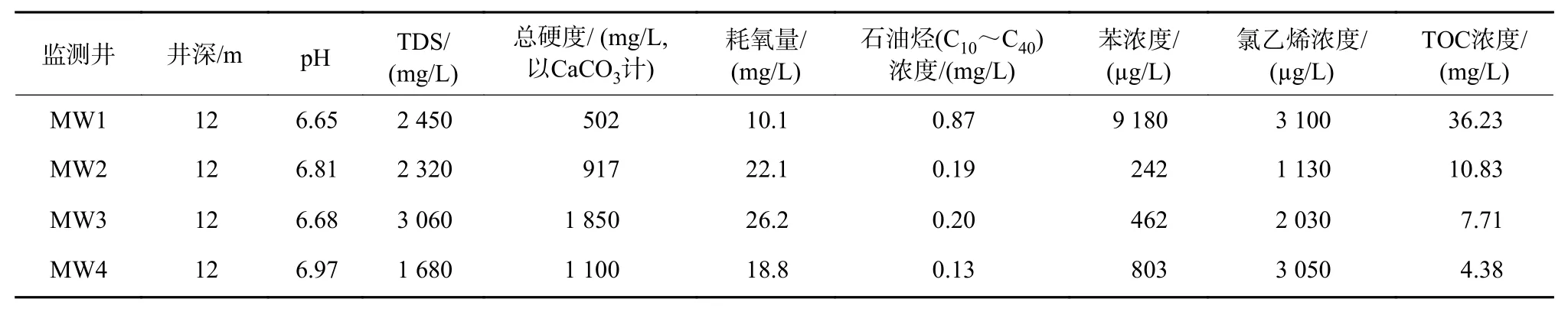
表1 各監測井地下水常規水質指標及特征污染物指標Table 1 Statistical information on the groundwater conventional quality indicators and characteristic pollutant indicators in various monitoring wells
2.2 地下水DOM 的組成特征
為了評估該場地地下水受到有機污染后的微生物作用,對該場地4 個監測井的地下水樣品進行同步熒光光譜測試及傅里葉紅外光譜測試,研究其DOM 組成特征(圖2)。由圖2 可知,4 個監測井水樣均在波長245~310 nm 存在1 個尖峰,代表類蛋白(酪氨酸)物質;MW1 和MW2 井還在波長200~245 nm 存在1 個尖峰,代表類蛋白(色氨酸)物質。研究表明,隨著污染羽在地下環境中的擴散,有機污染降解伴隨的氧化還原反應會按序列順序相繼發生[15]。微生物降解過程中,脂肪類等物質會優先被消耗,生成酪氨酸、色氨酸等代謝副產物,但該類物質具有較強的生化性,很容易被微生物利用,在相應微生物和酶的作用下,木質素類等物質會水解并與氨基酸類物質發生縮合形成類腐殖質物質[16]。故而外源有機污染物的輸入可造成地下水中酪氨酸、色氨酸物質與類腐殖質物質的增加[17],這解釋了同步熒光光譜中存在代表類蛋白物質尖峰的原因。考慮到沉積物會有向地下水中輸入類蛋白物質與類腐殖質物質的可能,本研究對相應監測井的含水層沉積物進行了DOM 提取和熒光分析,結果發現沉積物DOM 與地下水DOM 所呈現的光譜信息重合度不高,由此可以判定該場地地下水所呈現的DOM 特征主要源于地下水中有機污染物的降解反應。因此,該場地地下水在有機污染的刺激下,可能存在微生物降解作用生成的酪氨酸、色氨酸等代謝副產物。

圖2 各監測井地下水樣同步熒光光譜Fig.2 Synchronized fluorescence spectra of groundwater samples from various monitoring wells
各監測井地下水樣品DOM 的傅里葉紅外光譜圖如圖3 所示。4 個監測井DOM 樣品的透射峰位置基本一致,分別位于3 258、2 361、2 160、2 029、1 976、1 635 cm-1附近。其中在3 258 cm-1附近出現的寬峰為羥基中的O—H 或氨基中的N—H 伸縮振動[18],在2 361、2 160、2 029、1 976 cm-1附近出現的峰為C≡C 和C= C、C= N 累積雙鍵的伸縮振動,在1 635 cm-1附近的峰為芳香烴的C—C 伸縮振動或N—H 的彎曲振動[19-20]。上述結果表明,該場地地下水在有機污染的刺激下,微生物活動不僅富集了酪氨酸、色氨酸等代謝副產物,還含有大量的腐殖質物質,具有復雜的芳香特性。
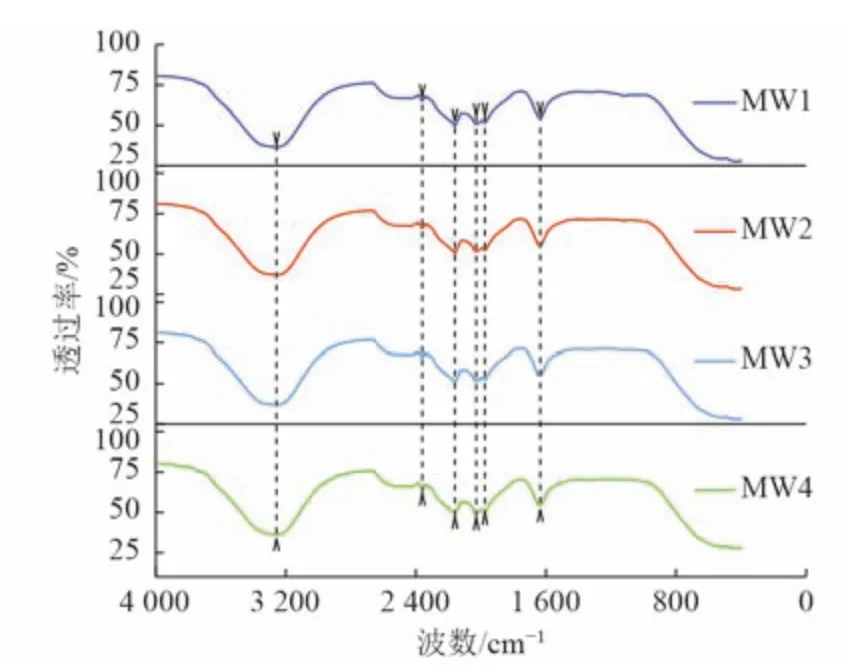
圖3 各監測井地下水樣DOM 紅外光譜Fig.3 FTIR spectra of DOM of groundwater samples from various monitoring wells
因該場地地下水涉及的主要有機物包括苯系物和石油烴等屬于熒光物質[21-22],故可以通過熒光峰的分布及強度分析有機污染物及降解產物的情況。對4 個監測井的地下水樣品進行三維熒光光譜測試,結果如圖4 所示。光譜中主要涉及3 個熒光峰,其中心分別位于Ex/Em 為200~230/275~315 nm(C1)、225~250/330~400 nm(C2)和230~260/350~450 nm(C3)處。

圖4 各監測井地下水樣三維熒光光譜Fig.4 Three-dimensional fluorescence spectrum of groundwater samples from various monitoring wells
表2 總結了本研究所涉及的有機污染物及降解產物在已有研究中的三維熒光光譜信息。由表2 可知,位于C1處的熒光峰與石油烴及其降解產物有關,位于C2處的熒光峰與石油烴、苯系物和多環芳烴及其降解產物有關,位于C3處的熒光峰與微生物降解作用有關的類腐殖質物質有關。本研究C1和C2處熒光峰的存在說明了地下水在有機污染物的刺激下,發生了微生物降解作用。Mendoza 等[23]研究發現,C3處類腐殖質物質隨微生物降解活動的增強而增加,這間接地說明了MW3 和MW4 井同樣存在相應的微生物降解作用。
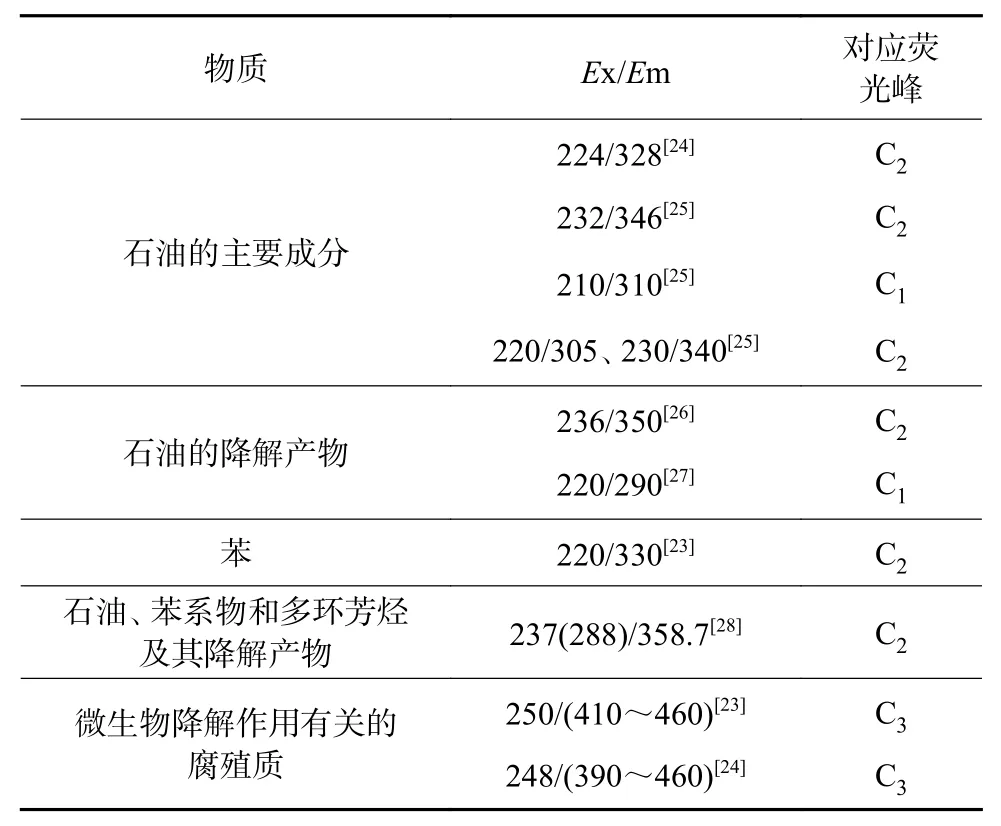
表2 已有研究中部分常見有機污染物及相關降解產物三維熒光光譜信息Table 2 Three-dimensional fluorescence spectral information of some common organic pollutants and related products of degradation in previous researches
相比于其他3 個監測井,有機污染程度嚴重的MW1 井水樣不僅具有較高的熒光強度,熒光峰也主要集中在C1和C2處。MW2~MW4 監測井水樣中,MW2 井水樣熒光峰除存在于C1和C2處外,還存在于C3處;MW3 和MW4 井水樣熒光峰較為集中,主要存在于C3處。這說明在有機污染物的刺激下,微生物降解強度的差異會造成地下水DOM 組成的不同,MW1 井降解有機污染物的作用最強烈,MW3 和MW4 井降解有機污染物的作用相對較弱。
對于有機污染較為嚴重的MW1 井,C1和C2處代表的污染物及代謝副產物的積累遠多于C3處代表的類腐殖質物質的積累。對有機污染程度相對較輕的3 個監測井,MW2 井中污染物及代謝副產物的積累現象均可以觀察得到,而MW3 和MW4 井只能觀察到C3處代表的類腐殖質物質的積累。這可能是由于C1和C2處代表的物質被進一步轉化,且轉化速率相比于有機污染物降解產生的代謝副產物的積累速率更高,因此只體現為有機污染物降解作用下的類腐殖質物質的積累。
2.3 地下水DOM 來源及腐殖化程度的熒光參數表征
FI、BIX、HIX 和β∶α是分別用來表征DOM 來源、自生源相對貢獻率、腐殖化程度和新生DOM 所占比例的指標。研究區各監測井地下水的FI、BIX、HIX 和β∶α如表3 所示。由表3 可知,各監測井地下水FI、BIX 和β∶α差異較小,FI>1.8,BIX>1,說明各監測井地下水自生源特征較為明顯,且有機質為新近產生,生物可利用度較高;HIX<4,說明該地下水屬于弱腐殖化特征,MW1 井水樣相比于其他3 個監測井水樣的DOM 來源則更偏向于微生物活動產生。綜上,該場地地下水DOM 主要源自生物作用。

表3 各監測井地下水的FI、BIX、HIX、β∶α 指數描述統計Table 3 Descriptive statistics of FI, BIX, HIX, (β∶α) of groundwater in various monitoring wells
為了進一步評估該場地地下水受有機污染后生物作用下的生物轉化程度和腐殖化程度,對該場地4 個監測井地下水樣品進行熒光區域積分分析(FRI),結果見表4。根據FRI 法對DOM 熒光區域的劃分:Ⅰ、Ⅱ區代表的類蛋白物質可能是微生物代謝產物,也可能是微生物容易利用的小分子有機物;Ⅴ區代表的類腐殖質物質可能是來源于沉積物的溶出及有機物的重組,組成較為復雜,難被微生物所利用[14,29-31]。由表4 可知,4 個監測井水樣的熒光分區Ⅲ和Ⅳ所占比例(PⅢ、PⅣ)相差不大,為10.74%~18.68%。熒光分區Ⅰ、Ⅱ、Ⅴ所占比例(PⅠ、PⅡ、PⅤ)有所差異。對微生物降解作用強烈的MW1 井水樣而言,PⅠ、PⅡ較高,分別為17.44%和22.42%,PⅤ最低,為29.43%;對微生物降解作用較弱的MW3、MW4 井水樣而言,DOM 呈弱腐殖化,PⅠ、PⅡ均較小,分別為0.58%、1.13% 和5.33%、6.91%,PⅤ較大,分別為63.87%、61.54%;而對于微生物降解作用稍弱的MW2 井水樣,其PⅠ、PⅡ不及MW1 井水樣、PⅤ不及MW3、MW4 井水樣。結合2.2 節可知,在地下水有機污染持續存在和長期的微生物作用下,類腐殖質物質總體占比很高,地下水的生物化學性質也相對穩定[32],但隨著生物降解作用越來越強烈,以酪氨酸、色氨酸等為代表的類蛋白物質的生成速率會大于轉化速率,造成DOM 中類蛋白物質所占比例越來越高。

表4 地下水DOM 三維熒光光譜區域積分結果Table 4 Volume integration results of DOM in different regions of three-dimensional fluorescence spectrum of groundwater
2.4 地下水DOM 對自然衰減能力指示作用
生物降解作用已經被認為是自然衰減過程中相對重要的環節。而微生物作用所導致的地下水DOM 的轉換可以在熒光圖譜上被直觀地表征出來。因此熒光圖譜的DOM 信息可以指示地下水中有機污染自然衰減進程。為了進一步明確二者之間的聯系,利用水文地球化學指標分析方法與微生物學分析方法輔助判斷該場地4 個監測井地下水的自然衰減程度。
2.4.1 水文地球化學指標分析方法評估
地下水中可利用的電子受體包括O2、、Fe3+、和CO2等,而相應的還原產物Fe2+、Mn2+、硫化物和CH4等濃度增加則可以說明發生了污染物的氧化還原降解反應[33],電子受體的消耗及相應還原產物的生成越多,說明污染物自然衰減反應程度越強。一般可關注的水化學指標有、、Fe2+、Mn2+等[34-35]。
本研究中背景值的選取參照前人研究中該區域的水文地質調查資料,背景點位于本研究區地下水上游[36]。根據地下水各監測井水化學指標濃度(表5)分析可知,該場地受有機污染的地下水均處于厭氧微還原環境。相較背景值,4 個監測井地下水的電子受體也處于被消耗的階段,MW1 井水樣的反硝化反應尤其明顯。通過水文地球化學指標分析方法輔助判斷的各監測井地下水的自然衰減程度應為MW1>MW2、MW3>MW4。

表5 各監測井地下水水化學指標Table 5 Hydrochemistry indexes of groundwater in various monitoring wells
2.4.2 微生物學分析方法評估
土著微生物會視有機污染物為碳源或輔助代謝物而產生定向響應,進而不斷消耗輸入到地下水中的有機污染物。對于相對厭氧低溫的地下環境來說,有機污染物的氧化還原過程依次包括反硝化過程、鐵還原過程、脫硫酸過程和產甲烷過程。每一過程均有典型的關鍵酶存在,微生物相關過程的酶豐度越高,說明污染物自然衰減反應程度越強。根據相關過程的關鍵酶研究[37-40],挑選出該場地地下水中存在的主要酶,如CoB-CoM 異質二硫化物還原酶(CoB-CoM heterodisulfide reductase)是甲烷生成最后步驟中具有電子傳遞功能的蛋白復合物;亞硫酸鹽還原酶(sulfite reductase)是硫酸鹽還原過程中最為關鍵的功能蛋白之一,可作為用于追蹤硫循環的關鍵分子標志物;硝酸鹽還原酶(nitrate reductase)可以催化硝酸鹽還原過程的第一步。關鍵酶豐度情況如圖5 所示。

圖5 各監測井地下水微生物代謝過程關鍵酶豐度Fig.5 Abundance of major enzymes in the microbial metabolism process of groundwater in various monitoring wells
由圖5 可知,該場地存在3 種地下水氧化還原的主要作用,即反硝化作用、脫硫酸作用和產甲烷作用,且各作用程度有所差異。MW1 井相比于其他3 個監測井產甲烷作用更明顯,反硝化作用稍弱,說明MW1 井已完成了以反硝化為主的氧化還原階段,MW1 井的自然衰減程度最強烈,這與2.4.1 節的分析一致。MW2 和MW3 井相比于MW4 井產甲烷和脫硫酸作用更明顯,說明MW2 和MW3 井氧化還原階段比MW4 井更深入,MW4 井的氧化還原作用僅以反硝化作用為主。通過微生物學分析方法輔助判斷的各監測井地下水的自然衰減程度同樣為MW1>MW2、MW3>MW4。
基于FRI 分區理論并結合上述水文地球化學指標分析方法與微生物學分析方法的佐證,提出可根據地下水中DOM 于Ⅰ、Ⅱ、Ⅴ區的熒光信息來評價受有機污染的地下水在自然衰減過程中已發生的生物降解作用程度。基于2.3 節中提到的地下水受有機污染后,不同程度生物降解作用下的地下水DOM 于Ⅲ、Ⅳ區的熒光體積積分所占比例(PⅢ、PⅣ)相差不大,于Ⅴ區的熒光體積積分占比(PⅤ)總體很高,于Ⅰ、Ⅱ區的熒光體積積分占比(PⅠ+PⅡ)因生物降解作用的增強而增大,故而可將DOM 于Ⅰ、Ⅱ、Ⅴ區相對含量的比值〔P(Ⅰ+Ⅱ)/PⅤ〕用于評價地下水有機污染自然衰減生物作用效果,結果見表5,即P(Ⅰ+Ⅱ)/PⅤ越大,表明自然衰減生物作用越強。
3 結論
(1)通過探究山東某污染場地地下水DOM 結構組成的變化規律發現,生物降解的作用主要涉及到DOM 中類腐殖質和酪氨酸、色氨酸物質的組分變化,在地下水有機污染持續存在和長期的微生物作用下,DOM 中類腐殖質物質占比相對較高,但隨著生物降解作用越來越強烈,以酪氨酸、色氨酸等為代表物質的生成速率會大于轉化速率,造成DOM 中類蛋白物質所占比例逐漸升高。
(2)基于FRI 分區理論結合本研究結果,提出可用特定熒光分區相對含量比〔P(Ⅰ+Ⅱ)/PⅤ〕來推斷地下水受到有機污染后生物降解的程度,并結合水文地球化學指標分析方法與微生物學分析方法加以論證。P(Ⅰ+Ⅱ)/PⅤ的提出說明可將類蛋白物質與類腐殖質物質的相對含量比作為一種替代指標用于評價地下水有機污染的自然衰減能力。

