糖尿病足潰瘍感染患者創面Bcl-2、PDGFR-α表達與預后的關系研究
向 林,董 靖,劉 敏,向光大
中部戰區總醫院內分泌科,湖北武漢 430070
糖尿病足潰瘍(DFU)是糖尿病患者嚴重慢性并發癥之一,據統計,約25%的糖尿病患者會發生DFU[1]。同時DFU也是導致糖尿病患者截肢的主要原因,在所有非創傷性截肢病例中,DFU大約占40%左右[2]。此外,DFU還會增加患者心腦血管疾病以及死亡風險,給患者及其家庭帶來沉重的心理和經濟負擔[3]。感染作為DFU患者創面愈合遷延不愈、反復發生的重要原因之一,也是導致DFU病情加重、致殘、致死的主要原因。研究表明,相較于未感染的DFU患者,伴感染患者的截肢風險增高15.5倍[4]。DFU患者易發生感染的主要原因在于這些患者多伴有神經病變、血管病變,前者可導致痛溫覺減退、足部畸形,增加皮膚破潰風險,引發感染;后者可導致足部干燥破裂,病原菌入侵引發感染[5]。臨床認為DFU感染的發生機制可能與局部高血糖、炎癥反應失衡、生長因子及其受體表達異常等有關[6]。血小板源生長因子(PDGFR)是一種堿性多肽生長因子,只有與靶細胞膜上的特異性受體PDGFR-α結合后才能發揮作用,并直接或間接參與創面愈合的調控[7];B細胞淋巴瘤(Bcl)-2是一種原癌基因,該基因與胰島B細胞的凋亡相關[8],可通過增加其凋亡數量,導致高血糖的出現,進而間接影響創面愈合。但目前有關于Bcl-2、PDGFR-α的研究多集中于小鼠模型或人皮膚潰瘍,對于Bcl-2、PDGFR-α表達與DFU愈合的關系鮮有報道。故本研究旨在探究DFU感染患者創面Bcl-2、PDGFR-α表達與預后的關系。
1 資料與方法
1.1一般資料 選取本院2019年3月至2021年6月診治的125例DFU患者作為研究對象。納入標準:(1)符合DFU診斷指南[9];(2)無血液、自身免疫性相關疾病;(3)患者臨床資料完整。排除標準:(1)非糖尿病引起的潰瘍;(2)潰瘍組織存在明顯壞死、骨髓炎;(3)入組前1個月接受生長因子等敷料或高壓氧治療;(4)合并惡性腫瘤或心腦血管疾病者。根據是否發生感染分為感染組(87例)和未感染組(38例)。兩組患者一般資料比較無統計學意義(P>0.05),具有可比性。見表1。
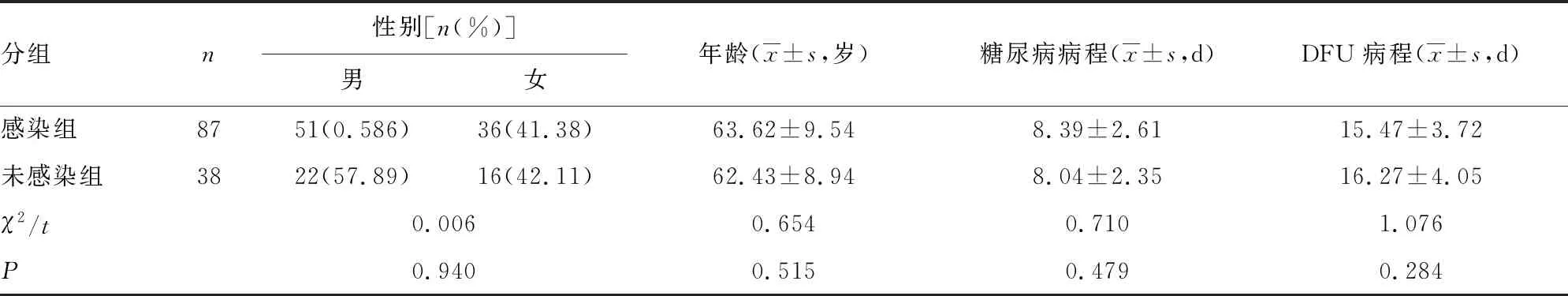
表1 兩組一般資料比較
1.2方法 患者入院后均給予常規清創處理,根據患者具體情況每1~3 d進行1次換藥,清除表面壞死組織。取患者創面中的新鮮肉芽組織,放入液氮中冷卻,然后將組織標準本轉移至-80 ℃冰箱中保存。將肉芽組織研磨呈粉末狀,加1 mL Trizol溶液混勻,室溫靜置5 min。加0.2 mL氯仿溶液,搖勻,室溫靜置3 min。在4 ℃、離心力12 000×g的情況下離心15 min。取上層水相,以1∶1的體積加異丙醇,在4 ℃、離心力12 000×g的情況下離心15 min。棄去上清液,加1 mL的75%的乙醇溶液,震蕩洗滌,在4 ℃、離心力7 500×g的情況下離心5 min。棄去上清液,自然風干5~10 min。加入去離子水洗滌,于55 ℃下恒溫孵育10 min,提取總RNA。引物序列:PDGFR-α上游和下游(5′-3′)分別為GACACTGGGAGATTCGGAGC 和AGAGATCATTGGAGGCCGTG。Bcl-2上游和下游(5′-3′)分別為AAGATTGATGGGATCGTTGC和GCGGAACACTTGATTCTGGT。內參上游和下游(5′-3′)分別為CCGCATCTTCTTTTGCGTCG和TCCACCCATGGCAAATTCCA。PCR反應條件設置:95 ℃ 5 min,進入循環反應,95 ℃ 15 s、58 ℃ 30 s、72 ℃ 30 s,循環40次,在每個循環的第3個階段進行熒光信號收集。采用SDS v2.0.1軟件對熒光信號進行處理,采用2-ΔΔCt法計算各個目的基因的mRNA相對表達水平。
1.3觀察指標 (1)比較感染組和未感染組DFU患者Bcl-2、PDGFR-α表達水平。(2)根據國際DFU工作組以及美國感染病學會制定的DFU感染分級標準[10]對DFU感染患者進行分級,分為輕度感染、中度感染以及嚴重感染,其中將只有皮膚或皮下組織出現感染,紅斑在傷口周圍延伸<2 cm,為輕度感染;紅斑距創面邊緣≥2 cm,感染深至皮膚和皮下組織以下更深的組織,為中度感染;體溫>38 ℃或<36 ℃,心率為90次/分,呼吸速率>20次/分或二氧化碳分壓(PaCO2)<4.3 kPa(32 mmHg),白細胞計數>12 000/mm3或<4 000/mm3或>10%,滿足上述任意兩項及以上者即為嚴重感染。分別比較不同感染程度患者Bcl-2、PDGFR-α表達水平,并分析感染程度與表達水平的相關性。(3)隨訪半年,主要通過門診隨訪或電話隨訪方式進行,期間無失訪人員。將患者未愈合、截肢、死亡等納入預后不良組,將創面皮膚完全附帶或形成結痂,達到愈合標準的患者納入預后良好組,收集患者臨床資料,分析影響DFU感染患者預后的因素,并分析Bcl-2、PDGFR-α表達對于預后的預測價值。
2 結 果
2.1感染組和未感染組Bcl-2、PDGFR-α表達水平的比較 感染組患者Bcl-2、PDGFR-α表達水平均顯著低于未感染組(P<0.05),見表2。
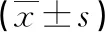
表2 感染組和未感染組Bcl-2、PDGFR-α表達水平比較
2.2不同感染程度Bcl-2、PDGFR-α表達水平比較 Bcl-2、PDGFR-α表達水平:嚴重感染者<中度感染者<輕度感染者,差異均有統計學意義(P<0.05),見表3。
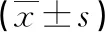
表3 不同感染程度Bcl-2、PDGFR-α表達水平比較
2.3Bcl-2、PDGFR-α表達水平與感染嚴重程度相關性 Bcl-2、PDGFR-α表達水平與感染嚴重程度均呈負相關(r=-0.280、-0.516,P<0.05)。
2.4影響DFU感染患者預后的單因素分析 預后不良組患者Bcl-2、PDGFR-α表達水平顯著低于預后良好組(P<0.05),其余指標單因素分析差異均無統計學意義(P>0.05)。見表4。

表4 影響DFU感染患者預后的多因素分析
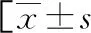
表4 影響DFU感染患者預后的單因素分析或n(%)]
2.5影響DFU感染患者預后的多因素分析 以DFU感染患者預后是否良好為因變量,以Bcl-2、PDGFR-α表達為自變量,進行Logistic回歸分析,結果顯示Bcl-2、PDGFR-α表達降低是導致DFU感染患者預后不良的危險因素(P<0.05)。見表4。
2.6Bcl-2、PDGFR-α表達對于DFU感染預后的預測價值 Bcl-2、PDGFR-α表達對于DFU感染患者預后均具有較好的預測價值,而兩者聯合預測曲線下面積(AUC)、特異度分別為0.765、71.83%,高于Bcl-2、PDGFR-α表達水平單項用于預測。見表5和圖1。
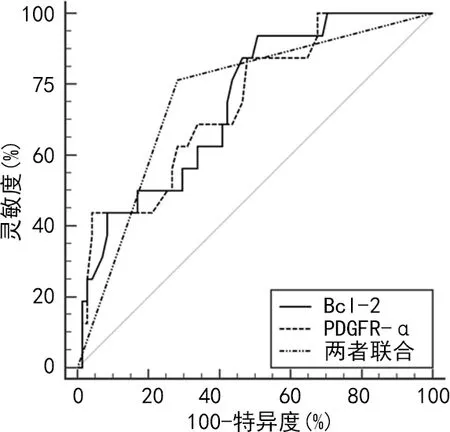
圖1 Bcl-2、PDGFR-α表達水平用于DFU感染患者預后預測的ROC曲線分析
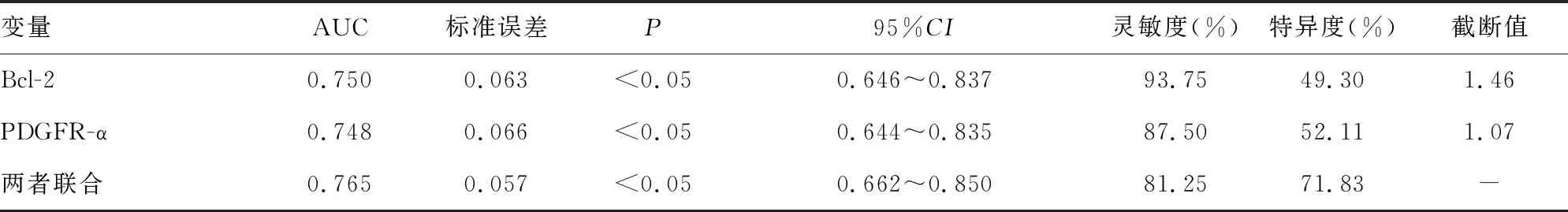
表5 Bcl-2、PDGFR-α表達對于DFU感染預后的預測價值
3 討 論
DFU患者因自身免疫力較低,多伴有神經病變或血管病變,創面愈合情況較差,極易發生感染,而感染會進一步加重患者病情,兩者相互作用,從而影響患者預后[11]。盡管近年來不斷有新型廣譜抗菌藥物出現,同時較多的綜述或指南均給予了包括局部清創、外科干預、抗菌藥物等DFU感染治療方案[12-13],但感染的發生率仍存在上升趨勢。既往研究表明約71%的DFU患者會發生感染[14]。在本研究中,DFU患者的感染發生率為69.6%,與既往上述研究結果相類似,進一步證實了DFU的易感染性。而DFU患者因多種并發癥的存在,增加了抗菌藥物的選擇難度,促使患者預后變差。故早發現、早診斷、早治療對于DFU患者的預后至關重要。
近年來研究發現,細胞因子及其受體在DFU的發生以及修復過程中具有重要作用[15]。PDGF是發現較早的結締組織生長因子,來源于平滑肌細胞、血管內皮細胞、成纖維細胞等多種細胞。該因子可通過促進多種細胞增殖,同時趨化合成細胞外機制,增強細胞黏附,形成肉芽組織,促使損傷后的組織修復,可見其在創面愈合過程中起到十分重要的作用[16]。國內劉洋等[17]通過對DFU患者潰瘍組織以及正常皮膚組織的PDGF表達情況進行比較,發現前者表達水平明顯降低。另國外CADAMURO等[18]研究也表明PDGFR-α可通過調節組織重塑促進成纖維細胞的生成。本研究以DFU感染和未感染患者為研究對象,結果顯示DFU感染患者創面PDGFR-α表達水平明顯降低,而且隨著感染程度的增加,PDGFR-α表達水平呈現遞減趨勢,提示PDGFR-α可能與DFU患者創面感染相關。分析其原因,PDGFR-α可介導炎癥細胞、成纖維細胞等,促進肌動蛋白重排,促使炎癥細胞向受損部位遷移和轉運,同時介導血管內皮細胞,達到促進新生血管形成的目標。而降低或抑制PDGFR-α的表達,則會導致細胞核內PDGFR-α基因表達的降低,進而降低生長因子活性,難以發揮其生產的生物學作用,致使創面遷延不愈,增加感染風險[19]。既往已有研究表明DFU患者感染程度與潰瘍程度呈正相關[20],可見創面經久不愈也是引發感染的重要因素。除此之外,高血糖被認為也是導致DFU患者感染的重要因素[21],高血糖的發生會導致患者機體抵抗力降低,從而增加感染風險。Bcl-2是一種癌基因,可通過抗氧化通路、破壞孔道蛋白的活性、調節線粒體滲透性轉變孔道復合物的成分等機制抑制細胞凋亡,近年來研究表明該基因與糖尿病患者胰島B細胞凋亡密切相關[22]。呂曉玉等[23]研究表明Bcl-2與DFU創面中Wnt/β-catenin通路被抑制密切相關;另鄭敏等[24]也發現Bcl-2相關細胞凋亡機制參與了DFU創面病理過程。本研究結果顯示,DFU感染患者創面Bcl-2表達水平明顯降低,而且隨著感染程度增加,呈現遞減趨勢,提示Bcl-2可能與DFU患者創面感染相關。筆者認為,一方面Bcl-2水平的降低,導致抑制凋亡能力也相應降低,進而促使創面凋亡細胞數量顯著增加,出現組織壞死或創面不愈,進而增加感染風險。另一方面,細胞凋亡增加,可能影響Bcl-2家族之間的動態平衡,進而促使胰島B細胞凋亡受影響,促使機體發生高血糖,降低抵抗力,從而導致感染概率增加。感染的發生勢必會對DFU患者的預后產生負面影響,導致患者發生截肢甚至死亡[25]。故探究Bcl-2、PDGFR-α表達與DFU感染患者預后的關系十分必要。本研究通過Logistic單因素以及多因素分析,結果顯示創面Bcl-2、PDGFR-α表達水平降低是導致DFU感染患者不良預后的獨立危險因素,并進一步通過ROC曲線分析得出檢測創面Bcl-2、PDGFR-α表達情況可為DFU感染患者預后提供一定的預測價值。DFU創面內細胞過度凋亡被認為是重要的病理特征,推測可能隨著PDGFR-α表達降低,組織修復能力減弱,同時Bcl-2抑制凋亡能力降低,細胞凋亡的增加,進一步導致創面組織損傷加重,感染程度增加,進而導致不良預后。
綜上所述,DFU患者感染的發生與Bcl-2、PDGFR-α表達密切相關,且Bcl-2、PDGFR-α表達降低是導致患者預后不良的危險因素,臨床可加強對Bcl-2、PDGFR-α表達的監控,進而為預后判斷提供參考。目前本研究的局限在于未通過體外試驗進一步論證Bcl-2、PDGFR-α表達影響DFU感染患者預后的具體機制,這也是后期有待開展的研究方向。

