滇皂角米多糖提取工藝優(yōu)化及其抗氧化活性
徐瑾鈺,彭小偉,闞歡,趙平,全偉,劉云*
(1.西南林業(yè)大學(xué)生命科學(xué)學(xué)院,云南 昆明 650224;2.西南林業(yè)大學(xué)材料與化學(xué)工程學(xué)院,云南 昆明 650224;3.云南省農(nóng)村科技服務(wù)中心,云南 昆明 650021)
滇皂角米又稱皂角精、雪蓮子,是滇皂莢(Gleditsia japonica)種子的外胚乳,其質(zhì)量占種子的30%左右[1]。滇皂角米中蛋白質(zhì)含量高、氨基酸種類齊全、礦物質(zhì)元素豐富[2],被認(rèn)為是唯一可食的皂莢種子外胚乳[3]。此外,皂角米中含有約80%的多糖膠,其主要由半乳糖、甘露糖、葡萄糖、阿拉伯糖等單糖組成[4]。植物多糖應(yīng)用廣泛,不僅可作為增稠劑、黏合劑、穩(wěn)定劑等應(yīng)用于造紙、印染等產(chǎn)業(yè),還具有抗氧化、降血糖、降血脂、抗腫瘤等功能,可應(yīng)用于食品醫(yī)藥制造領(lǐng)域[5]。
在植物多糖的研究與應(yīng)用中,提取方法的選擇是較重要的環(huán)節(jié)之一。提取方法的不同導(dǎo)致植物多糖的得率、結(jié)構(gòu)與活性存在一定的差異[6]。熱水浸提法是制備植物多糖最經(jīng)典的方法,但因得率低、耗時長逐漸被其它方法所替代。與熱水浸提相比,堿液提取法具有得率高、耗時短、節(jié)省原材料等優(yōu)點。此外,氫氧化鈉溶液能降低多糖膠的黏度、增大其溶解度,提高多糖膠的得率。
抗氧化能力是評價植物多糖生物活性的重要指標(biāo),體外抗氧化能力可通過對自由基清除效果來評價。自由基具有較高的氧化活性,在代謝過程中攜帶不對稱電子,容易引起各種疾病。研究表明,體內(nèi)大量的自由基會氧化、破壞正常細(xì)胞,引發(fā)身體疾病,如炎癥、早衰、癌癥、輻射損傷等[7]。
目前對于滇皂角米多糖提取工藝及活性研究較少,限制了其在食品醫(yī)藥、化工中的開發(fā)與利用。本試驗以滇皂角米為研究對象,探究滇皂角米多糖提取工藝與抗氧化活性,為滇皂角米的開發(fā)利用提供理論基礎(chǔ)。
1 材料與方法
1.1 材料與試劑
滇皂角米:片狀,質(zhì)地堅硬,色澤微黃,采自云南省梁河縣,經(jīng)粉碎后過60 目篩,備用。
VC、苯酚、硫酸、三氯甲烷、正丁醇、無水乙醇、碳酸氫鈉、乙二胺四乙酸二鈉:廣東光華科技股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-聯(lián)氨-雙-(3-乙基苯并噻唑啉-6-磺酸)二胺鹽[2,2'-azino-bis-(3-ethylbenzthiazoline-6-sulphonic acid),ABTS]:北京博奧拓達(dá)科技有限公司;葡萄糖、過硫酸鉀:天津市風(fēng)船化學(xué)試劑科技有限公司;以上試劑均為分析純。
1.2 儀器與設(shè)備
真空冷凍干燥機(jī)(FD5-series):金西盟(北京)儀器有限公司;紫外可見分光光度計(UV-2600):島津儀器(蘇州)有限公司;離心機(jī)(TG16-WS):湖南邁克爾實驗儀器有限公司;漩渦混合器(XH-C):常州越新儀器制造有限公司;增力電動攪拌器(JJ-1)、電熱恒溫水浴鍋(XMTD-7000):北京市永光明醫(yī)療儀器有限公司。
1.3 試驗方法
1.3.1 滇皂角米多糖提取
準(zhǔn)確稱取100 mg 滇皂角米粉末,在一定溫度、體積、濃度的NaOH 溶液中提取一定時間,6 000 r/min 離心10 min,收集上清液,用其4 倍體積的95%乙醇沉淀,真空冷凍干燥,得滇皂角米粗多糖。
1.3.2 滇皂角米粗多糖脫蛋白、除雜
采用Sevag 法除去粗多糖中的蛋白質(zhì)[8],透析袋法除去鹽類及小分子雜質(zhì)[9],經(jīng)真空冷凍干燥得滇皂角米多糖。
1.3.3 葡萄糖標(biāo)準(zhǔn)曲線的繪制
葡萄糖標(biāo)準(zhǔn)曲線的繪制參照錢怡霖等[10]的方法并稍作修改。
1.3.4 滇皂角米多糖提取率的計算
采用苯酚-硫酸法測定滇皂角米多糖含量,滇皂角米多糖提取率(Y,%)按如下公式計算。
式中:m1為樣品中滇皂角米多糖質(zhì)量,g;m0為樣品質(zhì)量,g;N 為稀釋倍數(shù)。
1.3.5 單因素試驗設(shè)計
按照1.3.1 進(jìn)行試驗,選取液料比[100∶1、150∶1、200∶1、250∶1、300∶1(mL/g)]、提取時間(70、80、90、100、110 min)、NaOH 溶液濃度(0.05、0.10、0.15、0.20、0.25 mol/L)、提取溫度(30、40、50、60、70 ℃)進(jìn)行單因素試驗,其中固定條件分別為液料比200∶1(mL/g)、提取時間90 min、NaOH 溶液濃度0.15 mol/L、提取溫度50 ℃。
1.3.6 Box-Behnken 試驗設(shè)計
基于單因素試驗的結(jié)果,以多糖提取率(Y)為響應(yīng)值,分別考察液料比(A)、NaOH 溶液濃度(B)、提取溫度(C)對滇皂角米多糖提取率的影響。試驗因素水平見表1。
1.3.7 滇皂角米多糖抗氧化活性測定
1.3.7.1 DPPH 自由基清除能力的測定
根據(jù)Huang 等[11]的方法并稍作修改,將滇皂角米多糖溶液濃度設(shè)置為2、4、6、8、10 mg/mL。分別取2 mL 不同濃度的多糖樣品溶液和2 mL DPPH 溶液(0.1 mmol/L)均勻混合,在避光條件下反應(yīng)30 min,于517 nm 處測定其吸光度A1,同時測定無水乙醇加滇皂角米多糖樣液的對照組吸光度A2,以及蒸餾水加DPPH 溶液的空白組吸光度A0。以VC作為陽性對照,DPPH 自由基清除率(X,%)計算公式如下。
1.3.7.2 ABTS+自由基清除能力的測定
根據(jù)Bora 等[12]的方法并稍作修改,將滇皂角米多糖溶液濃度設(shè)置為2、4、6、8、10 mg/mL。分別取1 mL不同濃度的滇皂角米多糖樣品溶液和3 mL ABTS 儲備液均勻混合,在避光條件下反應(yīng)6 min,于734 nm 處測定其吸光度A1,同時測定蒸餾水加滇皂角米多糖樣液的對照組吸光度A2,以及蒸餾水加ABTS 儲備液的空白組吸光度A0,以VC作為陽性對照,ABTS+自由基清除率(Y,%)計算公式如下。
1.4 數(shù)據(jù)處理
本研究每個處理均進(jìn)行3 次重復(fù),結(jié)果以平均值±標(biāo)準(zhǔn)差表示。采用SPSS Statistics 26 進(jìn)行單因素組間多重比較,Design-Expert 12 進(jìn)行試驗設(shè)計與方差分析,GraphPad Prism 8 作圖。
2 結(jié)果與分析
2.1 葡萄糖標(biāo)準(zhǔn)曲線的繪制
圖1 為葡萄糖溶液標(biāo)準(zhǔn)曲線,其方程為y=9.596 1x+0.000 02,R2=0.999 6。
2.2 單因素試驗
2.2.1 液料比對滇皂角米多糖提取率的影響液料比對滇皂角米多糖提取率的影響見圖2。
由圖2 可知,在100∶1~300∶1(mL/g)內(nèi),液料比對多糖提取率的影響顯著(P<0.05)。液料比在100∶1~200∶1(mL/g)時,多糖提取率隨提取液量的增加而升高,其原因是在這個范圍內(nèi),滇皂角米多糖與溶液的接觸面積隨著提取液量的增加而擴(kuò)大,有利于溶質(zhì)多糖的溶出;提取液量在200∶1~300∶1(mL/g)時,滇皂角米多糖提取率隨提取液量的增加反而降低,其原因可能是提取液量過大導(dǎo)致溶液中分子間相互作用力降低以及溶出其它非糖雜質(zhì),從而阻礙了多糖的溶出,滇皂角米多糖提取率降低。這與陳淑芳等[13]、郭杰等[14]探究液料比對多糖提取率影響的結(jié)論一致。當(dāng)液料比為200∶1(mL/g)時,滇皂角米多糖提取率達(dá)到峰值,為(72.50±0.74)%,因此,選擇液料比150∶1、200∶1、250∶1(mL/g)進(jìn)行后續(xù)試驗。
2.2.2 提取時間對滇皂角米多糖提取率的影響
提取時間對滇皂角米多糖提取率的影響見圖3。
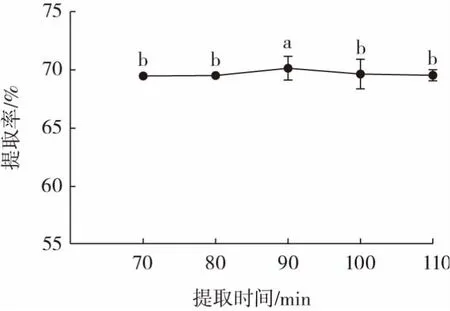
圖3 提取時間對滇皂角米多糖提取率的影響Fig.3 Effect of extraction time on the extraction yield of polysaccharide from the seed of Gleditsia japonica
由圖3 可知,當(dāng)提取時間達(dá)到90 min 時,滇皂角米多糖提取達(dá)到峰值,為(70.16±1.02)%。但隨著時間的進(jìn)一步的延長,滇皂角米多糖的提取率稍有降低,但差異不顯著(P>0.05),其原因可能是提取時間延長導(dǎo)致多糖堿降解和熱降解,促使提取率下降。這與唐森等[15]在研究提取時間對軟棗獼猴桃果膠提取率影響時得到的結(jié)論基本一致。提取時間在70~110 min 內(nèi)對多糖提取率影響較液料比、NaOH 溶液濃度、提取溫度小。綜合考慮成本、效率,響應(yīng)面優(yōu)化過程將提取時間固定為90 min。
2.2.3 NaOH 溶液濃度對滇皂角米多糖提取率的影響
NaOH 溶液濃度對滇皂角米多糖提取率的影響見圖4。
由圖4 可知,在NaOH 溶液濃度低于0.15 mol/L時,滇皂角米多糖提取率較低。當(dāng)NaOH 溶液濃度為0.15 mol/L 時,多糖提取率達(dá)到峰值(71.35±0.56)%。這與龐庭才等[16]探究堿法提取堿蓬多糖的試驗結(jié)果一致。隨著溶液的濃度繼續(xù)增大,多糖提取率顯著下降(P<0.05),其原因可能是NaOH 溶液濃度過高會破壞多糖結(jié)構(gòu)、溶出非多糖類雜質(zhì),不利于多糖的提取[17]。綜上,選擇NaOH 溶液濃度0.10、0.15、0.20 mol/L 進(jìn)行后續(xù)試驗。
2.2.4 提取溫度對滇皂角米多糖提取率的影響
提取溫度對滇皂角米多糖提取率的影響見圖5。

圖5 提取溫度對滇皂角米多糖提取率的影響Fig.5 Effect of extraction temperature on the extraction yield of polysaccharide from the seed of Gleditsia japonica
由圖5 可知,提取溫度從30 ℃升高到50 ℃,滇皂角米多糖提取率顯著提高(P<0.05)。其原因可能是在一定范圍內(nèi)的溫度升高會使提取液黏度降低,多糖傳質(zhì)速率變快,提取率提高[18]。當(dāng)?shù)嵩斫敲锥嗵翘崛囟冗_(dá)到50 ℃時,提取率最高,為(71.44±0.50)%。但溫度高于50 ℃,多糖提取率下降明顯,可能是因為高溫破壞多糖結(jié)構(gòu),以及高溫使水分蒸發(fā)、溶液黏度增大,不利于多糖的提取[19]。因此,選擇提取溫度40、50、60 ℃進(jìn)行后續(xù)試驗。
2.3 響應(yīng)面試驗
2.3.1 Box-Behnken 試驗結(jié)果
基于單因素試驗結(jié)果,進(jìn)行三因素三水平Box-Behnken 響應(yīng)面試驗設(shè)計,試驗結(jié)果見表2。
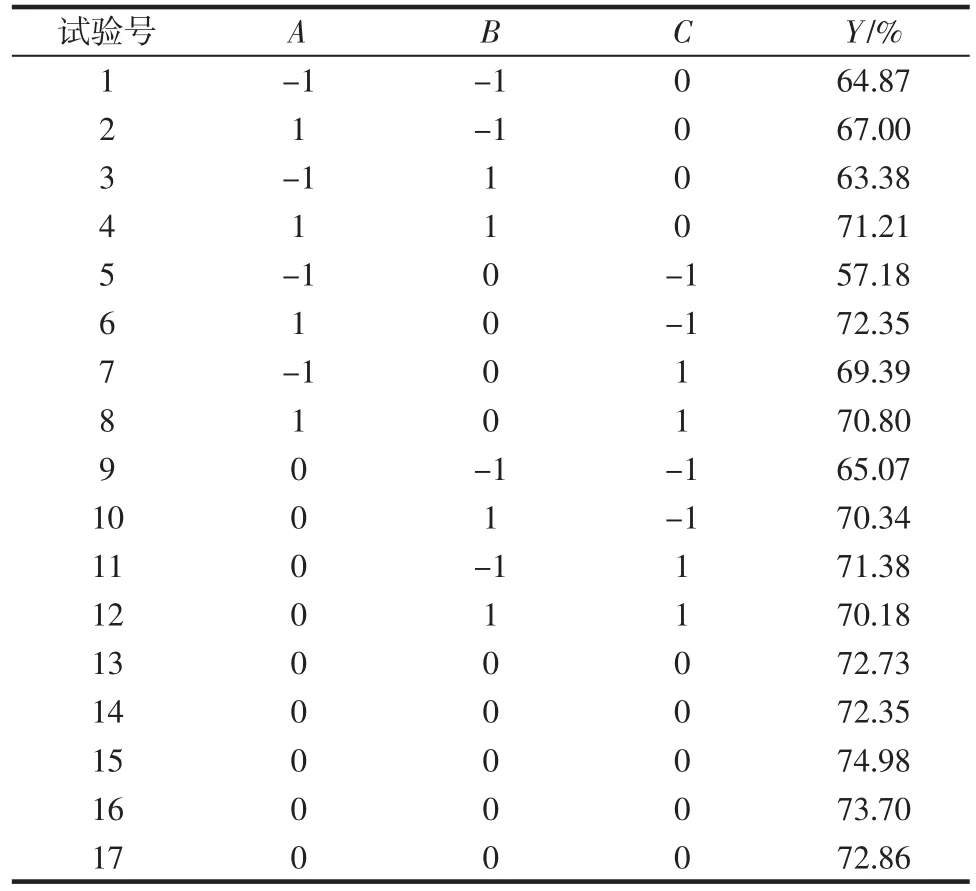
表2 Box-Behnken 試驗設(shè)計與結(jié)果Table 2 Design and results of Box-Behnken experiments
運用Design-Expert 12 軟件對表2 中試驗數(shù)據(jù)進(jìn)行回歸方程擬合,得到實際值擬合方程(只包含顯著項):Y=-763.320 6+2.195 6A+13.928 6C-0.022 9AC-16.170 3BC-0.004 7A2-6 125.598 5B2-0.065 4C2。
對模型進(jìn)行方差分析,結(jié)果見表3。
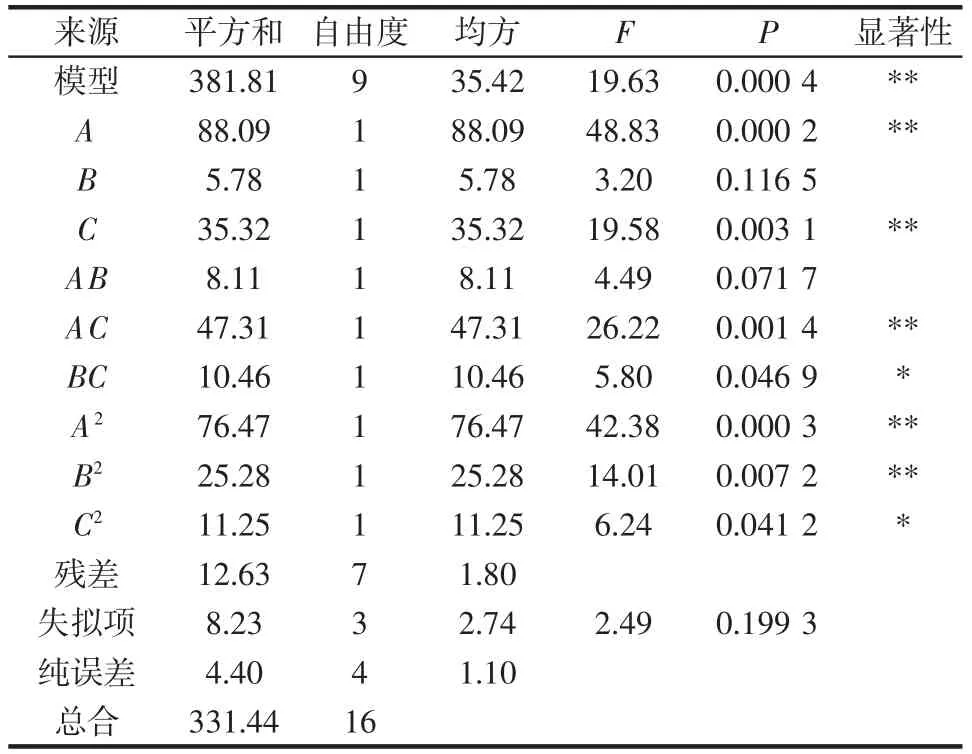
表3 Box-Behnken 試驗方差分析Table 3 Variance analysis of Box-Behnken experiments
由表3 可知,該模型P=0.000 4<0.01,失擬項P=0.199 3>0.05,說明該模型極顯著,并且模型選擇正確。模型的決定系數(shù)R2=0.961 9,調(diào)整決定系數(shù)為RAdj2=0.912 9,說明該模型擬合良好,91.29%的響應(yīng)值變化可以用該模型解釋。根據(jù)F 值的大小可以判斷出各因素對滇皂角米多糖提取率的影響大小為液料比(A)>提取溫度(C)>NaOH 溶液濃度(B)。
2.3.2 各因素交互作用
液料比、NaOH 溶液濃度及提取溫度兩兩之間交互作用的響應(yīng)面圖與等高線圖如圖6 所示。
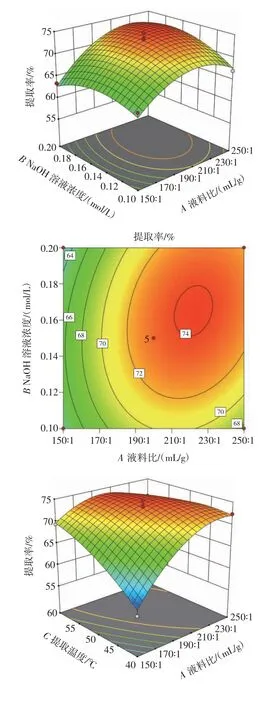
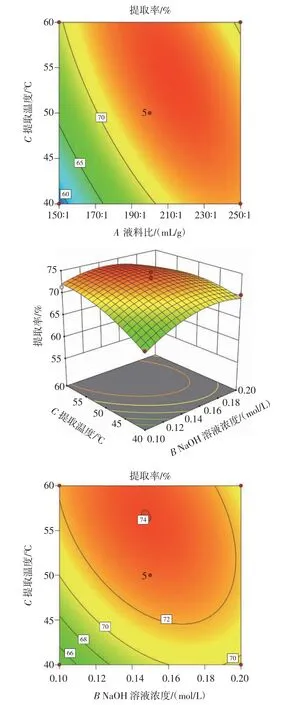
圖6 各因素交互作用的響應(yīng)面圖及等高線圖Fig.6 Response surface and contour plots of interaction of various factors
從圖6 中可以看出,液料比與提取溫度、NaOH 溶液濃度與提取溫度的交互作用響應(yīng)曲面陡峭,等高線圖為橢圓形,說明液料比與提取溫度、NaOH 溶液濃度與提取溫度的交互作用對滇皂角米多糖提取率的影響顯著(P<0.05);而液料比與NaOH 溶液濃度的交互作用響應(yīng)曲面較平緩,等高線圖接近圓形,說明液料比與NaOH 溶液濃度的交互作用對滇皂角米多糖提取率的影響不顯著(P>0.05)。
2.3.3 驗證試驗
通過響應(yīng)面模型得到滇皂角米多糖提取最佳工藝:液料比219.16∶1(mL/g),NaOH 溶液濃度為0.16 mol/L,提取溫度為51.21 ℃,預(yù)測多糖提取率為(74.19±1.34)%。為進(jìn)一步驗證響應(yīng)面分析結(jié)果的可靠性,同時也為了試驗操作的方便性,將工藝參數(shù)調(diào)整為液料比220∶1(mL/g)、NaOH 溶液濃度0.16 mol/L、提取溫度51 ℃,在此條件下,進(jìn)行3 次重復(fù)試驗,測得滇皂角米多糖提取率為(73.64±0.56)%,與預(yù)測值相差0.55%。
2.4 體外抗氧化試驗
滇皂角米多糖的DPPH 自由基、ABTS+自由基清除能力結(jié)果如圖7 所示。

圖7 滇皂角米多糖對DPPH、ABTS+自由基清除能力Fig.7 Clearance ability of DPPH and ABTS+free radical by polysaccharide from the seed of Gleditsia japonica
由圖7 可知,在多糖濃度為2~10 mg/mL 內(nèi),DPPH自由基清除率為25.31%~50.93%,清除率隨其濃度的增加而增加,存在明顯的量效關(guān)系,這與高潔等[20]研究皂莢多糖對DPPH 清除效果的結(jié)論一致;在相同濃度下,ABTS+自由基清除率為18.69%~70.87%。本試驗滇皂角米多糖對ABTS+自由基清除情況與柴美靈等[21]研究結(jié)論接近。滇皂角米多糖清除DPPH 自由基、ABTS+自由基的IC50值分別為10.87、6.67 mg/mL。
3 結(jié)論
本研究通過單因素試驗與Box-Behnken 響應(yīng)面試驗對滇皂角米多糖堿提工藝進(jìn)行優(yōu)化,得到滇皂角米多糖堿提最佳工藝參數(shù)為液料比220∶1(mL/g)、NaOH 溶液濃度0.16 mol/L、提取溫度51 ℃、提取時間90 min,在此條件下滇皂角米多糖的提取率為(73.64±0.56)%。滇皂角米多糖具有一定的體外抗氧化活性,清除DPPH、ABTS+自由基IC50值分別為10.87、6.67 mg/mL。本研究為滇皂角米多糖的開發(fā)利用提供了一定的理論基礎(chǔ)。

