精準備考突破物質結構模塊中的不同類型的共價鍵
金敖然
(廣西南寧市第三中學)
共價鍵是物質結構模塊的重要知識,也是高考考查的重要內容。分值在結構化學考點中占比較高,考查的內容包括共價鍵的極性、σ鍵與π鍵、配位鍵及相關知識、大π鍵、物質結構式中涉及的d-p 反饋π鍵等。考查的角度越來越新穎,考查內容也不斷深入。那么高三學子在面對有關化學鍵復雜多變的題型時如何才能做到應對自如呢?本文中,筆者總結歸納了共價鍵的相關知識,做到精準備考突破物質結構模塊中的共價鍵問題。
一、近三年部分真題卷中有關共價鍵考點的統計
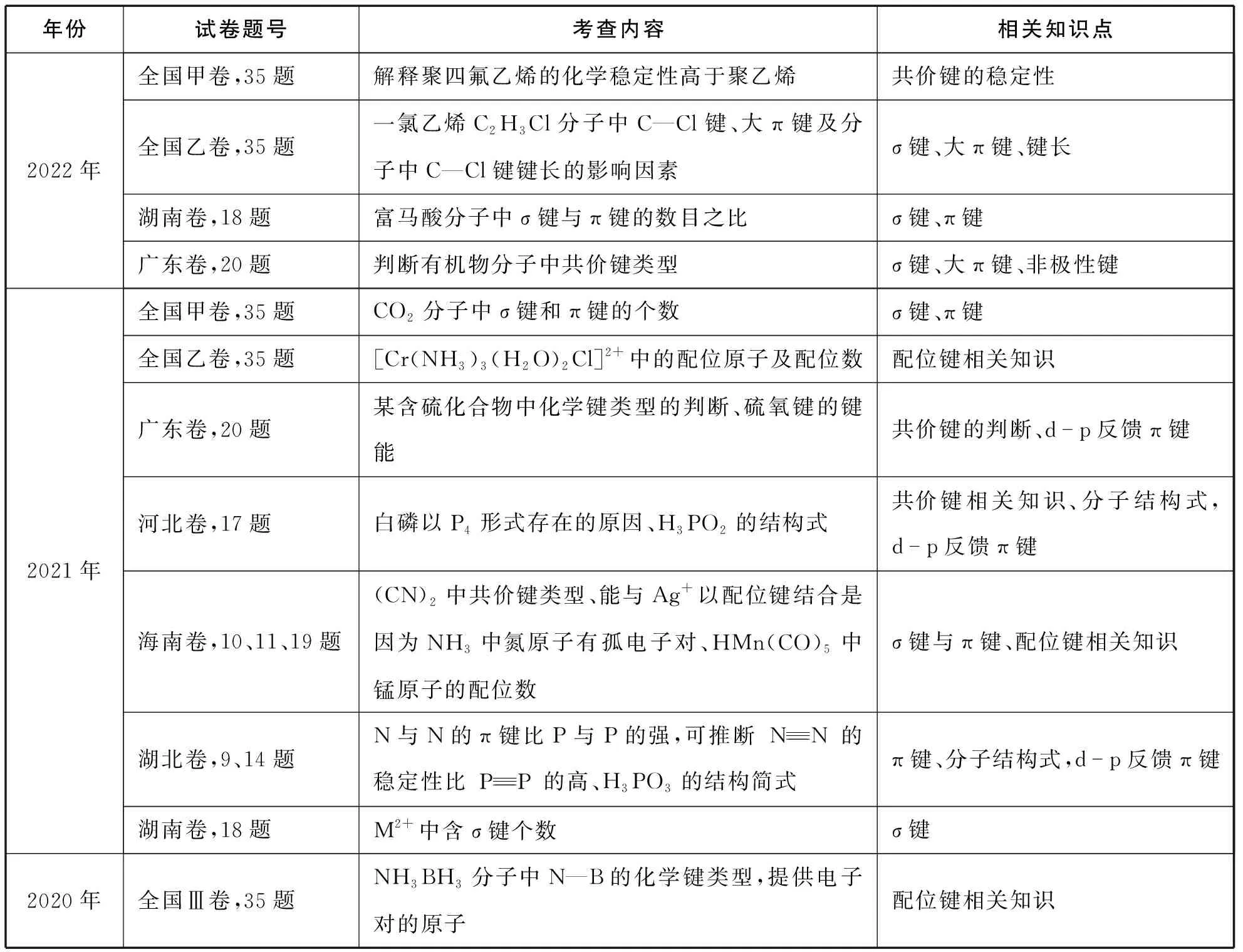
表1
二、極性共價鍵與非極性共價鍵
根據經典的共價鍵理論,原子與原子是通過兩個自旋方向相反的電子組成“電子對”吸引在一起的,我們把這種“電子對”稱作共用電子對、共價鍵。成鍵原子間的“電子對”或者說電子云,由于受成鍵原子的吸引力的大小不同,會發生偏移。當成鍵原子相同時,他們對“電子對”的吸引力相同,那么電子對就不發生偏移,成鍵原子不顯電性,此時該種作用力被稱作非極性共價鍵簡稱非極性鍵。相反,當成鍵原子不同時,他們對電子對的吸引力也不同,這就導致共用電子對發生偏移,成鍵原子帶相反電荷,這就是極性共價鍵簡稱極性鍵。簡單講,同種原子間形成非極性鍵,不同原子間形成極性鍵。
由于分子內電荷分布不均勻,正負電荷中心不重合,導致分子“兩端”分別出現正電性δ+和負電性δ-,這樣的分子稱作極性分子,相反就是非極性分子。那么如何判斷分子的極性呢?方法有三種。
(一)化合價法
對于ABn型分子,中心原子A的化合價的絕對值或成鍵數等于其價電子數,則該分子為非極性分子,如:BF3、CH4、PCl5等。相反為極性分子如:CO、SO2、PCl3等。
(二)力的合成法
對于已知空間構型的分子,利用力的向量加減,若合力為0,則為非極性分子,反之為極性分子。一般分子采用直線形、平面正三角形、正四面體形、三角雙錐形、正八面體形等分子構型,就是非極性分子。如:CO2、SO3、SF6等。
(三)絕大多數單質都是非極性分子
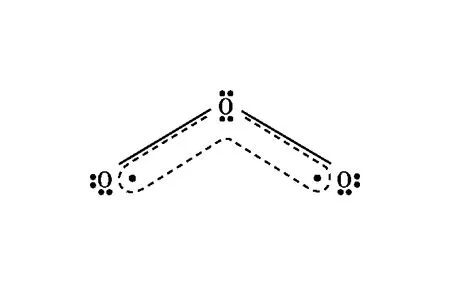
圖1
三、σ鍵與π鍵
分子的量子化模型認為,共價鍵是由不同原子的電子云重疊形成的。如果電子云或原子軌道采用“頭碰頭”重疊,那么這種共價鍵就叫σ鍵,一般σ鍵成鍵電子云密度較高,相對比較穩定,對稱方式為軸對稱,因此成鍵原子可以繞軸旋轉。若電子云采用“肩并肩”重疊,那么這種化學鍵叫作π鍵,π鍵電子云空間重疊相對較少,穩定性不如σ鍵,容易發生斷裂,常見于有機反應中的加成、加聚反應。π鍵的空間對稱屬于鏡面對稱,故雙鍵、三鍵不能旋轉。
關于σ鍵與π鍵的判斷比較簡單。共價單鍵都是σ鍵,共價雙鍵中分別為一個σ鍵和一個π鍵,三鍵中包括一個σ鍵和兩個π鍵。
【例1】(2022年湖南卷,18題節選)(2)富馬酸亞鐵(FeC4H2O4)是一種補鐵劑。富馬酸分子的結構模型如圖2所示:
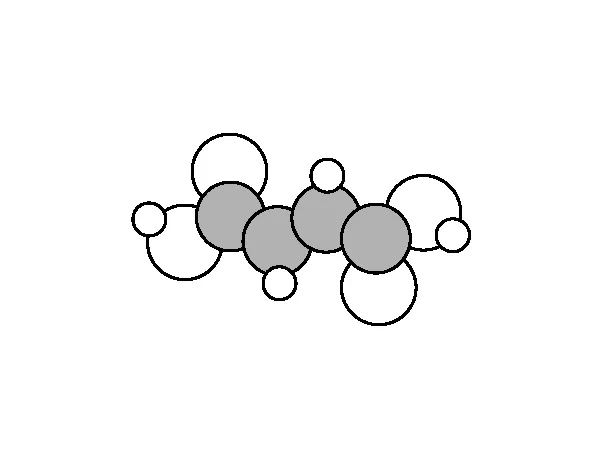
圖2
①富馬酸分子中σ鍵與π鍵的數目比為________。
【答案】11∶3

四、配位鍵

由中心離子(或原子)和幾個配體分子(或離子)以配位鍵相結合而形成的復雜分子或離子,通常稱為配位單元。凡是含有配位單元的化合物都稱作配位化合物,簡稱配合物,也叫絡合物。配合物結構中中心原子或離子提供空軌道,配原子提供孤電子對。
【例2】(2020年全國Ⅲ卷,35題節選)(2)NH3BH3分子中,N—B化學鍵稱為________鍵,其電子對由________提供。
【答案】配位;N
【解析】NH3BH3分子中,B最外層3個電子,分別與3個H成鍵,空出一個空軌道,而分子中N與3個H原子成鍵后,多出一對孤對電子,故 N—B 化學鍵為配位鍵,其電子對由N提供。
五、大π鍵
大π鍵的判斷相對比較復雜。一共三條規則:
1.分子結構為平面形結構,即中心原子采用sp或sp2雜化。
2.參與形成大π鍵的原子必須存在垂直平面、相互平行的p軌道。
3.中心原子未參與雜化的電子與周圍的配原子的一個p軌道上的電子共同形成大π鍵,大π鍵的電子數小于軌道數的兩倍。
【例3】請表示出下列粒子中的大π鍵。

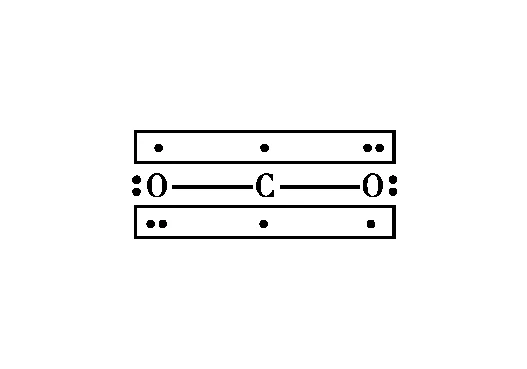
圖3 CO2分子中2個的電子排布情況
【例4】(2022年全國乙卷,35題節選)(2)②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl鍵長的順序是
____________________,理由:(ⅰ)C的雜化軌道中s成分越多,形成的C—Cl鍵越強:(ⅱ)____________________,。
【答案】一氯乙烷>一氯乙烯>一氯乙炔 Cl參與形成的大π鍵越多,形成的C—Cl鍵的鍵長越短
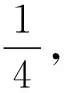
在學習H2SO4分子結構的時候,我們了解到中心原子S采用sp3雜化,形成4個σ鍵連接4個O原子,4個S—O鍵完全相同,但是實際上4個S—O鍵有長短之分,如圖4所示。
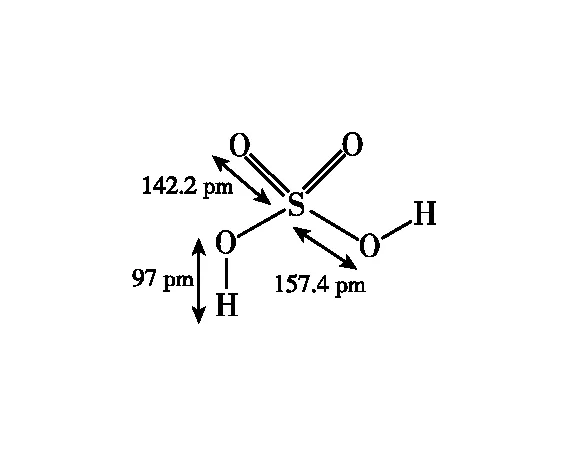
圖4
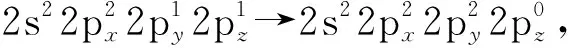
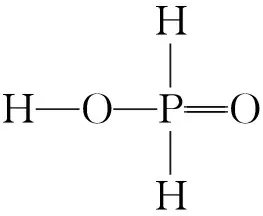
【例5】(2021年河北卷,17題節選)KH2PO4晶體具有優異的非線性光學性能。我國科學工作者制備的超大KH2PO4晶體已應用于大功率固體激光器,填補了國家戰略空白。回答下列問題:
(4)已知KH2PO2是次磷酸的正鹽,H3PO2的結構式為____________________________________。