建構“三步”解題模型 突破高考電化學題
劉 潔
(廣東省佛山市高明區第一中學)
各種層出不窮的電化學裝置給人類工作和生活帶來了便利,相關的電化學知識也成為了高考命題的熱點。高考試題常常關注新型化學電源,具有基于真實問題情境考查學科知識與能力、學科核心素養的趨勢,同時試題對學生接受、吸收、整合化學信息的能力以及分析解決問題的能力提出了全方位、更高層次和水平的認知要求。由于該題型存在情境新穎、陌生度大、問題真實等特點,學生普遍感覺較難突破,但這些高考題的考點實際上是課堂教學所研究的基礎問題:電極判斷、電極反應式和微粒移動,故本文通過建構解題模型“三步曲”,幫助學生快速準確地突破電化學選擇題。
一、分清兩池——原電池、電解池
高考試題會對陌生情境的裝置進行相關的文字介紹或必要的標注,首先應該確定題中所涉及的是哪種裝置,是只含原電池還是只含電解池,或是可充放電的二次電池,因為原電池裝置和電解池裝置所對應的工作原理是不同的。
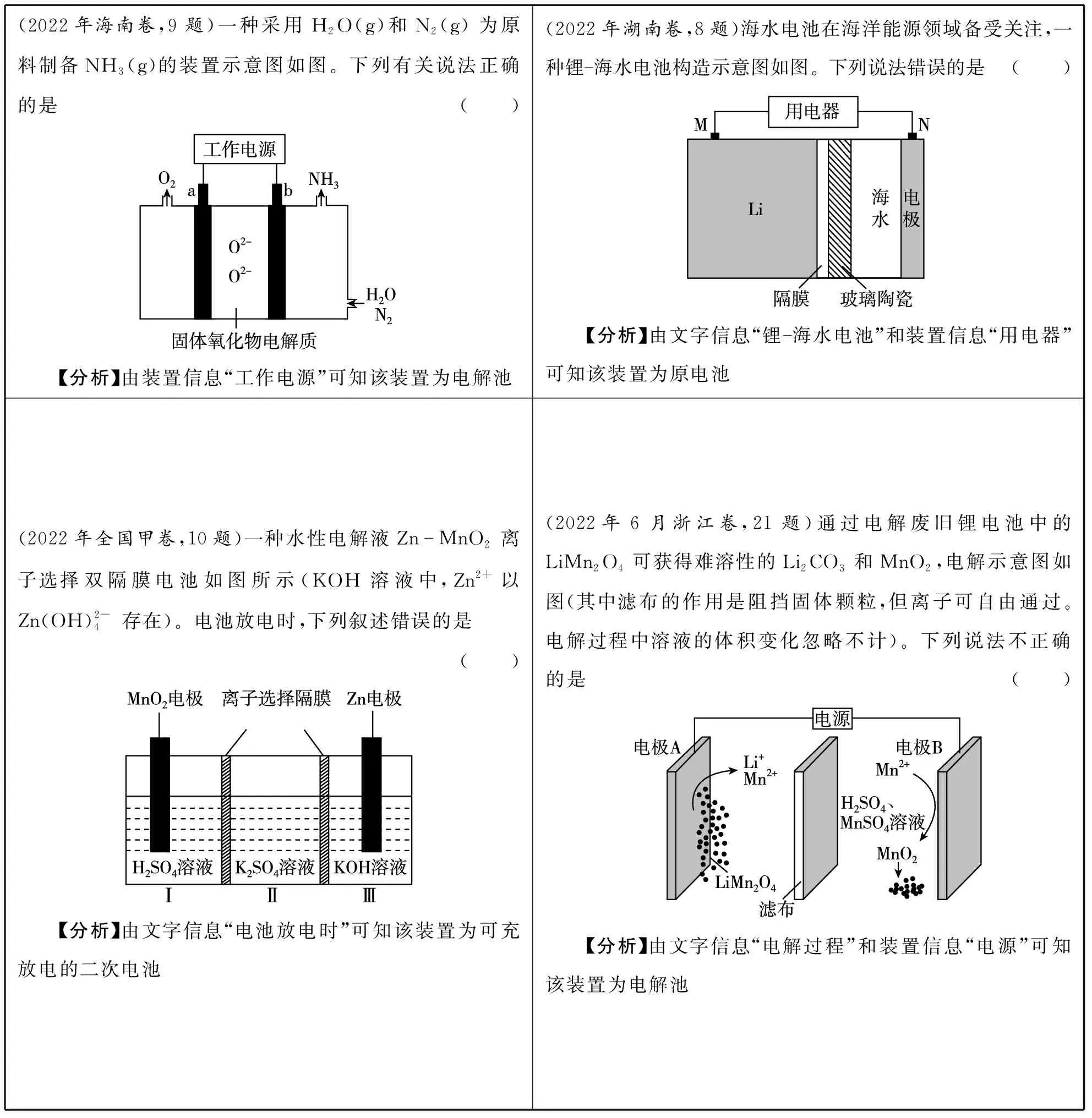
表1
如果是二次電池,要明確放電方向和充電方向。放電時,裝置遵循原電池工作原理——“負失正得、負負正正”(負極失去電子,正極得到電子,帶負電荷的陰離子向負極移動,帶正電荷的陽離子向正極移動);充電時,裝置遵循電解池工作原理——“陽失陰得、陰陽相吸”(陽極失去電子,陰極得到電子,陰離子向陽極移動,陽離子向陰極移動)。
二、判斷兩極——負或正、陰或陽
如何判斷兩極有很多種方法,不管何種方法,本質是相同的。原電池中失去電子的電極為負極、得到電子的電極為正極(負失正得),而電解池中失去電子的電極為陽極、得到電子的電極為陰極(陽失陰得),二次電池中充放電對應的電極反應正好相反。
結合上述內容,分清兩池后,根據題中的信息正確判斷兩極,但是要注意一定不能混淆兩極,原電池中的兩極名稱是正極、負極,而電解池中的兩極名稱是陽極、陰極。
在明確兩極的過程中,可以完成電極反應式的書寫和判斷:
第一步:找信息,定物質;認真審題,獲取題中的信息(文字信息、裝置信息),確定該電極上的反應物和生成物。
第二步:標價態,寫得失;標出價態變化元素的化合價,化合價升高即失去電子,降低即得到電子,并確定得失電子的數目即電子的系數。
第三步:看環境,配守恒;結合電極反應所處的環境,根據得失電子守恒、電荷守恒和原子守恒將電極反應式配平。
【例1】(2022年山東卷,13題節選)設計如圖1裝置回收金屬鈷。保持細菌所在環境pH穩定,借助其降解乙酸鹽生成CO2,將廢舊鋰離子電池的正極材料LiCoO2(s)轉化為Co2+,工作時保持厭氧環境,并定時將乙室溶液轉移至甲室。已知電極材料均為石墨材質,右側裝置為原電池。下列說法正確的是
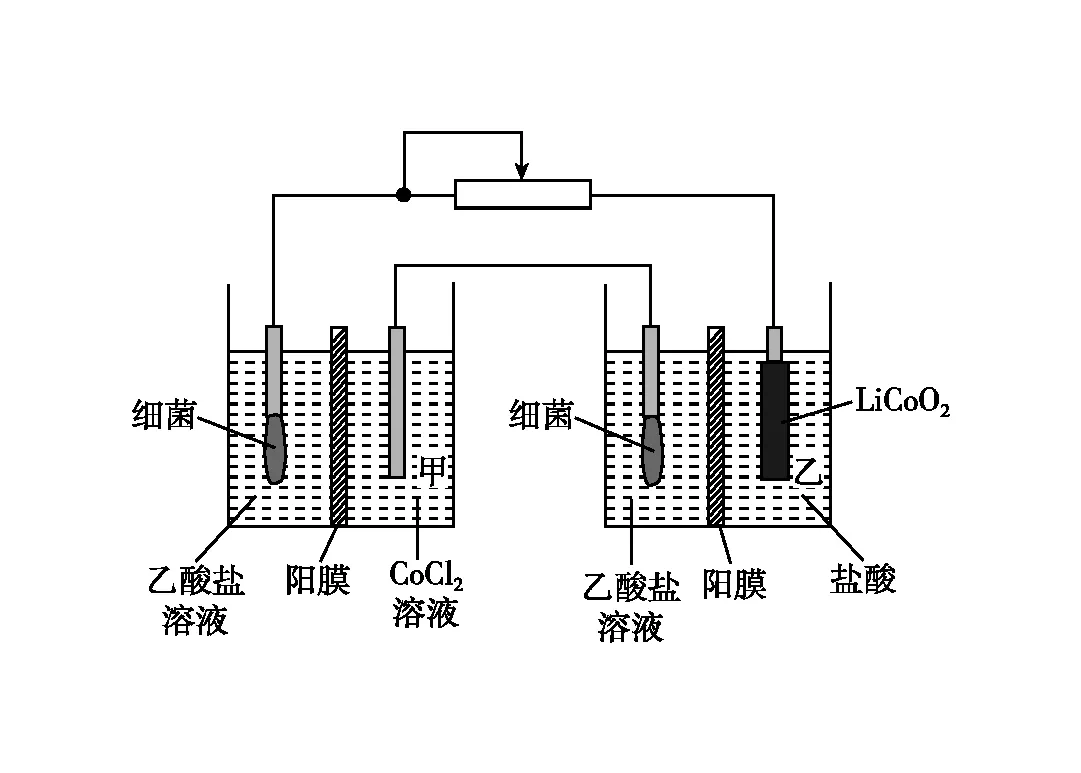
圖1
( )


三、確定兩路——內電路、外電路
在電化學裝置中,微粒移動的考查有兩大方面,內電路離子的移動方向和外電路電子的移動方向。在前兩步的基礎上,確定選項所涉及的是外電路中的電子還是內電路中的離子,然后熟記下表中口訣進行判斷。若遇到相關計算,要謹遵“守恒思想”,外電路兩極上得失電子總數相等,內電路移動離子的電荷總數與外電路電子的電荷總數相等。
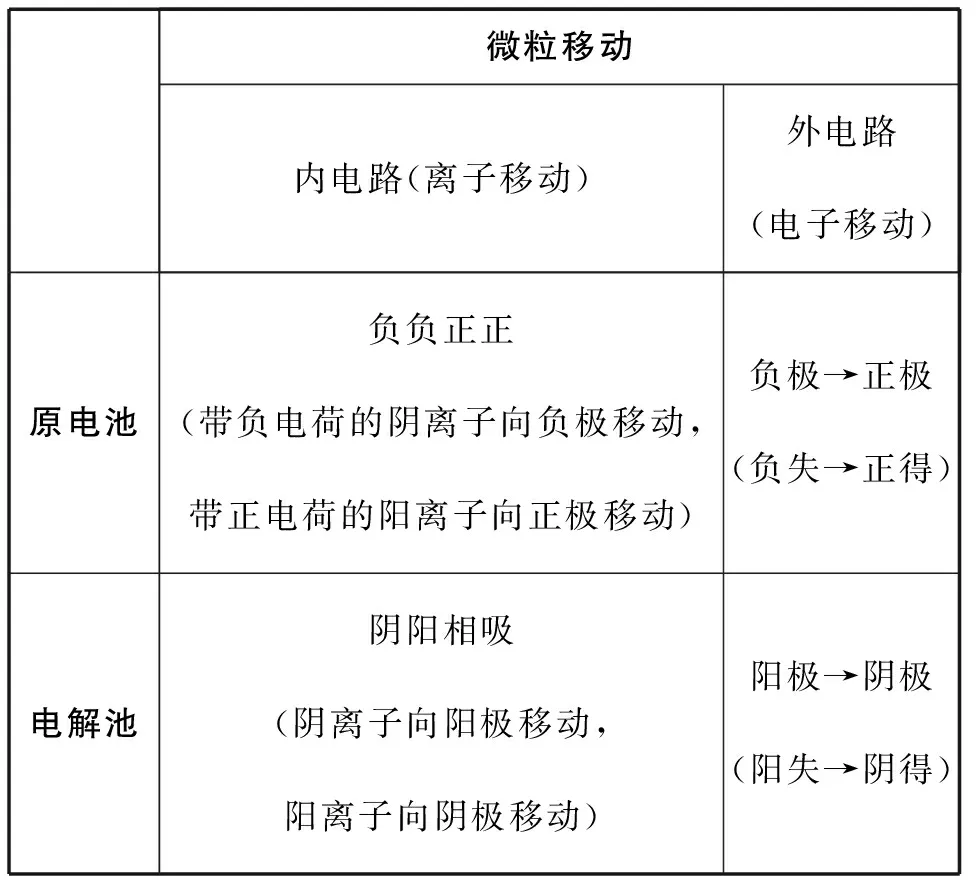
表3
【例2】(2022年山東卷,13題節選)題干和圖像同【例1】。
A.裝置工作時,甲室溶液pH逐漸增大
B.裝置工作一段時間后,乙室應補充鹽酸
D.若甲室Co2+減少200 mg,乙室Co2+增加300 mg,則此時已進行過溶液轉移
真題演練

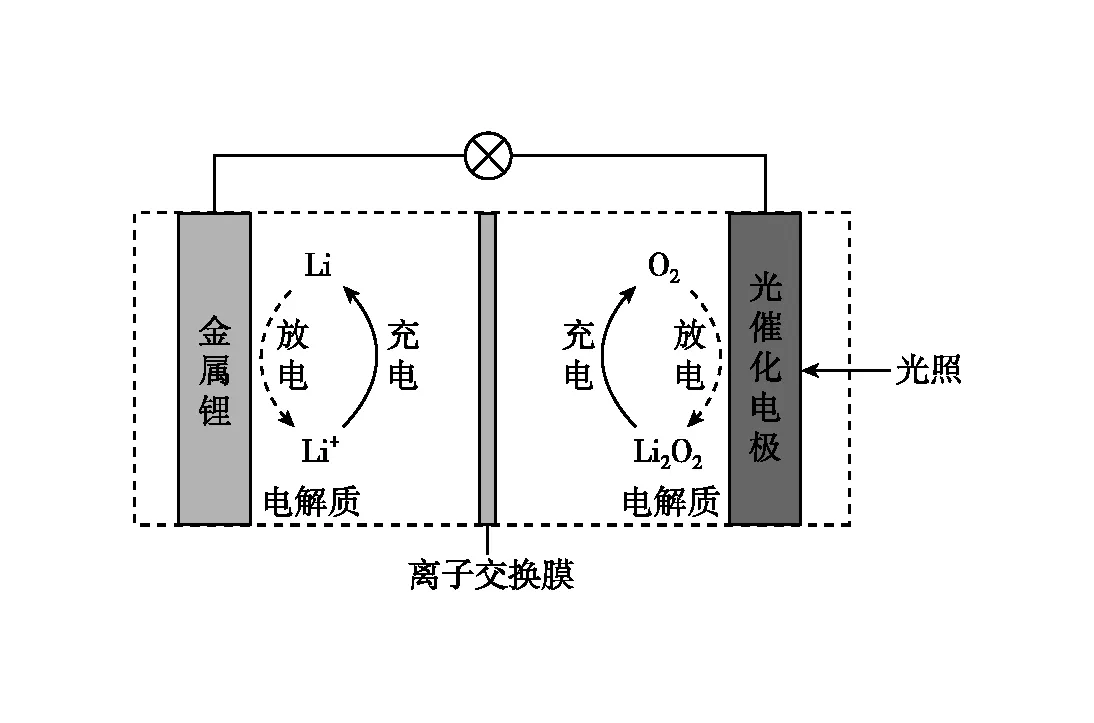
圖2
( )

B.充電效率與光照產生的電子和空穴量有關
C.放電時,Li+從正極穿過離子交換膜向負極遷移

【答案】C
【解析】本題以真實情境“光照充電Li-O2電池”為考查載體,考查電極判斷、電極反應式、微粒移動方向等核心必備知識,甄別學生對題目中有效信息的獲取及分析能力。
第一步:分清兩池——原電池、電解池
教育以“立德樹人”為出發點和落腳點,這要求學校和教育工作者一定要把“德”放在首位。在高校校園中,圖書館匯聚著來自不同學院、不同專業的學生。因此,圖書館運用閱讀推廣進行對學生品德教育顯得意義重大。而通過對新的推廣閱讀的形式的不斷探索與創新,可以更為高效的促進對學生的品德教育。

第二步:判斷兩極——負或正、陰或陽

第三步:確定兩路——內電路、外電路
放電時內電路微粒移動為“負負正正”,故帶正電荷的陽離子Li+應該從負極穿過離子交換膜向正極移動,C錯誤。

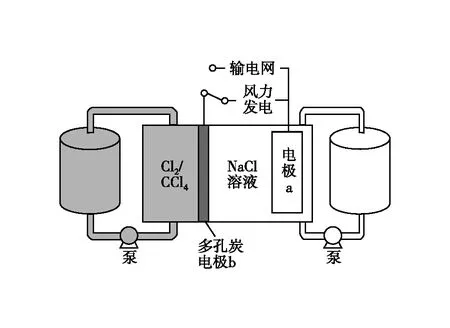
圖3
下列說法正確的是
( )
A.充電時電極b是陰極
B.放電時NaCl溶液的pH減小
C.放電時NaCl溶液的濃度增大
D.每生成1 mol Cl2,電極a質量理論上增加23 g
【答案】C
【解析】本題以“新型氯流電池”為情境素材,考查電化學裝置工作原理的分析與綜合應用能力,包括電極的判斷、電極反應式、電解質溶液濃度及pH變化的判斷等。
第一步:分清兩池——原電池、電解池
由文字信息可知該裝置是二次電池,放電時是原電池,充電時是電解池;
第二步:判斷兩極——負或正、陰或陽

第三步:確定兩路——內電路、外電路
二次電池充放電的電極反應相反,由第二步中放電時電極a、b的電極反應可知,電極a生成Na+,電極b生成Cl-,放電時溶液中NaCl濃度增大,C正確;工作時外電路遷移的電子總數相等,Cl2→2e-而Na+→e-,根據得失電子守恒,每生成1 mol Cl2,電極a的質量理論上增加23 g/mol×2 mol=46 g,D錯誤。


