高溫儲藏條件對花生油脂和蛋白質品質劣變的影響
李尤好,劉 瀟,沈 飛,劉 強,裴 斐,馬高興,胡秋輝
(南京財經大學食品科學與工程學院,江蘇省現代糧食流通與安全協同創新中心,江蘇高校糧油質量安全控制及深加工重點實驗室,江蘇 南京 210023)
花生作為全球最重要的油料作物之一,在我國的種植業中占有重要地位,據統計,近年來我國花生播種面積達470萬 hm2以上,總產量近1 800萬 t,保障了我國植物食用油的安全供給[1]。與高產量隨之而來的花生儲藏問題一直是人們研究的重點[2]。花生在儲藏過程中極易受到環境溫濕度、光線、空氣組分等外部因素以及自身水分含量、水分活度等內部因素的影響[3-5]而導致氧化、出油、變味等品質劣變,造成花生品質發生變化的主要因素就是花生中含有的油脂和蛋白質[6]。已有的研究表明,較低的環境溫度有助于花生品質的保持[7-8]。
花生中油脂平均相對含量高達50%,而其中又有80%為不飽和脂肪酸,不飽和脂肪酸極易被花生仁中的氧化酶類催化發生氧化反應[9-10]。過氧化值能夠反映初級氧化產物的含量,酸價則能夠反映游離脂肪酸的含量,在油脂的氧化過程中,酸價始終上升,而過氧化值在達到一定峰值后會出現下降的情況[11]。光照、高溫、水分和氧化酶類加速了油脂的代謝過程,生成甘油三酯和游離脂肪酸,游離脂肪酸進一步被氧化成氫過氧化物,并裂解成小分子的醛、酮、酸類物質,從而造成油脂氧化程度上升、風味劣變和品質下降[12]。
花生蛋白質平均相對含量可達30%,花生在儲藏過程中,其蛋白質的氧化除了會導致蛋白質功能特性下降、風味改變,更會引起花生營養損失[13-14]。而花生品質劣變的現象在炎熱的夏天尤為明顯[15],研究表明,溫度高于20 ℃時,溫度越高,花生內源酶活性越高,從而加劇花生仁中油脂酸敗、蛋白質氧化[16]。此外,蛋白質在與脂質氧化產物接觸后,會以化學鍵的形式與其結合形成脂蛋白復合體,從而導致蛋白質氧化程度加劇[17];同時,也有部分研究表明,蛋白質可以通過金屬螯合和自由基清除作用抑制脂質的氧化[18],因此,脂質的氧化同時也是影響蛋白質氧化的因素之一。
本實驗通過對花生仁在15、25、35 ℃條件下進行模擬儲藏,測定30 周儲藏時間內氧化酶、抗氧化酶活力以及油脂和蛋白質相關氧化指標,探究儲藏溫度對花生仁儲藏過程中油脂和蛋白質氧化程度的影響。
1 材料與方法
1.1 材料與試劑
‘四粒紅’花生,原產地山東德州,采購自南大和園農貿市場。
正己烷、異丙醇、可溶性淀粉、冰乙酸、鹽酸、Tris-Gly緩沖液、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,P V P) 上海阿拉丁生化科技股份有限公司;乙醚、三氯甲烷 南京化學試劑股份有限公司;百里香酚酞、二硫蘇糖醇(dithiothreitol,DTT)溶液(1 mol/L)、碘化鉀、5,5’-二硫代雙(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)上海麥克林化學試劑有限公司;氫氧化鈉、硫代硫酸鈉、無水硫酸鈉 西隴科學股份有限公司;三氯乙酸、95%乙醇、尿素 廣東光華科技股份有限公司;以上試劑均為分析純。
1.2 儀器與設備
DF-101S集熱式恒溫磁力攪拌器 上海力辰邦西儀器科技有限公司;HWS型恒溫恒濕箱 寧波東南儀器有限公司;LABCONCO冷凍干燥機 北京照生行儀器設備有限公司;GL-21M離心機 上海市離心機械研究所有限公司;Hei-VAP ML Adv/Pre(EU)旋轉蒸發儀 海道爾夫儀器設備(上海)有限公司。
1.3 方法
1.3.1 花生的處理
分別稱取帶殼花生3 份,每份(7.5±0.1)kg,裝入45 cm×32 cm×21.5 cm收納盒中,分別置于25、35、45 ℃和50%相對濕度的恒溫恒濕箱,每隔3 周取樣進行各指標測定。
1.3.2 花生酶類活力的測定
脂肪酶活力參照GB/T 5523—2008《糧油檢驗 糧食、油料的脂肪酶活動度的測定》進行。
脂肪氧化酶活力參照Zhang Shen等[19]的方法測定。取0.1 g花生粉末,加入20 mL含質量分數1% PVP的磷酸鹽緩沖液(50 mmol/L、pH 7.0),于4 ℃下10 000 r/min離心15 min,取上清液。取2.875 mL 0.1 mol/L乙酸-乙酸鈉緩沖溶液(pH 5.5),加入25 μL 10 mmol/L亞油酸鈉溶液,35 ℃保溫10 min后,加入0.1 mL上述上清液,混勻。以蒸餾水為空白對照,測定234 nm波長處吸光度,每30 s記錄一次,以每分鐘吸光度變化0.01為1 個脂肪氧化酶活力單位U,結果以U/g表示。
過氧化物酶的活性使用過氧化物酶測定試劑盒進行檢測。
1.3.3 花生油脂、蛋白質制備
花生油脂制備參照GB 5009.229—2016《食品安全國家標準 食品中酸價的測定》方法進行。
將花生脫脂后樣品風干制成脫脂花生粉,參照楊曦等[17]的方法并有所改動,脫脂花生粉按料液比1∶10加入水,磁力攪拌2 h,用2 mol/L NaOH溶液調節pH值至8.5,經室溫提取1 h后,于4 ℃、6 000 r/min離心兩次,每次15 min,所得上清液用2 mol/L HCl溶液調節pH值至4.5后經上述條件離心,所得沉淀調至中性,凍干即得到花生蛋白。
1.3.4 花生油脂氧化指標測定
酸價參照GB 5009.229—2016《食品安全國家標準 食品中酸價的測定》進行測定;過氧化值參照GB 5009.227—2016《食品安全國家標準 食品中過氧化值的測定》進行測定;丙二醛(malondialdehyde,MDA)含量使用MDA測定試劑盒測定。
1.3.5 花生蛋白質氧化指標測定
羰基含量使用蛋白質羰基含量測定試劑盒測定。
游離巰基和二硫鍵含量參照Beveridge[20]、Zhao Xiaoyan[21]和彭武[22]等的方法并有所改動,取花生蛋白0.1 g加入30 mL去離子水,磁力攪拌2 h后定容至50 mL。
取1 mL蛋白溶液溶解于5 mL Tris-Gly-尿素(尿素8 mol/L)緩沖液中,渦旋振蕩后加入50 μL DTNB溶液(4 mg/mL)中,在25 ℃條件下反應1 h,測定412 nm波長處吸光度。按式(1)計算游離巰基含量。
式中:CSH為游離巰基含量/(μmol/g);A412nm為412 nm波長處吸光度;ρ為樣品質量濃度/(mg/mL);D為稀釋因子。
取1 mL上述蛋白溶液于3 mL含有10 mmol/L DTT的8 mol/L尿素溶液中,渦旋振蕩后于25 ℃條件下反應1 h,添加6 mL體積分數為12%的三氯乙酸溶液后于25 ℃條件下再反應1 h,將樣品于4 ℃、10 000 r/min條件下離心10 min。將沉淀加入到9 mL 8 mol/L尿素溶液和90 μL DTNB(4 mg/mL)溶液中混勻,測定412 nm波長處吸光度。按式(2)、(3)分別計算總巰基含量和二硫鍵含量。
式中:ρ為樣品質量濃度/(mg/mL);CSS為二硫鍵含量/(μmol/g);CSHT為總巰基含量/(μmol/g);CSH為游離巰基含量/(μmol/g)。
1.4 數據處理與分析
采用SPSS Statistics 25軟件處理數據,結果以平均值±標準差表示,采用Origin 2018軟件作圖。
2 結果與分析
2.1 花生儲藏過程中酶活力變化
2.1.1 脂肪酶和脂肪氧化酶活力變化
花生中的氧化酶和抗氧化酶類活力在不同溫度下呈現不同的變化趨勢,由此直接或間接地影響花生中脂肪和蛋白質的氧化。不同溫度儲藏條件下花生脂肪酶和脂肪氧化酶活性變化如圖1、2所示。對于脂肪酶,15 ℃組在第3周時活力達到峰值((41.60±1.23)U/g),此后該組脂肪酶活力始終保持較低水平,這是因為低溫能有效抑制脂肪酶的活性[23]。25 ℃組脂肪酶活力在第3周和第9周分別達到兩個峰值((40.39±1.12)U/g和(40.82±0.70)U/g),隨后下降,第12周起從(35.03±1.01)U/g開始穩步上升,并在實驗結束時達到(47.12±1.34)U/g,超過了實驗初期的兩個峰值,且上升的趨勢并未放緩,與35 ℃組脂肪酶活力差距逐漸減小。35 ℃組脂肪酶活力在第3周達到第一個峰值((44.93±1.03)U/g),并自第6周起活力保持上升趨勢,在實驗結束時35 ℃組脂肪酶活力達到(59.00±1.70)U/g,顯著高于實驗初期該組脂肪酶活力達到的峰值,這是因為較高的溫度可以提高脂肪酶的活性,并且隨實驗時間推移,脂肪酶的活性始終保持上升趨勢。對于脂肪氧化酶,在15 ℃儲藏條件下,樣品的脂肪氧化酶活力在第18周達到峰值((1 036.14±34.49)U/g),此后樣品的脂肪氧化酶活力始終保持較低水平。35 ℃組樣品的脂肪氧化酶活力第18周達到峰值((1 287.17±98.45)U/g),在第18周后脂肪氧化酶活力呈下降趨勢,直至實驗結束時脂肪氧化酶活力下降至(1 009.62±42.39)U/g,其原因是長時間儲藏于高溫條件下會鈍化酶,從而導致活性大幅下降[24],對于25 ℃組來說,樣品脂肪氧化酶活力自開始儲藏后總體呈上升趨勢,并在第24周達到峰值((1 265.19±32.50)U/g),最終在實驗結束時降至(1 009.62±42.39)U/g。綜合分析3 種儲藏溫度條件下樣品脂肪氧化酶活力的變化過程可知,較高的儲藏溫度會提高脂肪氧化酶的活性,但高溫也會破壞酶的活性中心,導致儲藏后期酶活性的下降,低溫同樣能抑制脂肪氧化酶的活性。脂肪酶調控脂肪的氧化速率,催化脂肪水解生成大量的游離脂肪酸,使油脂酸敗、酸價升高、油脂風味變差。脂肪氧化酶會催化多不飽和脂肪酸氧化生成氫過氧化物,氫過氧化物會促進蛋白質等組分的氧化,同時自身會分解成其他揮發性風味物質,影響花生的風味[13],二者的活性變化會對花生儲藏過程中的油脂和蛋白質氧化進程產生影響。
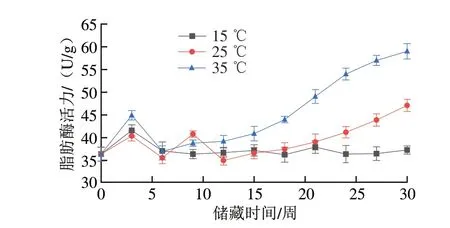
圖1 不同溫度條件下儲藏花生脂肪酶活力變化Fig.1 Changes in LPS activity of peanut stored at different temperatures
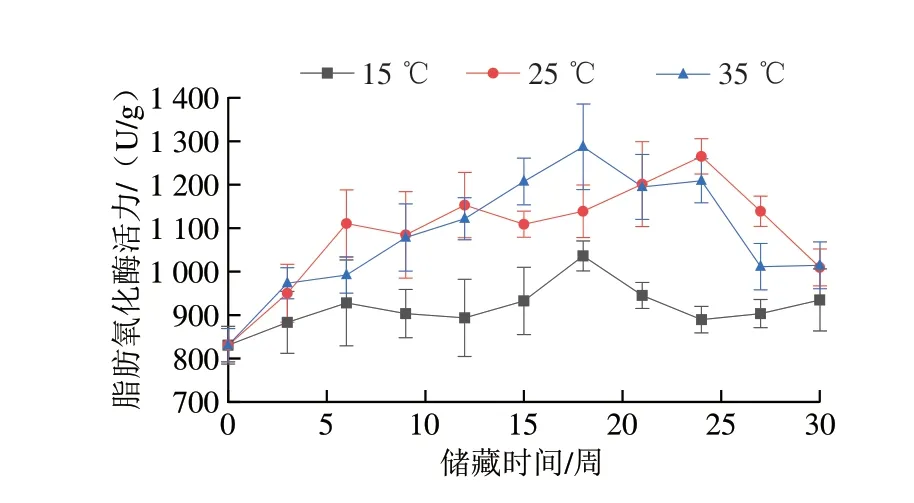
圖2 不同溫度條件下儲藏花生脂肪氧化酶活力變化Fig.2 Changes in LOX activity of peanut stored at different temperatures
2.1.2 過氧化物酶活力變化
過氧化物酶可將脂質的部分二次氧化產物轉化為無害的物質,由此清除積累的過氧化物,抑制花生品質的劣變[25]。由圖3可知,15、25、35 ℃組過氧化物酶活力均在第3周達到峰值,分別為102.3、104.5 U/g和107.1 U/g,25 ℃組和35 ℃組過氧化物酶活力在達到峰值后之后呈下降趨勢,15 ℃組過氧化物酶活力在第12周后不再發生明顯變化。其原因是花生籽粒作為活的生命有機體,在面對非生物脅迫時,活性氧等指標水平顯著上升,在此情況下籽粒自身會啟動防御響應來抵御活性氧對細胞造成的損傷,包括酶類和非酶類的活性氧清除系統,其中酶類的防御響應主要包括超氧化物歧化酶、過氧化物酶、過氧化氫酶等抗氧化酶類活性的升高,非酶類的防御響應主要包括植物體內的多種維生素、滲透調節物質含量提升以及如鞘脂代謝增強[26-28]等,因此在溫度脅迫下,儲藏初期花生的過氧化物酶活力上升。部分研究表明,在長期儲藏過程中,植物的抗氧化酶類活性總體呈下降趨勢,且溫度越高,活性下降越明顯,低溫能夠有效抑制過氧化物酶活性的降低。在本實驗中,第3周過氧化物酶活力上升是由于受到溫度脅迫時植物體啟動了防御響應,而在長時間儲藏過程中,25 ℃組和35 ℃組由于自由基過量積累和細胞衰老等原因[29],抗氧化酶活性無法長期保持較高的水平,因此在儲藏中后期活性明顯降低。
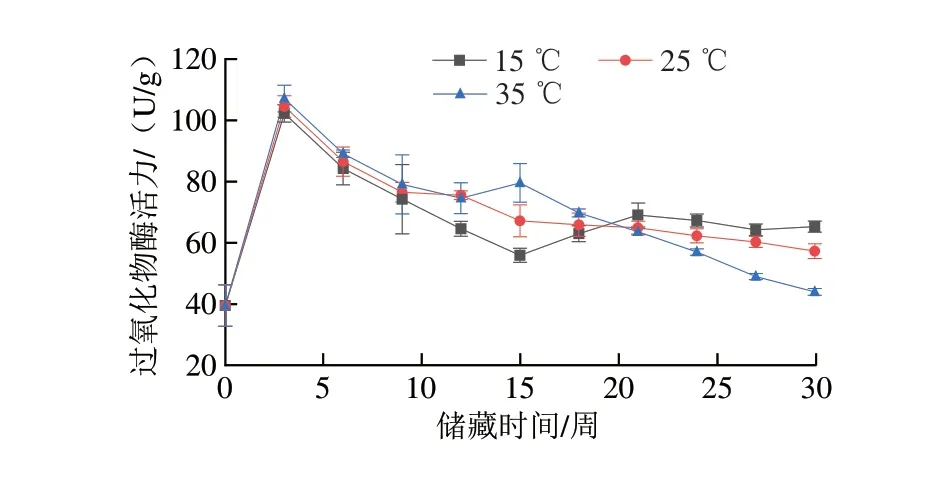
圖3 不同溫度條件下儲藏花生過氧化物酶活力變化Fig.3 Change in POD activity of peanut stored at different temperatures
2.2 花生儲藏過程中油脂氧化指標變化
氧化劣變的程度通常可用過氧化值、酸價以及MDA含量等指標量化。過氧化值能夠反映初級氧化的程度,酸價則被用來評估小分子的醛、酮、醇類等二次氧化產物水平,而MDA是脂質過氧化的主要產物,其含量可以反映脂質過氧化的程度。在50%恒定相對濕度,15、25 ℃和35 ℃儲藏溫度下,儲藏30 周過氧化值、酸價以及MDA含量的變化分別如圖4~6所示。在整個儲藏過程中,不同溫度條件下的樣品各指標均隨儲藏時間延長而升高,且上升幅度與溫度有密切聯系,高溫環境下儲藏的樣品各指標上升幅度顯著高于低溫環境下儲藏的樣品。儲藏30 周后,儲藏于35 ℃條件下的花生仁酸價從儲藏初期(0.48±0.01)mg/g上升至(3.15±0.10)mg/g,增加了5.6 倍,儲藏于15、25 ℃條件下的花生仁酸價同期分別上升至(0.99±0.09)mg/g和(1.78±0.02)mg/g,增加了1.06 倍和2.71 倍。儲藏于35 ℃條件下的花生仁過氧化值從儲藏初期0.14 mmol/kg上升至7.75 mmol/kg,增加了54.4 倍,儲藏于15、25 ℃條件下的花生仁過氧化值同期分別增加了18.4 倍和28.6 倍。同時,儲藏于35 ℃條件下的花生仁MDA含量從從儲藏初期的23.03 nmol/g上升至1 039.63 nmol/g,增加了44.1 倍,儲藏于15、25 ℃條件下的花生仁同期分別增加了25.0 倍和35.8 倍。花生仁中油脂經脂肪酶的催化能分解成甘油和游離脂肪酸,脂肪酸進一步分解成低級的醛、酮類化合物,對水稻、核桃等糧油作物的研究均表明高溫引起的氧化酶類活性升高是導致花生酸價上升、風味劣變和品質降低的原因[30-32]。綜上,高溫對脂肪氧化的影響一方面是加速脂肪碳鏈受熱斷裂,另一方面是加速酶類對脂類的水解,產生更多游離脂肪酸[33],而低溫儲藏條件除了抑制氧化酶類的活性,還減少了抗氧化物質如VE的消耗[8],起到了減緩花生油脂氧化的作用。

圖4 不同溫度條件下儲藏花生酸價變化Fig.4 Changes in AV of peanut stored at different temperatures
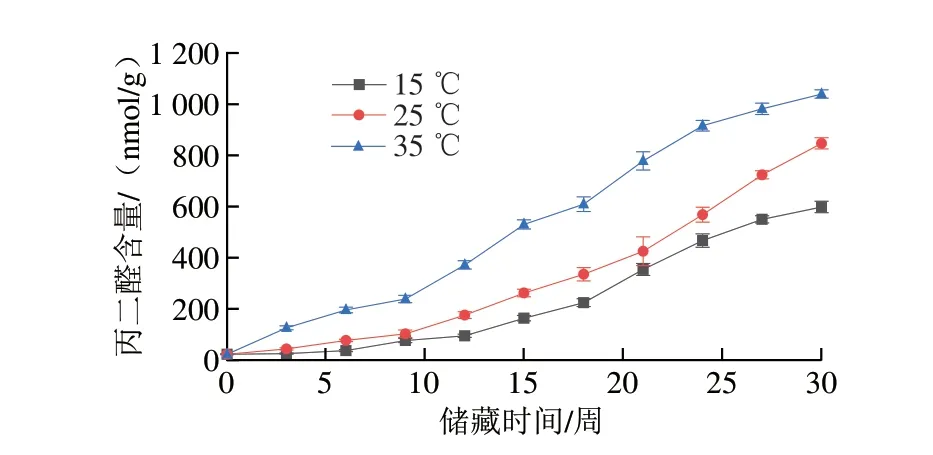
圖6 不同溫度條件下儲藏花生MDA含量變化Fig.6 Changes in MDA content of peanut stored at different temperatures
2.3 花生儲藏過程中蛋白質氧化指標變化
2.3.1 羰基含量變化
蛋白質氧化反應可分為直接反應和間接反應。蛋白質可以被活性氧直接誘導發生主肽鏈或側鏈基團氧化,或者被脂質過氧化反應產生的活性中間產物誘導而發生氧化[34]。由圖7可知,不同樣品在30 周的儲藏周期內羰基含量均隨儲藏時間延長而升高。第30周,儲藏于35 ℃條件下的花生仁羰基含量從儲藏初期的(3.19±0.24)μmol/g上升至(124.86±3.07)μmol/g,增加了38.1 倍,儲藏于15、25 ℃條件下的花生仁羰基含量同期分別上升至(57.78±2.06)μmol/g和(118.61±6.41)μmol/g,增加了17.1 倍和36.2 倍。蛋白質氨基酸側鏈的直接氧化、肽骨架的斷裂和還原糖反應或者和非蛋白羰基化合物相結合都可以產生羰基[35]。高溫條件下氧化酶的高活性催化了油脂的氧化,也使反應繼續向生產羰基化合物的方向進行,同時,由于儲藏后期35 ℃組脂肪氧化酶活性下降,而25 ℃組脂肪氧化酶活性持續上升,二者的羰基含量依然保持上升趨勢并逐漸接近。
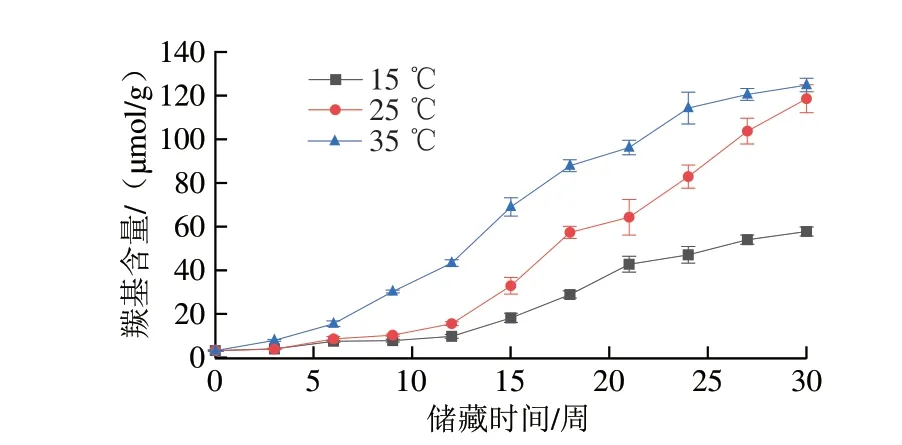
圖7 不同溫度條件下儲藏花生羰基含量變化Fig.7 Changes in carbonyl content of peanut stored at different temperatures
2.3.2 巰基與二硫鍵含量變化
二硫鍵和巰基是穩定蛋白質分子構象的重要化學鍵,蛋白質游離巰基和二硫鍵含量的變化與蛋白質中的活性基團特別是半胱氨酸殘基密切相關,氧化可以改變半胱氨酸的氧化還原狀態,進而改變蛋白質分子中巰基和二硫鍵的含量和分布[22],在蛋白質氧化中,巰基會被轉變為二硫鍵[36]。因此,游離巰基與二硫鍵含量可以作為評價蛋白質氧化程度的重要指標。由圖8、9可知,不同樣品在儲藏過程中游離巰基含量明顯下降,同時二硫鍵含量明顯上升。儲藏30 周后,各組花生仁游離巰基含量較儲藏初期下降了72.5%~83.1%。儲藏于35 ℃條件下的花生仁二硫鍵含量從儲藏初期的37.98 μmol/g上升至65.14 μmol/g,增加了0.72 倍,儲藏于15、25 ℃條件下的花生仁游離巰基含量同期分別增加了0.63 倍和0.41 倍。出現上述現象的原因是在儲藏過程中蛋白的結構被破壞,暴露出更多易氧化的半胱氨酸及其殘基,同時游離巰基被氧化為二硫鍵,導致游離巰基含量的減少和二硫鍵含量的上升。但隨著樣品中各氧化酶類活性的升高,大量的游離巰基被轉化為二硫鍵,這一現象在35 ℃組中尤為明顯。

圖8 不同溫度條件下儲藏花生游離巰基含量變化Fig.8 Change in free sulfhydryl content of peanut stored at different temperatures

圖9 不同溫度條件下儲藏花生二硫鍵含量變化Fig.9 Changes in disulfide bond content of peanut stored at different temperatures
除了溫度、酶類對花生蛋白質氧化產生影響以外,油脂的氧化同樣對蛋白質氧化產生影響,油脂和蛋白質的共氧化是近幾年新興的研究方向,由于脂類和蛋白質之間存在著復雜的相互作用[37],因此二者的共氧化機制還在研究中。目前對共氧化的研究方法主要有3 種,以研究蛋白質氧化為例:第一種方法是去除樣品中的油脂成分,探究在無油脂存在的情況下,蛋白質的氧化情況[38-39];第二種方法是抑制樣品中油脂的氧化,比如通過添加抗氧化劑的方式,探究在油脂氧化被抑制的情況下蛋白質的氧化情況[40];第三種方法是將蛋白質置于模擬的脂類氧化條件下探究蛋白質的氧化規律[17]。在脂質過氧化反應中產生的脂質氫過氧化物通過一定的條件可轉化生成活性羰基化合物[41],蛋白質側鏈基團可與活性羰基化合物反應產生共價交聯物[22],其中最為常見的是活性醛氧化蛋白質,上文中提到的MDA就是典型的活性醛類化合物。這一過程在一些植物性原料中已被證實,如尤翔宇發現脂質過氧化對米糠蛋白的結構和功能特性等存在影響[36],但該方向的研究大部分集中于肉類蛋白,對于植物蛋白與油脂氧化的相互作用研究還待進一步深入。這些因素對蛋白質氧化的促進作用導致了蛋白質風味改變、營養缺失和功能特性的改變。
3 結論
本研究結果表明,脂肪酶和脂肪氧化酶的活性以及活性變化速率受溫度影響較大,高溫可以提升脂肪酶和脂肪氧化酶的活性,而低溫可使氧化酶類活性始終保持較低水平。各組過氧化物酶的活性無法在長時間儲藏下保持高水平的活性且高溫對酶活性中心破壞最嚴重。儲藏過程中各組樣品的油脂和蛋白質氧化指標水平均呈上升趨勢,且高溫條件下樣品的二者氧化程度最為嚴重,其中油脂的一次、二次氧化產物含量均增加,表現為過氧化值和酸價的上升,影響蛋白質氧化的活性醛類化合物如MDA含量也同時上升,蛋白質由于結構破壞和氨基酸側鏈氧化等多種原因也發生氧化。綜上,較高的儲藏溫度下可以通過影響酶類的活性提高花生油脂和蛋白質氧化速率,導致花生油脂和蛋白質氧化程度加深,由此影響花生的品質。

