持續性心房顫動患者首次射頻消融術后1 年復發的影響因素
廉玉蓉,王芳,段續敏,劉念
心房顫動是臨床常見的心律失常類型,其發病率約為2%[1],主要并發癥為心力衰竭和血栓形成導致的栓塞事件,其可降低患者的生存質量及增加患者的死亡率[2]。目前,射頻消融術已成為藥物治療無效的心房顫動患者的一線治療方案,但術后患者復發率較高(約為60%)[3-4],且復發的具體機制尚不明確。基于此,本研究旨在探討持續性心房顫動患者首次射頻消融術后1年復發的影響因素,以期能早期發現并及時干預復發風險高的持續性心房顫動患者。
1 對象與方法
1.1 研究對象 選取2019—2021年在臨汾市人民醫院首次行射頻消融術的持續性心房顫動患者96例。納入標準:(1)心電圖或24 h動態心電圖記錄到心房顫動持續時間>1周;(2)符合射頻消融術相關指征。排除標準:(1)合并器質性心臟病、腎衰竭者;(2)甲狀腺功能亢進引起的心房顫動者;(3)既往有心臟外科手術史者;(4)妊娠期婦女;(5)有抗凝禁忌證或左心房血栓者;(6)預期壽命<1年者。本研究通過臨汾市人民醫院倫理委員會審核批準(T20230112001),所有患者簽署知情同意書。
1.2 射頻消融術
1.2.1 消融前準備 經右頸內靜脈置入冠狀竇電極,經右股靜脈置入Swartz長鞘,穿刺房間隔后送Swartz長鞘至肺靜脈,右前斜30°后行左右肺靜脈造影。術中使用Carto三維電解剖標測系統(Biosense Webster,Diamond Bar,CA),將高精密度標測電極(Pentaray,Biosense Webster)經Swartz長鞘送入左心房后重建左心房三維電解剖標測。采用冷鹽水灌注射頻消融導管進行消融。術中采用舒芬太尼進行局部鎮痛。
1.2.2 消融術式 采用“2C3L”術式。所有患者行大環肺靜脈前庭隔離,采用肝素鹽水持續灌注導管(非消融時2 ml/min,消融時17~20 ml/min),功率為35~40 W。若心房顫動不終止則進一步進行左心房頂線、二尖瓣峽部及三尖瓣峽部線性消融,若術中出現房性心律失常則進一步進行激動標測和消融。如仍存在心房顫動,則給予200 J雙相同步電復律。術中轉復為竇性心律后鞏固消融,以達到雙肺靜脈完全電隔離,若二尖瓣峽部線性消融未完全阻滯則進一步于冠狀竇內進行消融,術中未進行基質消融。
1.2.3 術后管理 術后在無禁忌證的情況下,所有患者接受為期3個月的抗凝治療及抗心律失常藥物治療,根據其血壓和心率情況使用胺碘酮、普羅帕酮或索他洛爾治療,然后常規應用質子泵抑制劑治療1個月。
1.3 資料收集 記錄所有患者的臨床資料、術中消融終止心房顫動情況和冷鹽水灌注射頻消融導管類型。臨床資料包括性別、年齡、心房顫動類型(分為持續性心房顫動和長程持續性心房顫動)、既往史〔高血壓、糖尿病、冠心病、卒中及短暫性腦缺血發作(transient ischemic attack,TIA)史〕、有無卵圓孔未閉、CHA2DS2-VASc評分、實驗室檢查指標〔包括白細胞計數(white blood cell count,WBC)、血小板計數(platelet count,PLT)、尿酸、估算腎小球濾過率(estimated glomerular filtration rate,eGRF)〕、經胸心臟超聲心動圖檢查結果〔包括左心房前后徑、左心室舒張末期內徑(left ventricular end diastolic dimension,LVEDD)及左心室射血分數(left ventricle ejection fraction,LVEF)〕。
1.4 隨訪 所有患者術后定期(1、3、6、12個月)進行門診隨訪,主要隨訪內容為動態心電圖檢查或12導聯心電圖檢查,針對未進行門診隨訪的患者進行電話隨訪,并建議患者在當地醫院進行12導聯心電圖或動態心電圖檢查。記錄患者術后3個月內心房顫動或心房撲動發生情況及術后1年復發情況。復發定義為12導聯心電圖或動態心電圖記錄到持續時間>30 s的房性心律失常,包括心房顫動、心房撲動和房性心動過速。根據術后1年復發情況將患者分為復發組(n=21)和未復發組(n=72)。
1.5 統計學方法 使用SPSS 20.0統計學軟件進行數據處理。符合正態分布的計量資料以(±s)表示,兩組間比較采用成組t檢驗;不符合正態分布的計量資料以M(P25,P75)表示,兩組間比較采用秩和檢驗;計數資料以相對數表示,組間比較采用χ2檢驗;持續性心房顫動患者首次射頻消融術后1年復發的影響因素分析采用多因素Logistic回歸分析。以P<0.05為差異有統計學意義。
2 結果
2.1 一般情況 隨訪期間,2例患者失訪、1例患者于術后3個月猝死,共93例患者完成隨訪,其中復發21例,復發率為22.6%(21/93)。
2.2 持續性心房顫動患者首次射頻消融術后1年復發的單因素分析 復發組與未復發組男性占比、年齡、既往史、卵圓孔未閉者占比、CHA2DS2-VASc評分、WBC、PLT、尿酸、eGFR、左心房前后徑、LVEDD、LVEF及術中消融終止心房顫動者占比比較,差異無統計學意義(P>0.05);復發組與未復發組心房顫動類型、冷鹽水灌注射頻消融導管類型及術后3個月內發生心房顫動或心房撲動者占比比較,差異有統計學意義(P<0.05),見表1。
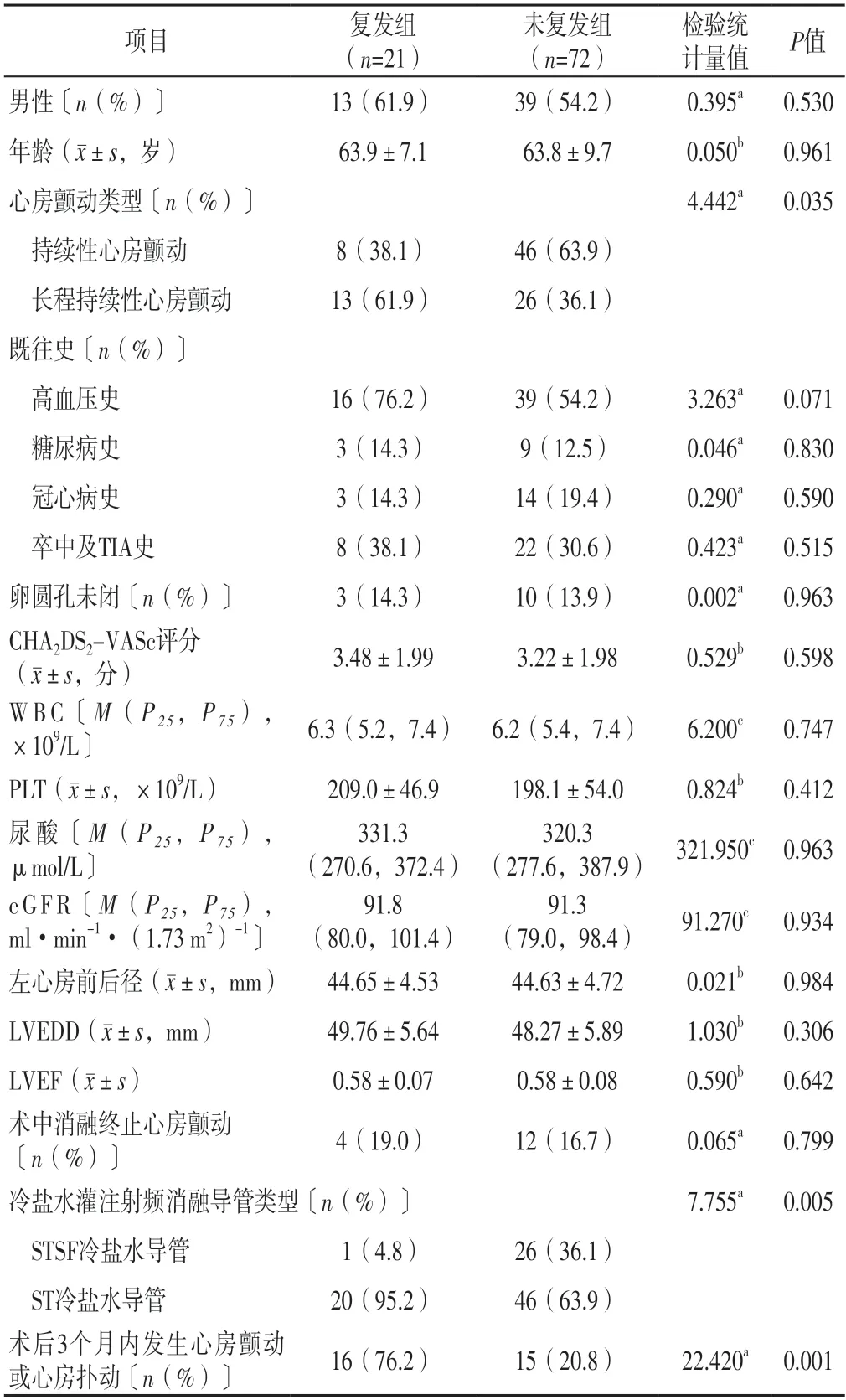
表1 持續性心房顫動患者首次射頻消融術后1年復發的單因素分析Table 1 Univariate analysis of recurrence one-year after first radiofrequency ablation in patients with persistent atrial fibrillation
2.3 持續性心房顫動患者首次射頻消融術后1年復發的多因素Logistic回歸分析 將單因素分析中差異有統計學意義的指標作為自變量(心房顫動類型賦值:持續性心房顫動=0,長程持續性心房顫動=1;冷鹽水灌注射頻消融導管類型賦值:ST冷鹽水導管=0,STSF冷鹽水導管=1;術后3個月內發生心房顫動或心房撲動情況賦值:未發生=0,發生=1),將患者術后1年復發情況作為因變量(賦值:未復發=0,復發=1),進行多因素Logistic回歸分析,結果顯示,術后3個月內發生心房顫動或心房撲動是持續性心房顫動患者首次射頻消融術后1年復發的危險因素(P<0.05),見表2。
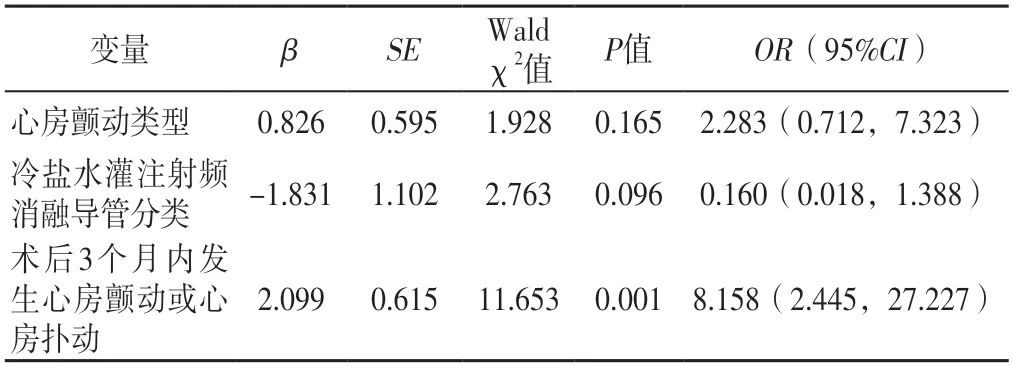
表2 持續性心房顫動患者首次射頻消融術后1年復發的多因素Logistic回歸分析Table 2 Multivariate Logistic regression analysis of recurrence one-year after first radiofrequency ablation in patients with persistent atrial fibrillation
3 討論
心房顫動是臨床常見的心律失常類型,其會增加患者腦卒中、心肌梗死及心力衰竭發生風險,從而增加患者的病死率[5-6]。目前,心房顫動的治療方法主要包括藥物、射頻消融術、心臟起搏治療及外科手術,其中藥物是最主要的治療方法,其目的是治療心房顫動的病因及誘因、控制節律、控制室率及預防并發癥等。《2020歐洲心臟病學會心房顫動診斷和管理指南》[7]指出,針對藥物治療無效且有癥狀的持續性心房顫動患者,導管消融術治療證據等級應從Ⅱa類升高至Ⅰ類。觸發機制和維持機制被認為是心房顫動的主要發病機制,而根據該機制制定的射頻消融方案是目前治療心房顫動的主要手段[8]。肺靜脈區域是心房顫動的常見起源部位,故臨床上主要采用左右肺靜脈雙環隔離治療心房顫動[9]。據報道,肺靜脈電隔離治療陣發性心房顫動的成功率為50%~70%,但其對持續性心房顫動的治療效果有限,在臨床實踐中常需要結合線性消融和基質改良策略[10]。雖然目前射頻消融術已成為藥物治療無效的心房顫動患者的一線治療方案,但患者術后仍存在較高的復發率,進而嚴重影響患者的病情恢復及日常生活[11]。因此,探討持續性心房顫動患者首次射頻消融術后1年復發的影響因素具有重要的臨床意義。
理論上,心房顫動可以導致心房顫動,心房顫動持續時間越長,心房電重構及結構重構越明顯,復發風險越高[12]。但本研究結果顯示,長程持續性心房顫動不是持續性心房顫動患者首次射頻消融術后1年復發的獨立影響因素,分析其原因可能與本研究樣本量較小有關。既往研究表明,PLT異常[13]、尿酸增高[14-15]、LVEDD增大及LVEF降低[16]會導致心房顫動患者射頻消融術后復發率增高,但本研究未得到類似結果,分析原因可能與本研究樣本量較小有關。左心房擴大可導致心房內不同部位出現非均質性電活動,從而誘發或加重心房顫動[17];而一旦發生心房顫動,左心房收縮功能也會出現異常,進而導致電重構和結構重構,促使左心房進一步擴大,從而形成惡性循環,這也會導致射頻消融術后復發率升高[18]。一項包括3 750例患者的Meta分析結果顯示,復發組較未復發組患者左心房內徑平均增加1.87 mm(P<0.001)[18]。但MCCREADY等[19]認為,心房顫動患者射頻消融術后復發并非僅由左心房內徑增大所致。本研究結果也顯示,復發組與未復發組左心房前后徑比較差異無統計學意義。目前,對于持續性心房顫動患者術中是否消融終止心房顫動尚無統一結論。劉俊等[20]研究結果顯示,采用消融恢復竇性心律者和采用藥物/電復律恢復竇性心律者遠期療效比較,差異無統計學意義(P>0.05)。本研究結果顯示,復發組和未復發組術中采用消融終止心房顫動者占比比較無統計學差異。因此,臨床上可以不將消融作為恢復心律的主要方式,以免引起消融不足或消融過度。近年來隨著導管器械的不斷改進,心房顫動射頻消融術取得了重大進展。國外研究表明,STSF冷鹽水導管的56孔灌注設計可以使冷卻效果更佳,能進一步提高手術效率、縮短手術時間、減少術中灌注[21]。目前,STSF冷鹽水導管結合消融指數是保證射頻消融透壁性和連續性損傷的較好選擇[22]。本研究結果顯示,復發組使用STSF冷鹽水導管者占比低于未復發組,但多因素Logistic回歸分析結果顯示,STSF冷鹽水導管不是持續性心房顫動患者首次射頻消融術后1年復發的影響因素。分析原因可能與本研究使用STSF冷鹽水導管的患者例數較少有關,真實結果有待進一步驗證。
研究表明,射頻消融術后3個月為空白期,該時間段內發生心房顫動或心房撲動的可能機制包括消融后炎癥反應及組織水腫、自主神經系統不平衡、消融不連續透壁引起肺靜脈傳導恢復及靶消融區域未形成持久的消融損傷或傳導阻滯[23-26],其發生率為15.9%~65.0%[27]。心房顫動患者射頻消融術后空白期復發是一過性現象,并非代表手術失敗。本研究結果顯示,術后3個月內發生心房顫動或心房撲動是持續性心房顫動患者首次射頻導管消融術后1年復發的危險因素,與薛利等[28]研究結果相似。筆者結合臨床實踐認為,心房顫動射頻消融術中做到連續透壁且持久的消融損傷是減少術后空白期心房顫動復發的重要因素,而要做到連續透壁且持久的消融損傷,除了需要消融指數指導外,還需要術者有豐富的手術經驗。
綜上所述,術后3個月內發生心房顫動或心房撲動是持續性心房顫動患者首次射頻消融術后1年復發的危險因素。但本研究為單中心研究,樣本量較小,隨訪時間較短,可能對結果產生影響;同時,本研究主要通過心電圖、動態心電圖檢查等評估房性心律失常復發情況,不排除無癥狀房性心律失常復發的可能,故本研究統計的心房顫動復發率可能偏低。
作者貢獻:廉玉蓉進行文章的構思與設計,研究的實施與可行性分析,負責撰寫、修訂論文;王芳、段續敏進行數據收集、整理、分析,結果分析與解釋;劉念負責文章的質量控制及審校,對文章整體負責、監督管理。
本文無利益沖突。

