血清促腎上腺皮質激素與老年高血壓合并射血分數保留型心力衰竭患者發生心房顫動的關系
桑明敏,祝存奎,馬生龍
高血壓被認為是射血分數保留型心力衰竭(heart failure with preserved ejection fraction,HFpEF)的重要病因,其會對患者心功能造成較大損傷,引起心室充盈、擴大及舒張功能障礙[1]。心房顫動(以下簡稱房顫)是高血壓合并HFpEF患者比較常見的并發癥,其會進一步加重心肌損傷程度,促進病情惡化,導致心腦血管意外風險增加,進而增加患者的再住院率及病死率[2]。因而早期識別高血壓合并HFpEF患者中房顫高風險者,對于臨床早期制定針對性干預措施,改善患者預后具有重要意義。近年研究發現,機體下丘腦-垂體-腎上腺軸功能異常會導致心肌纖維化及心室重構,從而影響心功能[3-4]。而心肌纖維化是房顫發生的一個重要的病理生理因素[5]。血清促腎上腺皮質激素(adrenocorticotropic hormone,ACTH)是腦垂體分泌的一種多肽類激素,能促進腎上腺皮質組織增生及皮質激素的生成與分泌,進而調節下丘腦-垂體-腎上腺軸功能,間接影響心功能[6]。但目前關于血清ACTH與高血壓合并HFpEF患者發生房顫的關系尚不明確。因此,本研究探討血清ACTH與老年高血壓合并HFpEF患者發生房顫的關系,旨在為預防老年高血壓合并HFpEF患者發生房顫提供新思路。
1 對象與方法
1.1 研究對象 前瞻性選取2020年5月至2021年10月于青海省心腦血管病專科醫院就診的老年高血壓合并HFpEF患者150例。納入標準:(1)符合《中國老年高血壓管理指南2019》[7]中高血壓及《中國心力衰竭診斷和治療指南2018》[8]中心力衰竭的診斷標準;(2)年齡≥60歲;(3)患者及家屬均對本研究知情并自愿簽訂同意書。排除標準:(1)伴有類風濕性心臟病、慢性肺源性心臟病、感染性心內膜炎等其他可能引起房顫的疾病者;(2)伴有嚴重精神疾病者;(3)伴有肺癌、基底細胞腺癌、垂體瘤等可能影響血清ACTH的惡性腫瘤者;(4)既往有陣發性、持續性房顫病史者;(5)近1個月內存在重大創傷、感染、血液系統疾病者。剔除標準:(1)隨訪期間失訪、全因死亡者;(2)隨訪期間主動要求退出本研究者。本研究符合《赫爾辛基宣言》,并經青海省心腦血管病專科醫院醫學倫理委員會審核通過(倫審號:QXYYLL-2022-030)。
1.2 研究方法
1.2.1 一般資料采集 采用自制一般資料調查表采集患者年齡、性別、高血壓病程、BMI、入院時收縮壓、入院時舒張壓及有無心血管病家族史、吸煙史、飲酒史。
1.2.2 實驗室檢查 采集所有患者入院后肘靜脈血6 ml,分裝2管。1管加入抗凝劑后充分抗凝,然后以3 000 r/min離心10 min(離心半徑10 cm),留取血漿,采用干式電化學法檢測N末端腦鈉肽前體(N-terminal pro-brain natriuretic peptide,NT-proBNP),所用試劑購自北京樂普診斷科技股份有限公司。另外1管直接以3 000 r/min離心10 min(離心半徑10 cm),留取血清,采用磁敏免疫法檢測心肌肌鈣蛋白I(cardiac troponin I,cTnI),所用試劑購自東莞博識生物科技有限公司;采用磁微粒化學發光法檢測ACTH,所用試劑購自湖南攜光生物技術有限公司。
1.2.3 房顫評估方法 所有患者入院后進行常規治療(包括降壓、糾正電解質紊亂、調整生活方式、抗凝、抑制交感神經活性等),待病情穩定后出院并遵醫囑用藥,出院后隨訪1年(隨訪時間截至2022-10-31),每月電話隨訪1次,每3個月門診復查1次,進行心電圖、動態心電圖等相關檢查,若隨訪期間出現心悸、頭暈、胸悶、乏力等癥狀,及時到醫院進行檢查。參照《心房顫動基層診療指南(2019年)》[9]中相關診斷標準,若心電圖P波消失,代之以振幅、頻率不等的f波,RR間期絕對不整,伴或不伴有胸悶、頭暈、黑蒙等癥狀則定義為發生房顫。
1.3 統計學方法 采用SPSS 25.0統計學軟件進行數據處理。符合正態分布的計量資料以(±s)表示,組間比較采用兩獨立樣本t檢驗;符合偏態分布的計量資料以M(P25,P75)表示,組間比較用Mann-WhitneyU檢驗;計數資料以相對數表示,組間比較采用χ2檢驗;采用多因素Logistic回歸分析探討血清ACTH與老年高血壓合并HFpEF患者發生房顫的關系。以P<0.05為差異有統計學意義。
2 結果
2.1 一般資料 150例患者中,6例隨訪期間失訪、2例隨訪期間病死,最終納入142例患者。142例患者中60例發生房顫,房顫發生率為42.3%,將其作為房顫組,其余82例患者作為非房顫組。兩組年齡、性別、高血壓病程、BMI及有心血管病家族史、吸煙史、飲酒史者占比比較,差異無統計學意義(P>0.05);房顫組入院時收縮壓、舒張壓及血清NT-proBNP、cTnI、ACTH高于非房顫組,差異有統計學意義(P<0.05),見表1。
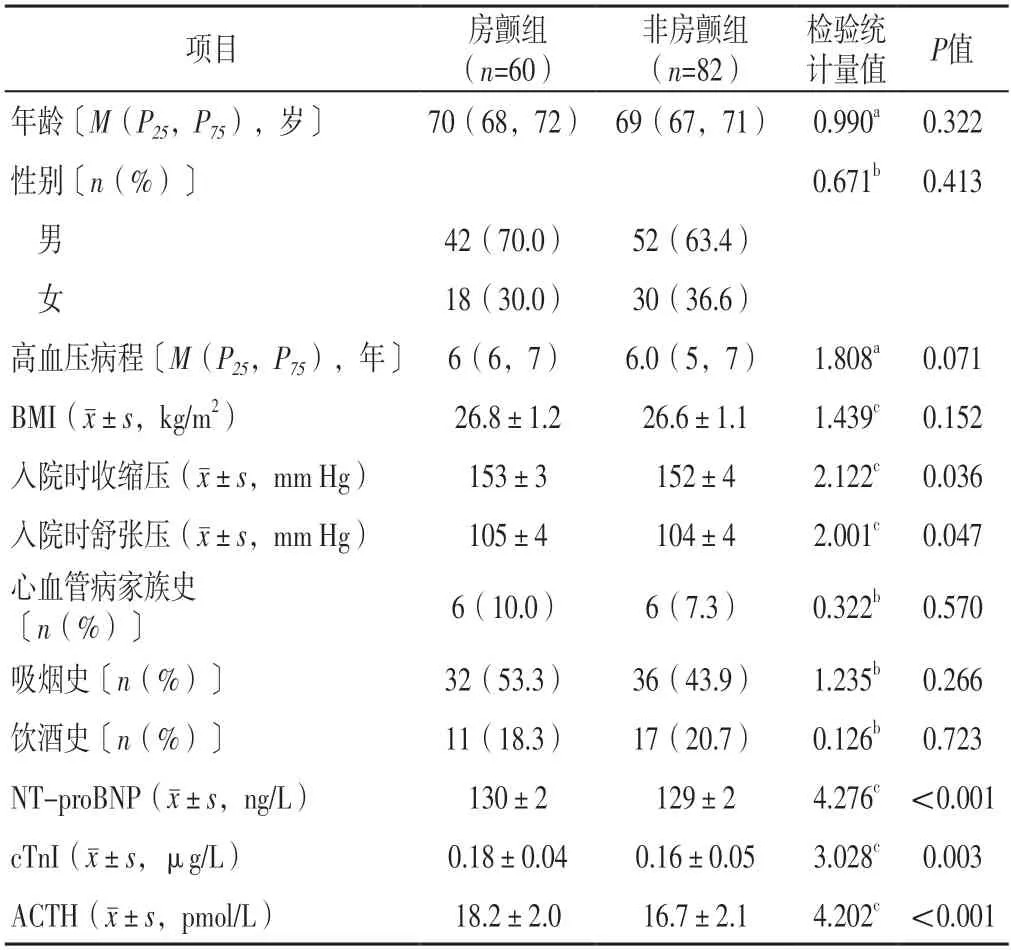
表1 兩組一般資料、實驗室檢查指標比較Table 1 Comparison of general data and laboratory examination indexes between the two groups
2.2 老年高血壓合并HFpEF患者發生房顫影響因素的多因素Logistic回歸分析 以老年高血壓合并HFpEF患者發生房顫情況作為因變量(賦值:發生=1,未發生=0),以表1中P<0.05的指標作為自變量(實測值),進行多因素Logistic回歸分析,結果顯示,血清NT-proBNP、ACTH升高是老年高血壓合并HFpEF患者發生房顫的獨立危險因素(P<0.05),見表2。

表2 老年高血壓合并HFpEF患者發生房顫影響因素的多因素Logistic回歸分析Table 2 Multivariate Logistic regression analysis of influencing factors of atrial fibrillation in elderly hypertension patients combined with HFpEF
3 討論
“十二五”高血壓抽樣調查結果顯示,中國成年人高血壓患病率約為23.2%,且其呈逐年上升趨勢,這也導致高血壓引起的HFpEF發病率升高[10]。相關文獻報道,若高血壓合并HFpEF患者相關危險因素及病情未得到有效控制,會使心肌組織長期處于機械負荷狀態,最終導致心肌收縮功能受損,引發房顫[11]。一項國外研究顯示,HFpEF患者房顫患病率約為56.7%,且房顫的發作可增加卒中、周圍血栓栓塞等不良事件的發生風險[12]。本研究142例患者出院后1年房顫發生率為42.3%,提示老年高血壓合并HFpEF患者房顫發生風險較高,而如何早期識別高危患者并進行針對性靶向治療、降低房顫發生風險是臨床關注的重點課題。
既往研究表明,高血壓合并HFpEF患者心臟血管因長期處于高壓狀態而發生血管重塑,導致血管硬度增加,韌性降低,最終導致血管結構發生改變,引起心肌纖維化及心室重塑,增加房顫發生風險[13-14]。ACTH是39肽的小分子物質,其結構與功能具有高度保守性,可調控腎上腺細胞增殖,維持腎上腺正常形態與功能,當ACTH水平異常升高時,可激活腎素-血管緊張素系統,引起血管收縮,最終導致血壓升高[15]。因此,高水平ACTH參與了血管重塑病理過程,成為心血管事件的潛在風險因素,但其是否與老年高血壓合并HFpEF患者發生房顫有關還需進一步研究證實。
本研究多因素Logistic回歸分析結果顯示,血清ACTH升高是老年高血壓合并HFpEF患者發生房顫的獨立危險因素,提示血清ACTH升高可增加高血壓合并HFpEF患者房顫發生風險。分析原因可能如下:心血管系統是人體的一個動力系統,生理狀態下,脈管中的血流施加給血管壁的切應力、正應力及張應變在維持血管正常結構與功能及心臟周期性搏動中發揮著重要作用[16]。而血清ACTH作為垂體前葉嗜堿性細胞合成并分泌的一種神經肽類物質,其水平異常升高可促進腎上腺皮質球狀帶細胞分泌鹽皮質激素,導致水鈉失衡,引起高血壓表征,并能通過激活細胞表面受體的方式抑制G蛋白信號通路調節因子Rgs2、Rgs5的表達,上調細胞膜微囊蛋白1的表達,從而參與高血壓血管細胞功能調控過程,引起機體血壓升高,增加心臟血管壁的切應力、正應力及張應變[17-19]。而長期存在的高應力會使血管平滑肌細胞外基質產生形變,并通過離子通道、酪氨酸激酶、黏著斑等力學感受器激活細胞外調節蛋白激酶、絲裂原活化蛋白激酶、血小板衍生生長因子受體等一系列復雜的細胞信號通路調控血管平滑肌細胞下游細胞核基因表達,進而改變血管平滑肌細胞分化、增殖、凋亡及細胞外基質合成過程,誘導血管重塑,引起血管中膜增厚、內徑縮小及細胞外基質增多,最終促進心肌纖維化及心肌重塑,引起心臟不協調活動,導致房顫的發生[20-21]。另外,血清ACTH水平異常升高還會促進腎上腺皮質醇表達,而過度表達的腎上腺皮質醇又會協同各種血管升壓素促進血管收縮,引起血壓升高,從而對心肌組織產生持久的損傷,促進心肌纖維化及心室重塑進程,導致心臟電活動紊亂,從而引發房顫[22]。
綜上所述,血清ACTH升高是老年高血壓合并HFpEF患者發生房顫的危險因素,即血清ACTH越高,患者房顫發生風險越高。因此,入院時及隨訪期間監測血清ACTH變化有助于優化高血壓合并HFpEF患者干預方案,早期識別房顫高風險患者。但本研究隨訪時間較短,且納入的研究對象均為老年患者,所得結論具有一定的局限性,今后仍需擴大研究對象年齡范圍、延長隨訪時間以進一步驗證本研究結論。
作者貢獻:桑明敏、祝存奎進行文章的構思與設計,資料收集、整理;桑明敏、祝存奎、馬生龍進行研究的實施與可行性分析;桑明敏撰寫、修訂論文,對文章整體負責、監督管理;祝存奎、馬生龍進行統計學處理;桑明敏、馬生龍負責文章的質量控制及審校。
本文無利益沖突。

