斑點叉尾鮰PCR鑒定方法
鄭劍 曾憲東 周旋 王柘珉 鄒彩娟
摘? 要:該試驗根據斑點叉尾鮰(Ietalurus punetaus)特異保守基因序列,設特異性實時熒光PCR引物和探針,建立實時熒光PCR快速鑒定方法,然后進行PCR反應特異性和靈敏性驗證。結果表明,建立的實時熒光PCR檢測方法簡單、快速、靈敏度高,檢測靈敏度可達到6.07×101copies/μL,具有較大的應用價值,為相關魚類的肉制品源性鑒別提供了科學依據,適用于水產加工品貿易中斑點叉尾鮰的物種真偽鑒定,還可廣泛應用于以水產檢驗及食品衛生檢測等領域。
關鍵詞:斑點叉尾鮰(Ietalurus punetaus);PCR;成分鑒定
中圖分類號:S965.1文獻標志碼:A
斑點叉尾鮰(Ictalurus punctatus)全稱美國斑點叉尾鮰,又稱溝鯰、河鯰、美洲鯰,隸屬真骨總目(Teleostei),有鰾首目(Ostariophysi),鲇形目(Siluriformes),北美鯰科(Ictaluridae),叉尾鮰屬(Ictalurus)。其因適溫范圍廣、生長快、抗病能力強、飼料轉化率高,適于集約化和規模化養殖;而且其肉質鮮美,營養價值高,易于加工,一直深受養殖戶和消費者喜歡。中國于1984年由湖北省水產研究所從美國引進斑點叉尾鮰,并于1987年人工繁殖成功,為發展商品養殖奠定了基礎。并且隨著在養殖過程中不斷完善繁殖和養殖技術,90年代末開始鮰魚養殖并已經初具規模。
2000年以后中國斑點叉尾鮰開始出口美國,隨著2003年越南鲇魚被美國定為傾銷,美國的斑點叉尾鮰消費市場出現了較大缺口,中國的斑點叉尾鮰產品開始進入美國市場,并且出口量持續增長。但從2006年開始,美國對中國的鮰魚產品實施了貿易壁壘,阿拉巴馬州、密西西比州、路易斯安那州等美國本土鮰魚主產區先后禁止中國鮰魚產品入境。2007年美國FDA和FSIS要求對中國輸美斑點叉尾鮰實施DNA檢測及備案。自此中國鮰魚對美出口受到極大限制,出口量大幅下降,回落到5914t,出口美國鮰魚產品銳減50%以上。
常規的形態學鑒定方法并不適合斑點叉尾鮰加工產品的鑒定,為進一步提高斑點叉尾鮰鑒定能力,以應對國外貿易壁壘,以及預防和消除商業中的斑點叉尾鮰產品的摻假,該研究通過設計特異性引物進行PCR擴增,建立了斑點叉尾鮰分子生物學鑒定方法,大大提高了斑點叉尾鮰及其制品的鑒定能力。
1 材料與方法
1.1 材料
1.1.1 樣品來源
該實驗中所用到的實驗材料,斑點叉尾鮰、革胡子鯰、南方大口鯰、長絲巨鲇、鯉、紅錦鯉、鱔、黃顙魚、鱖、草魚、鯽均從農貿市場、超市和網絡平臺購買。
1.1.2 主要試劑
廣譜型基因組DNA小量純化試劑盒購自寶生物工程(大連)有限公司;2×Taq PCR Mastermix購自天根生化科技(北京)有限公司、KAPA PROBE FAST qPCR Master Mix(2×)Universal購自西格瑪奧德里奇(上海)貿易有限公司;引物與探針由武漢天一輝遠生物科技有限公司合成。
1.1.3 儀器設備
qubit4.0熒光定量儀(Thermo Fisher, 美國);Veriti PCR儀(Thermo Fisher,美國),QuantStudio 7 Flex實時熒光定量PCR系統(Thermo Fisher, 美國);5417R型高速離心機(Eppendorf, 德國)。
1.2 實驗方法
1.2.1 引物設計
根據Gen Bank數據庫中已公布的斑點叉尾鮰基因序列,使用 Clustal X 軟件進行序列比對,篩選出種屬相關的特異性保守序列,利用Primer3Plus設計特異性PCR引物和探針,引物和探針序列見表1。
1.2.2 DNA提取
所有動物樣品參照廣譜型基因組DNA小量純化試劑盒中的操作說明提取DNA,用qubit4.0熒光定量儀檢測DNA濃度及純度。提取的DNA置于-20℃保存。
1.2.3 標準質粒的構建
根據Gen Bank數據庫中已公布的斑點叉尾鮰基因保守序列,進行PCR擴增,將擴增獲得的基因序列克隆至pUC57載體,構建標準重組質pUC57-PI。根據以下公式計算重組質粒拷貝數:拷貝數(copies/μL)=6.02×1023×。
1.2.4 PCR方法的建立
普通PCR擴增體系和反應條件如下:2×Taq PCR Mastermix 12.5μL,引物(10μm)各1μL,模板2μL,dd H2O補足至25μL;95℃預變性5mins,然后35個循環為95℃變性30s,60℃退火40s,72℃延伸45s,最后72 ℃延伸5mins。實時熒光PCR擴增體系和反應條件如下:KAPA PROBE FAST qPCR Master Mix(2×)Universal 12.5μL,引物(10μm)各1μL,探針0.51μL,模板2μg,dd H2O補足至25μL;95℃預變性5mins,然后40個循環為95℃變性10s,60℃退火40s。
1.2.5 特異性驗證
為了驗證本實驗方法的特異性,分別使用斑點叉尾鮰、革胡子鯰、南方大口鯰、長絲巨鲇、鯉、紅錦鯉、鱔、黃顙魚、鱖、草魚、鯽的基因組DNA作為模板進行PCR擴增反應,分析引物的特異性。
1.2.6 靈敏度驗證
將質粒標準品 DNA 從起始39.5μg/mL開始進行 10 倍比稀釋,選擇 8 個梯度進行靈敏度實驗,以無菌ddH2O為空白對照,進行PCR擴增,分析檢測的絕對靈敏度,每個反應設置 3 個平行。
2 結果與分析
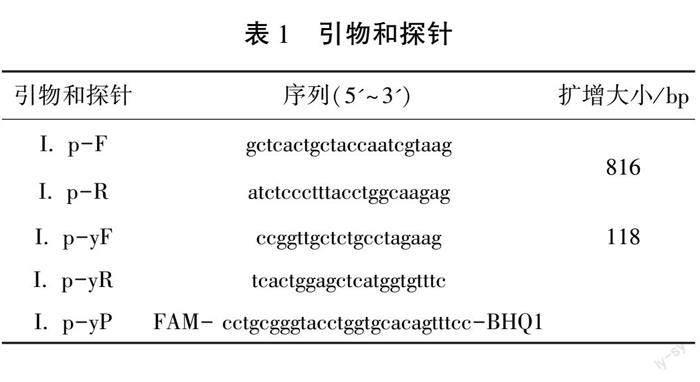
2.1 特異性分析
由圖1可知, 除斑點叉尾鮰有明顯的擴增曲線外,其他物種均為陰性結果,表明所設計引物和探針均具有很好的特異性。
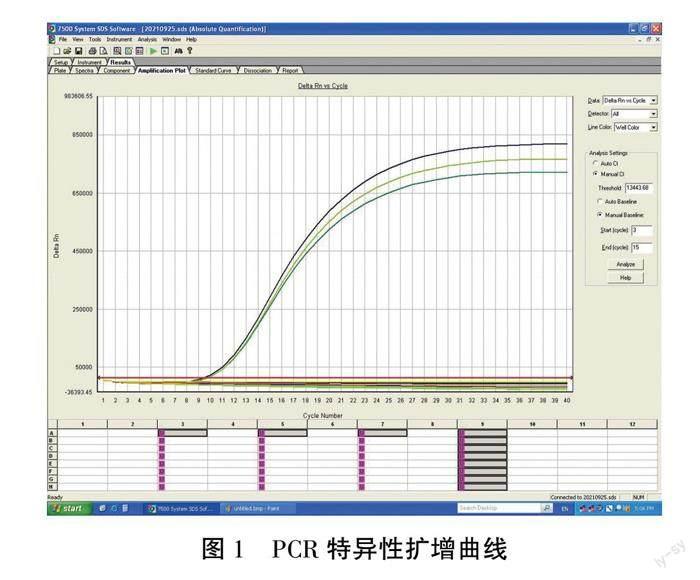
2.2 熒光PCR靈敏性分析
隨著模板拷貝數的降低,擴增曲線起飛時間逐漸下降,見圖2,當應質粒DNA拷貝數濃度為6.0×101copies/μL時,仍有明顯的擴增曲線出現,表明該檢測方法的靈敏度可以達到6.0×101copies/μL,相對常規PCR靈敏度提高了3個數量級,如圖3。
2.3 實時熒光PCR檢測方法的應用
對實驗室收集以及市場購買的20份樣品進行實時熒光PCR檢測, 結果顯示,實時熒光 PCR檢測方法從20份測試樣品中檢出3份陽性,實時熒光PCR 檢測方法與常規PCR的檢測結果完全一致,表明建立的斑點叉尾鮰實時熒光PCR檢測方法準確可靠且更快速。
3 討論
2003年越南鲇魚被美國封殺后,曾經借道中國,以中國斑點叉尾鮰的標簽轉道繼續再次進入美國市場,且隨著中國出口斑點叉尾鮰數量的急劇增長,對美國本土鮰魚養殖和加工業形成了巨大的生存壓力。從2007年下半年開始,美國FDA在對中國輸美斑點叉尾鮰在實施批批扣檢的基礎上,要求對產品實施DNA檢測,以驗證加工原料是否為從美國引進的原種斑點叉尾鮰魚,以杜絕越南鲇魚(巴沙魚)借道中國出口至美國,而美國FSIS則對斑點叉尾鮰以及其產品進行強制性的DNA備案,供查驗。除此以外,市場上龍利魚、巴沙魚和斑點叉尾鮰均以魚片的產品形式進行銷售,其產品在形態上相互都難以區分,市場上以巴沙魚冒充斑點叉尾鮰,或以巴沙魚和斑點叉尾鮰冒充龍利魚牟取暴利的情況也層出不窮。這種違法行為不僅逃避稅收,損害國家利益,而且破壞了水產品貿易的公平性,也損害了消費者的合法權益,甚至帶來食品安全問題。
該研究基于斑點叉尾鮰基因組特異保守序列設計特異性引物和探針,建立了斑點叉尾鮰熒光PCR源性成分分析檢測的方法。試驗證實,斑點叉尾鮰的引物和探針的特異性良好,熒光PCR的最低檢測量達到6.0×101copies/μL,相對常規PCR靈敏度提高了3個數量級。該方法特異性強、靈敏度高,為水產食品企業實現產品質量把控提供了有效方法,為監管部門對水產食品行業進行監督管理提供了科學依據。
參考文獻:
尹恒.2018年湖北省水產品市場綜述和2019年市場走勢分析.湖北農業科學,2019,58(4):160-161.
鐘立強,王明華,陳校輝,等.世界斑點叉尾鮰產業近況Ⅱ:中國斑點叉尾鮰產業發展與展望.水產養殖,2018,39(9):7-11.
吳湘生.2007年中國輸美水產品貿易爭端評述.內陸水產,2007(10):18-20+44.
肖友紅.中國鮰魚產業如何應對美國新政.中國水產,2010(7):27-28+56.
PCR identification method for Italurus punetaus
ZHENG Jian, ZENG Xiandong, ZHOU Xuan, WANG Zhemin, ZOU Caijuan
(Wuhan Customs Technology Center, Wuhan? 430050, Hubei China)
Abstract:This experiment was conducted to establish a rapid real-time fluorescent PCR identification method based on specific conserved gene sequences of Italurus punetaus with specific real-time fluorescent PCR primers and probes, followed by validation of the specificity and sensitivity of the PCR reactions. The results showed that the established real-time fluorescence PCR method is simple, rapid and sensitive, with a sensitivity of 6.07×101copies/μL, which is of great application and provides a scientific basis for the identification of the origin of meat products of the relevant fish species. It can also be widely used in the fields of aquatic inspection and food hygiene testing.
Keywords:Italurus punetaus; PCR; Component identification

