基于生物信息學與實驗驗證探討涼膈散通過GSK-3β調控內毒素致急性肺損傷分子機制
譚煒富 ,晏麗君 ,楊麗玲, ,余景滔 ,盧子濱 ,周湘君 ,楊廣麗 ,李薇 ,余林中
1.暨南大學附屬東莞醫院,廣東 東莞 523900;2.南方醫科大學中醫藥學院國家中醫藥管理局科研三級實驗室中藥藥理實驗室,廣東 廣州 510515;3.廣東醫科大學廣東天然藥物研究與開發重點實驗室,廣東 東莞 523808
急性肺損傷(acute lung injury,ALI)是一種以急性低氧性呼吸衰竭、肺泡通透性增加和嚴重肺泡水腫為病理表現的呼吸道急癥,可進一步發展為急性呼吸窘迫綜合征(ARDS)。據報道,美國ARDS年發病率為78.9/10萬例,病死率為40%[1]。上海的ICU監護數據顯示,15歲以上患者ARDS發病率為2%,病死率為70%[2]。中國臺灣ARDS年患病率由1997年的2.53/10萬例增加到2011年的19.26/10萬例[3]。ALI的原因包括敗血癥、肺炎、多發創傷、溺水、胃內容物誤吸、肺挫傷、藥物作用和休克等[4],其基本病理機制是炎癥反應失控,涉及PI3K/Akt、TLR4/NF-κB、AMPK-Nrf2等多條信號通路[5-7]。目前,ALI 尚無有效治療策略[8]。中醫藥調控炎癥反應具有優勢與特色,在膿毒癥、甲型流感、嚴重急性呼吸綜合征及新型冠狀病毒感染的治療中備受關注,對相關方藥的作用與機制研究已成為當前關注的熱點。
涼膈散出自《太平惠民和劑局方》,由黃芩、連翹、梔子、薄荷、大黃、芒硝、淡竹葉和甘草組成。相關臨床研究[9-10]及本團隊前期實驗研究[11-12]均表明,以涼膈散作為主方治療嚴重感染致ALI療效確切,但其作用機制尚未完全闡明。前期網絡藥理學分析顯示,涼膈散的作用靶點主要富集于PI3K/Akt通路[13]。基于此,本研究通過生物信息學方法從所富集的PI3K/Akt通路進一步識別涼膈散治療ALI的關鍵作用靶分子,并通過建立ALI小鼠模型進行驗證,為涼膈散防治ALI的臨床應用與開發提供依據。
1 材料與方法
1.1 涼膈散-PI3K/Akt通路相關急性肺損傷疾病基因分析
檢索GEO數據庫(https://www.ncbi.nlm.nih.gov/geo/)建庫至2022年11月1日收錄的ALI基因表達譜芯片: ①疾病為“Acute lung injury”“Sepsisassociated acute lung injury”“Sepsis-associated acute respiratory distress syndrome”;②組織來源為血液;③條目類型為“Sereies”;④研究類型為“Expression profiling by array”;⑤Top Organisms 選擇“Homo sapiens”;⑥樣本集包含疾病組與對照組。通過R語言ComBat包去除批次效應后,用limma包進行差異表達分析,篩選P<0.05且|logFC|>0.2的疾病基因,為ALI特征表達基因。
通過TCMSP(https://www.tcmsp-e.com/)和中醫藥整合藥理學研究平臺(TCMIP,http://www.tcmip.cn/)檢索涼膈散組方藥物大黃、連翹、黃芩、甘草、梔子、薄荷、芒硝、淡竹葉的化學成分,以口服生物利用度(OB)≥30%且類藥性(DL)≥0.18為條件篩選活性成分,并提取其作用靶點。通過KEGG(https://www.kegg.jp/)檢索“PI3K-Akt”通路,提取通路相關基因。
將ALI 疾病特征表達基因、涼膈散潛在靶點及PI3K/Akt通路相關基因取交集,得到涼膈散-PI3K/Akt通路相關ALI疾病基因,通過R語言Venn包生成交集圖。提取矯正后交集基因的表達量數據,采用RevMan5.3進行單基因Meta分析并繪制森林圖。
1.2 實驗驗證
1.2.1 動物、試藥與儀器
清潔級雄性BALB/c小鼠,5~6周齡,體質量18~22 g,購自南方醫科大學實驗動物中心,動物生產許可證號SCXK(粵)2021-0041,動物使用許可證號SYXK(粵)2021-0167。飼養于SPF級實驗室,溫度22~26 ℃,濕度40%~70%,12 h/12 h晝夜循環,每籠4只,自由飲水進食。本實驗經南方醫科大學實驗動物福利與倫理委員會批準(L2021064),根據實驗動物護理和使用指南進行操作。
中藥飲片黃芩(批號211002401)、連翹(批號211201101)、梔子(批號211002521)、薄荷(批號211000191)、大黃(批號211100199)、芒硝(批號210902001)、甘草(210902241)、淡竹葉(批號211003072),廣東康美藥業有限公司(中國廣州);TRIzol(批號15596018),Invitrogen 公司;TWS119(批號M2304)、Wortmannin(批號M2053),Abmole公司;PrimeScript Tyragent Kit with gDNA Eraser(批號AL62453A)、SYBR?Premix Ex TaqTMⅡ(批號ALE2949A),日本Takara公司;3-(4,5-二甲基噻唑-2-yl)-2,5-二苯基四溴化銨(MTT,批號M5655)、脂多糖(大腸桿菌055:B5,批號110M4086V),Sigma-Aldrich公司;胎牛血清(批號2166451)、高糖培養基(批號8118328)、青霉素/鏈霉素(批號R001100、15070-054),GIBCO公司;小鼠輔助性T細胞(Th17,批號KTH217)、調節性T細胞(Treg,批號KTR201)檢測試劑盒、紅細胞裂解溶液(批號LSC01、LSC02),杭州聯科生物技術股份有限公司;小鼠白細胞介素-17(IL-17)ELISA試劑盒(批號CSB-E12819h)、轉化生長因子-β(TGF-β)ELISA 試劑盒(批號CSBE04725h),武漢華美生物工程股份有限公司。
N-1200B型旋轉蒸發儀(海門市其林貝爾儀器制造有限公司),DGX-9243BC-1型冷凍干燥器(中國上海福瑪實驗設備有限公司),YP10002型分析天平(上海佑科儀器儀表有限公司),BA 110S 型電子天平(Sartorius公司),QL-901型渦旋振蕩器(海門市其林貝爾儀器制造有限公司),Thermo FC 型酶標儀(Thermo Fisher Scientific公司),CytoFLEX型流式細胞儀(Beckman Coulter公司),DS-11+型超微量分光光度計(Denovix公司),LightCycler?96型實時PCR系統(Roche公司)。
1.2.2 實驗方法
1.2.2.1 涼膈散藥液制備
按涼膈散原方比例稱取連翹24 g、梔子6 g、黃芩6 g、甘草12 g,加10倍體積蒸餾水浸泡30 min后加熱,煮沸20 min,然后加入大黃12 g、薄荷6 g、淡竹葉6 g,繼續煎煮,煮沸10 min后倒出煎煮液;向藥渣中加入6倍體積蒸餾水繼續煮沸10 min,合并2次煎液后3層紗布過濾,趁熱加入芒硝12 g,攪拌溶解后用3層濾紙抽濾得到藥液。用旋轉蒸發儀蒸發濃縮至稠液后,冷凍干燥12 h使其形成干粉。準確稱取干粉,溶于PBS中,配制成20 mg/mL藥液,渦旋振蕩器上渦旋,微孔濾膜過濾除菌,-20 ℃冰箱保存備用。
1.2.2.2 分組、給藥及取材
小鼠適應性飼養1周后,隨機分為空白組、模型組、涼膈散組、TWS119組、涼膈散+Wortmannin組,每組8只。涼膈散組予涼膈散藥液(60 g/kg)灌胃,每日分早晚2次;TWS119組予GSK-3β抑制劑TWS119(50 mg/kg)腹腔注射,每日1次;涼膈散+Wortmannin組予涼膈散藥液(60 g/kg)灌胃,每日分早晚2次,以及GSK-3β激動劑Wortmannin(0.7 mg/kg)腹腔注射,每日1次;空白組和模型組予等量生理鹽水灌胃或腹腔注射。連續給藥7 d后,除空白組外,各組小鼠氣管滴注脂多糖(3 mg/kg)建立ALI模型,空白組小鼠氣管滴注等量生理鹽水。12 h后,各組小鼠用1.5%(W/V)戊巴比妥鈉溶液麻醉后心臟采血,脫頸處死,分離氣管,打開胸腔,采集肺組織。
1.2.2.3 指標檢測
取新鮮肺組織,稱取濕重(W),于烤箱60 ℃烘干至質量不再改變,稱取干重(D),計算肺濕/干重比值(W/D),評估肺水腫程度。
使用肝素鈉抗凝管收集血液,檢測全血Th17、Treg細胞含量。Th17細胞抗體標記為FITC-抗CD4和PE-抗IL-17A,CD4+IL-17+為Th17細胞;Treg細胞抗體標記為PE-抗CD25和APC-抗Foxp3,CD25+Foxp3+為Treg細胞,按試劑盒說明書步驟處理后,采用流式細胞儀進行檢測。
取小鼠肺組織,用眼科剪刀剪碎,組織勻漿后,2 000 r/min離心10 min,取上清液,采用ELISA試劑盒檢測IL-17、TGF-β含量。
取小鼠肺組織,用眼科剪刀剪碎,組織勻漿后,使用miRcute miRNA試劑盒提取總RNA后,采用超微量分光光度計檢測RNA 的質量和濃度。使用PrimeScriptTMRT reagent Kit with gDNA Eraser試劑盒反轉錄RNA 后,采用SYBR?Premix Ex TaqTMⅡ(Tli RNaseH Plus)檢測GSK-3β表達水平,以β-actin為內參,采用2-ΔΔCt法計算基因相對表達量。所用引物由華大基因公司提供,序列信息見表1。

表1 基因PCR引物序列
1.3 統計學方法
采用SPSS20.0統計軟件進行分析。采用標準化均數差(SMD)作為合并統計量進行單基因Meta分析,分析前進行異質性檢驗,不存在異質性(P≥0.1,I2=0%)采用固定效應模型分析數據,存在異質性(P<0.1,I2>0%)采用隨機效應模型。計量資料用±s表示。采用方差分析評估多組間差異,事后檢驗采用圖基(Tukey)檢驗法。P<0.05表示差異有統計學意義。
2 結果
2.1 涼膈散-PI3K/Akt通路相關ALI疾病基因篩選及單基因Meta分析
從GEO 數據庫得到3 個基因表達芯片數據集GSE10474、GSE2322和GSE32707,獲得189份樣品(包括50例ALI/ARDS患者和139例膿毒癥患者對照),行批次處理后樣本間批次效應被消除,進行基因表達差異分析,篩選出764個ALI疾病特征表達基因(見圖1A~圖1C)。通過TCMSP和TCMIP數據庫收集到涼膈散組方藥物候選活性化合物274個,其中來源于大黃81個、連翹23個、黃芩36個、甘草92個、梔子15個、薄荷22個、芒硝1個、淡竹葉4個,刪除重復成分并提取其相應靶點共330 個。通過KEGG 檢索提取PI3K/Akt通路(ID:HSA04151)相關基因354個。將764個ALI特征表達基因、330個涼膈散作用靶點及354個PI3K/Akt通路相關基因取交集,得到涼膈散-PI3K/Akt 通路相關ALI 疾病基因4 個,分別為GSK3β、CDKN1A、NFKB1和MCL1(見圖1D),多表達數據集差異分析結果見表2。單基因Meta 分析發現,CDKN1A、MCL1和GSK3β這3個基因表達差異有統計學意義(P<0.05),見圖2。其中,CDKN1A基因在ALI患者體內低表達(SMD=-0.80,P<0.001),MCL1基因在ALI 患者體內高表達(SMD=0.41,P=0.02),GSK3β基因在ALI患者體內高表達(SMD=0.66,P<0.001)。前期研究表明,涼膈散中多個有效成分與GSK-3β對接良好[12],故選擇GSK-3β為作用靶點進行后續實驗驗證。
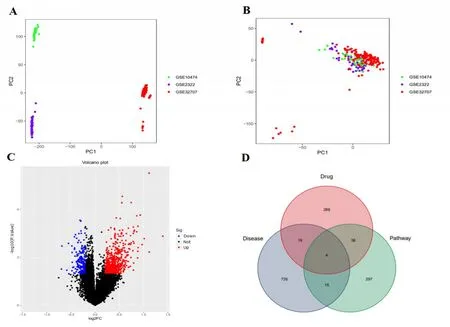
圖1 涼膈散-PI3K/Akt通路相關ALI疾病基因的生物信息學篩選
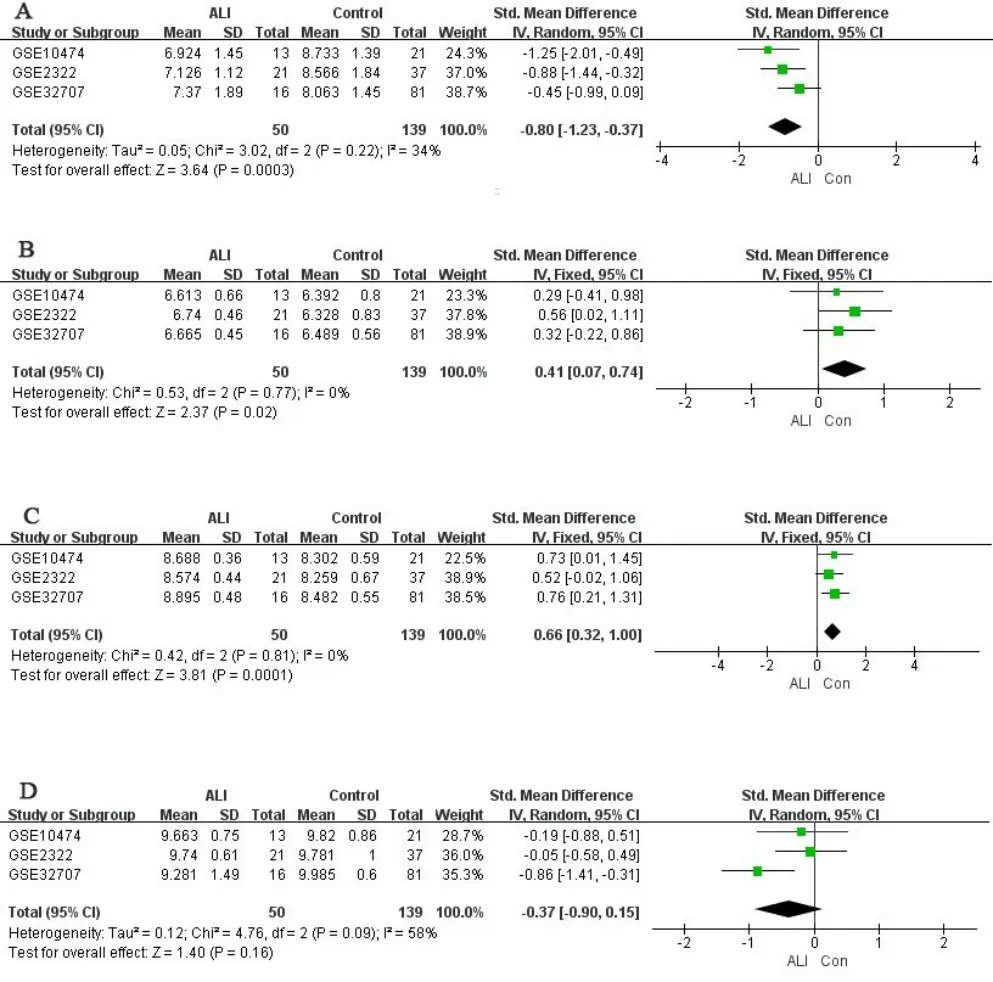
圖2 涼膈散-PI3K/Akt通路相關ALI疾病基因Meta分析森林圖
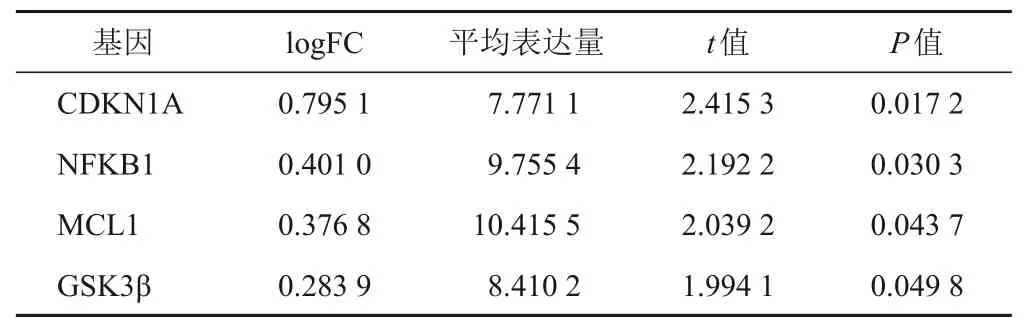
表2 涼膈散-PIK3/Akt通路相關ALI疾病基因多表達數據集差異分析
2.2 實驗驗證結果
2.2.1 涼膈散通過抑制GSK-3β表達降低急性肺損傷小鼠肺濕/干重比值
涼膈散能顯著降低ALI小鼠肺W/D比值,減輕肺水腫;TWS119與涼膈散作用相似;加入Wortmannin處理后,小鼠肺W/D比值升高,提示Wortmannin可拮抗涼膈散降低肺組織毛細血管通透性以減輕肺水腫的作用。見圖3a。與空白組比較,模型組小鼠肺組織GSK-3β基因表達顯著升高,涼膈散或TWS119能顯著下調ALI小鼠GSK-3β基因表達,但Wortmannin處理可拮抗涼膈散對GSK-3β的下調作用。見圖3b。
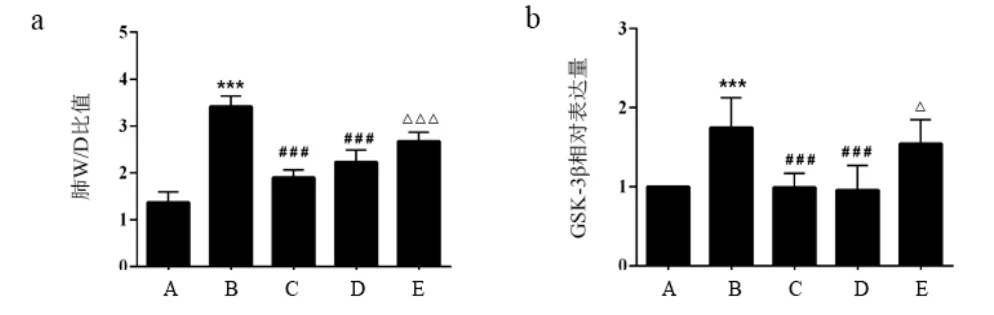
圖3 各組小鼠肺W/D比值及肺組織GSK-3β表達比較(±s,每組8只)
2.2.2 涼膈散改善急性肺損傷小鼠Th17/Treg失衡
涼膈散和TWS119均能顯著降低ALI小鼠外周血Th17細胞比例和Th17/Treg比值,提高Treg細胞比例,表明涼膈散可改善Th17/Treg 比例失衡。加入Wortmannin處理后,Treg細胞比例顯著降低,Th17/Treg比值顯著升高,表明Wortmannin可抵消涼膈散改善Th17/Treg失衡的作用。見圖4。
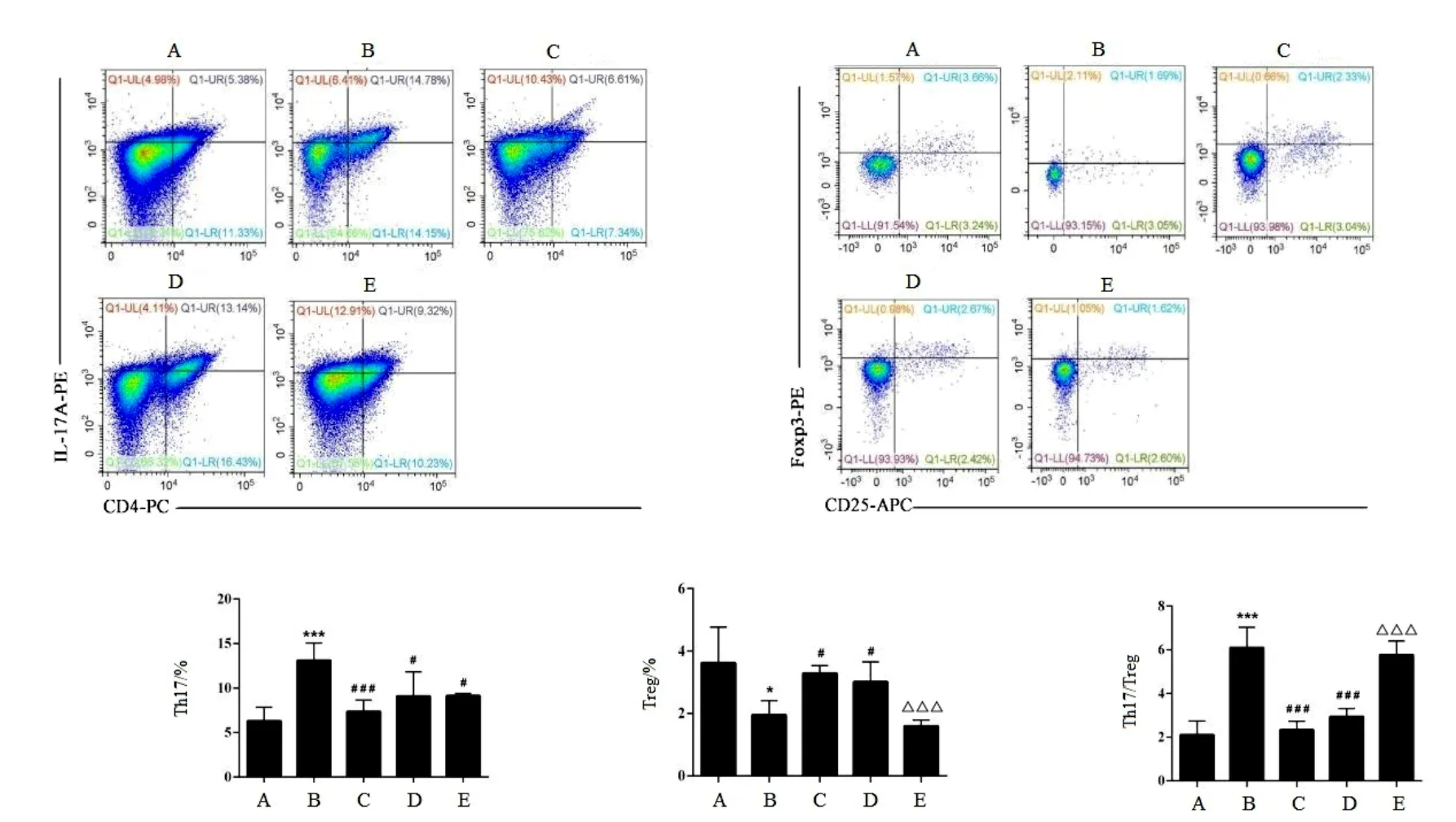
圖4 各組小鼠外周血Th17、Treg細胞比例及Th7/Treg比值比較(±s,每組8只)
2.2.3 涼膈散降低急性肺損傷小鼠細胞因子含量
與空白組比較,模型組IL-17A 含量顯著升高,TGF-β含量下降。涼膈散和TWS119均能顯著升高ALI小鼠肺組織TGF-β含量,且涼膈散能顯著降低ALI小鼠IL-17A 含量。Wortmannin 處理可抑制涼膈散對IL-17A的下調及對TGF-β的上調作用。見圖5。
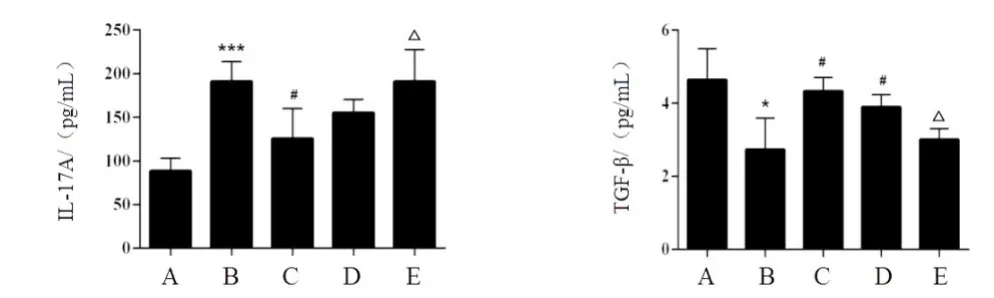
圖5 各組小鼠肺組織IL-17A、TGF-β含量比較(±s,每組8只)
3 討論
ALI/ARDS是危及生命的急重癥,由于無特效藥,病死率居高不下,成為重癥醫學難點[1,14]。臨床研究表明,以涼膈散為主方治療因嚴重感染及炎癥反應失控所致的ALI具有確切療效,本團隊前期研究發現,涼膈散通過抑制NF-κB、p38MAPK等信號通路降低脂多糖溫熱病家兔血漿腫瘤壞死因子(TNF)-α水平,抑制內毒素血癥小鼠炎癥因子TNF-α及IL-6表達,下調小鼠巨噬細胞CD14表達,減輕肺組織損傷,提示涼膈散可在血液、肺等多部位、多靶點、多機制發揮治療作用[10,15-17]。研究表明,PI3K/Akt 信號通路參與ALI/ARDS的發生發展過程[18]。本團隊近期研究發現,涼膈散作用靶點主要富集于PI3K/Akt通路[11,13-14]。本研究利用基因表達譜芯片、單基因Meta分析進一步預測涼膈散的具體作用靶點,并通過動物實驗進行驗證。
網絡藥理學結合基因表達譜芯片分析顯示,在PI3K/Akt通路相關的ALI疾病特征基因中,GSK3β、CDKN1A、NFKB1和MCL1可受涼膈散調節。研究表明,GSK-3β 作為炎癥反應的中樞激酶,是NF-κB、p38等多條炎癥信號通路的共同靶分子,GSK-3β的激活是協同放大炎癥級聯反應、推動ALI向ARDS進展的關鍵性因素。而CDKN1A則通過p53/p21途徑參與抵抗肺泡上皮凋亡[19]。研究表明,MCL1影響ALI的疾病進程,下調MCL1水平可促使ALI小鼠中性粒細胞凋亡及巨噬細胞清除凋亡細胞,從而加速肺部炎癥的緩解[20]。對上述4個基因進行單基因Meta分析以進一步篩選最佳靶點,結果發現,GSK-3β在ALI中表達顯著上調,推測涼膈散可能通過抑制GSK-3β表達而發揮抗ALI作用。
GSK-3β是一種絲氨酸蘇氨酸蛋白激酶,廣泛存在于真核生物細胞內,可調控多種生理病理功能,如糖原合成,細胞分化、增殖、死亡等。GSK-3β在肺部不僅可與TRIB3相互作用促進炎癥纖維化,還可調控血液中T細胞的遷移運動[21]。近年研究發現,GSK-3β參與調控機體的獲得性免疫:生理狀態下,Th17細胞及Treg細胞在體內處于動態平衡,激活GSK-3β可促進CD4+T細胞向Th17細胞亞型分化、減少Treg細胞亞型分化,抑制Treg細胞活性,進而影響Th17/Treg平衡。Th17/Treg保持平衡則內環境穩定,反之內環境失衡,免疫功能紊亂,炎癥反應失控,釋放過量炎癥因子導致肺泡毛細血管膜損傷、通透性增加,最終造成肺水腫、損傷[22-24]。
GSK-3β抑制劑在治療ALI/ARDS中表現出顯著抗炎作用,可通過抑制小鼠炎癥細胞浸潤和降低促炎癥細胞因子水平而減輕肺部急性炎癥損傷[25]。TWS119是一種GSK-3β抑制劑,可通過抑制GSK-3β的磷酸化而影響機體某些免疫細胞的增殖、分化和控制炎癥發展[26-27]。盡管目前尚無針對GSK-3β的特異性激活劑,但是可通過影響其他途徑而激活GSK-3β。Wortmannin是PI3K抑制劑,因其阻斷了MAPK和p90 S6激酶的級聯反應過程而保護GSK-3β的活性不受抑制[28]。本研究利用脂多糖誘導小鼠ALI發現,模型組肺水腫明顯,GSK-3β基因表達顯著升高,經涼膈散或TWS119治療后小鼠肺水腫顯著減輕,GSK-3β基因表達下調,但Wortmannin可逆轉涼膈散的上述作用,表明涼膈散可能通過GSK-3β抑制劑形式發揮抗ALI作用。
本研究發現,模型組小鼠外周血Th17細胞比例、Thl7/Treg比值明顯升高,Treg細胞明顯減少,提示存在Th17/Treg 失衡。涼膈散或TWS119 能明顯下調Th17細胞比例和Th17/Treg比值,增加Treg細胞比例,促使Th17/Treg 平衡從Th17 向Treg 側偏移。但Wortmannin可部分逆轉涼膈散改善Th17/Treg失衡作用,提示涼膈散具有類似GSK-3β抑制劑的效應,可以調控Th17/Treg平衡。
相關研究表明,Th17細胞主要分泌促炎細胞因子IL-17A,誘導炎癥反應或自身免疫性疾病,Treg細胞則主要分泌抗炎細胞因子TGF-β,以維持機體免疫穩態[29]。本研究ELISA結果顯示,涼膈散或TWS119能明顯下調IL-17A水平,上調TGF-β水平,Wortmannin可逆轉涼膈散的上述作用,表明涼膈散可通過抑制GSK-3β表達調節IL-17A、TGF-β水平,從而發揮治療ALI作用。
綜上所述,本研究通過生物信息學分析預測GSK-3β是涼膈散治療ALI的關鍵作用靶點,并通過小鼠模型驗證了涼膈散可通過抑制GSK-3β表達調控Th17/Treg平衡,調節IL-17A、TGF-β分泌,進而發揮抗ALI的作用。可為中藥防治ALI作用機理研究提供新思路,亦為涼膈散的臨床應用提供依據。

