吳茱萸堿對小鼠肝纖維化的影響
孫建超,張 藝,張娜佳,婁方方
1.貴州省臨床檢驗中心,貴州貴陽 550002;2.貴州醫科大學,貴州貴陽 550002;3.貴州省人民醫院檢驗科,貴州貴陽 550002
肝纖維化是病理損傷、病毒性肝炎、非酒精性脂肪肝、酒精性肝炎等眾多疾病的共同病理過程,遺傳性新陳代謝失調、藥物損傷、膽汁淤積性疾病、免疫功能失調等均可導致肝纖維化[1]。因此,肝纖維化是對急、慢性肝損傷的創傷應答反應,該反應幾乎是所有終末期肝病及其并發癥的基礎,包括門靜脈高壓、腹水、肝性腦病、合成功能障礙和代謝能力受損等,長期的肝臟損傷導致細胞外基質(ECM)增生、肝纖維化形成[2]。研究表明,肝纖維化是可逆的肝臟損傷過程[3],及時有效的干預可阻止肝臟向肝硬化或肝癌進展。因此,研究肝纖維化的發病機制及有效的干預措施對肝纖維化的防治具有重要的臨床意義。
1 材料與方法
1.1實驗動物 32只C57BL/6J小鼠均購自貴州醫科大學動物實驗中心,SPF級實驗室飼養,按照隨機數字表法分為對照組、模型組、吳茱萸堿低劑量組、吳茱萸堿高劑量組,每組8只,自由飲水,普通飲食。
1.2主要試劑 吳茱萸堿;丙二醛(MDA)試劑盒(南京建成生物工程研究所有限公司);3型膠原蛋白(Col-Ⅲ)單克隆抗體(美國Abcam公司);α-平滑肌肌動蛋白(α-SMA) 單克隆抗體(美國Abcam公司);細胞基質金屬蛋白酶-9(MMP-9)單克隆抗體(美國Abcam公司);增殖細胞核抗原(PCNA)單克隆抗體(美國Abcam公司);BCA蛋白定量試劑盒 (南京巴傲得生物科技有限公司);增強型化學發光(ECL)試劑(德國 Millipore公司)。
1.3方法
1.3.1小鼠肝纖維化造模流程 參考文獻[4],采用10% 四氯化碳(CCL4)在模型組、吳茱萸堿低劑量組、吳茱萸堿高劑量組中復制小鼠肝纖維化模型;橄欖油∶CCL4=9∶1配制10% CCL4混合溶劑;吳茱萸堿的溶劑為吐溫,配制吐溫∶二甲基亞砜(DMSO)∶生理鹽水=1∶1∶18的混合溶劑;每周1、3、5按0.5 mL/kg的劑量經腹腔注射10% CCL4,每周小鼠稱重,調整藥物劑量,重復12周。造模過程中,吳茱萸堿低劑量組給予吳茱萸堿溶液20 mg/(kg·d),吳茱萸堿高劑量組給予吳茱萸堿溶液25 mg/(kg·d)進行灌胃干預。模型組和對照組只注射10% CCL4混合溶劑。
1.3.2小鼠血清丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)水平檢測 小鼠摘眼球采集血液標本,以3 000 r/min離心10 min分離血清。ALT、AST均采用SiemensAdvia 1650全自動生化分析儀按試劑盒說明書要求進行檢測。
1.3.3小鼠肝組織MDA水平檢測 取小鼠肝組織,制備肝組織勻漿,采用硫代巴比妥酸法檢測MDA水平,嚴格按照試劑盒說明書要求操作。
1.3.4免疫組化法檢測 肝組織切片經脫蠟、抗原修復、封閉、一抗孵育、二抗孵育、顯色后,每張切片隨機選取5個低倍視野(×100),采用免疫組化法檢測Col-Ⅲ、α-SMA表達情況。
1.3.5PCNA蛋白、MMP-9水平檢測 取小鼠肝組織,制備肝組織勻漿,采用免疫印跡法按試劑盒說明書提取蛋白并定量。取20 μg蛋白,變性處理后進行聚丙烯酰胺(SDS-PAGE)凝膠電泳,轉PVDF膜,一抗PCNA(1∶1 000)、MMP-9(1∶5 000),4 ℃孵育過夜。二抗(1∶20 000)室溫孵育1 h,TBST緩沖液清洗后暗室內ECL試劑顯色、曝光。通過Image J軟件進行灰度分析。
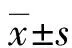
2 結 果
2.1各組小鼠血清ALT、AST水平比較 與模型組比較,吳茱萸堿低劑量組、吳茱萸堿高劑量組小鼠血清ALT、AST水平明顯降低,差異有統計學意義(P<0.05)。見表1。

表1 各組小鼠血清ALT、AST水平
2.2各組小鼠肝組織MDA水平比較 對照組、模型組、吳茱萸堿低劑量組、吳茱萸堿高劑量組MDA水平分別為(0.857±0.044)、(1.394±0.047)、(0.993±0.021)、(0.911±0.03)nmoL/mg,與模型組比較,吳茱萸堿低劑量組、吳茱萸堿高劑量組小鼠肝組織MDA水平均明顯降低,差異有統計學意義(P<0.05)。
2.3各組小鼠肝組織免疫組化法檢測結果 對照組小鼠肝組織中Col-Ⅲ可見于匯管區和中央脈管壁表達,但量極少,染色較淡;模型組Col-Ⅲ表達廣泛,呈彌漫性,主要表達在中央靜脈周圍及纖維組織增生的匯管區的纖維間隔、肝竇壁、血管內皮細胞和膽管上皮細胞細胞質,形成寬而粗大的纖維條索。吳茱萸堿低劑量組、吳茱萸堿高劑量組Col-Ⅲ陽性表達部位與模型組一致,但表達面積和強度有所減少和減弱。見圖1。

注:A為對照組;B為模型組;C為吳茱萸堿低劑量組;D為吳茱萸堿高劑量組。
對照組小鼠肝組織中α-SMA僅在肝內動脈、靜脈、膽管壁表達。模型組小鼠α-SMA除在血管壁表達外,主要在纖維間隔及匯管區的成纖維母細胞細胞質處表達明顯,且呈梭形或長橢圓形。吳茱萸堿低劑量組、吳茱萸堿高劑量組α-SMA陽性表達部位與模型組一致,但表達面積和強度有所減少和減弱。見圖2。

注:A為對照組;B為模型組;C為吳茱萸堿低劑量組;D為吳茱萸堿高劑量組。
2.4各組小鼠肝組織免疫印跡法檢測結果 與模型組比較,吳茱萸堿低劑量組、吳茱萸堿高劑量組小鼠肝組織MMP-9表達上調,PCNA蛋白表達下調,差異均有統計學意義(P<0.05)。見圖3、4。

注:A為對照組;B為模型組;C為吳茱萸堿低劑量組;D為吳茱萸堿高劑量組。

注:a為MMP-9表達情況比較;b為PCNA蛋白表達情況比較;A為對照組;B為模型組;C為吳茱萸堿低劑量組;D為吳茱萸堿高劑量組;與模型組比較,*P<0.05。
3 討 論
吳茱萸為《神農本草經》所記載的一味中藥,藥性辛、苦、熱,有小毒。其功效主要為助陽止瀉、散寒止痛、溫中止嘔。吳茱萸堿為吳茱萸主要活性成分之一,有廣泛的藥理活性,對心血管系統[5]、內分泌系統[6]、免疫系統[7]等均有較強的調節作用,表明吳茱萸堿在抗氧化應激損傷方面有重要作用。
肝纖維化是所有慢性肝損傷長期刺激轉歸的必經之路,一旦進入肝硬化階段則難以逆轉。經過大約40年的基礎、轉化和臨床研究的穩步進展,人們對肝硬化和終末期肝病的發病機制有了深入的認識[8]。肝纖維化因其較高的發病率及病死率嚴重威脅人類健康,全球約1億人口受到肝纖維化的影響[9]。肝纖維化的顯著特點為肝組織內大量ECM成分過度增生及異常沉淀[10],其特征是纖維ECM產生和降解不平衡,導致間質膠原及其他基質成分積聚。肝纖維化的發生、發展與機體氧化應激反應緊密相關,機體氧化應激狀態刺激肝星狀細胞(HSC)活化及炎癥細胞與細胞因子、肝巨噬細胞等多種因素,參與肝細胞損傷及肝小葉結構的重構。其中HSC的活化是肝組織內纖維膠原積累的關鍵因素[11],是肝纖維膠原的主要來源。研究表明,α-SMA是HSC活化的重要標志,α-SMA在HSC中表達的強度與HSC的活化程度呈正相關[12]。肝組織中的膠原主要分為Ⅰ、Ⅲ、Ⅳ和Ⅵ型等,其中以Ⅰ型膠原蛋白(Col-Ⅰ)、Col-Ⅲ最多,占肝臟ECM總量的95%以上,因此,Col-Ⅰ、Col-Ⅲ是肝纖維化、肝硬化時ECM的主要成分[13]。本研究中免疫組化法檢測結果顯示,吳茱萸堿低劑量組、吳茱萸堿高劑量組纖維間隔及匯管區的Col-Ⅲ、α-SMA表達面積和強度與模型組比較均有所減少和減弱,表明吳茱萸堿在抑制HSC的活化及抑制肝組織內纖維膠原積累方面有較好的作用。
基質金屬蛋白酶(MMPs)是一類結構相似的鋅依賴性內肽酶家族,MMP-9是MMPs家族的主要成員之一。MMP-9能夠水解膠原蛋白、蛋白聚糖、彈性蛋白及纖連蛋白,通過降解ECM參與許多生物過程,在肝纖維化、腫瘤等多種疾病的發生、發展中有重要作用[14-15]。MMP-9更是為數不多的可以降解Ⅳ型膠原等多種基質膠原的蛋白酶[16]。國內外諸多文獻報道了MMP-9與肝纖維化發生、發展的關系,認為MMP-9可作為肝纖維化程度及肝細胞狀態的可靠評價指標[17-19]。本研究結果表明,與模型組比較,吳茱萸堿低劑量組、吳茱萸堿高劑量組肝組織中MMP-9表達上調,差異有統計學意義(P<0.05)。王豫萍等[20]研究發現藍莓果漿在豬血清誘導大鼠免疫性肝纖維化損傷中可增加肝組織MMP-9表達。因此,MMP-9在降解ECM進而抑制肝纖維化中起重要作用,可能與吳茱萸堿的防護肝纖維化、水解ECM、防止肝組織內纖維膠原積累的功能有關。
肝纖維化是伴隨著肝細胞的不斷損傷與修復的過程。DONATO等[21-22]研究了慢性肝炎和肝硬化患者的肝臟組織標本PCNA蛋白表達水平,發現其能反映慢性病毒性肝炎患者的肝細胞增殖率,與肝病的嚴重性相關。胡沛臻等[23]研究表明,在慢性肝炎、肝細胞不典型增生、肝細胞肝癌中,病情嚴重程度與PCNA蛋白表達量增加相關,即PCNA蛋白的表達水平與組織的分化程度呈負相關。本研究結果表明,與模型組比較,吳茱萸堿低劑量組、吳茱萸堿高劑量組PCNA蛋白表達下調,差異有統計學意義(P<0.05),可能與吳茱萸堿能抑制肝細胞過度增殖,減輕肝細胞損傷有關。
綜上所述,吳茱萸堿對CCL4誘導小鼠肝纖維化有顯著防護效果,可能與吳茱萸堿抑制肝組織氧化應激反應,同時抑制HSC活化,提高MMP-9表達,降低肝組織周圍Col-Ⅲ水平,同時下調PCNA蛋白表達有關。

