Ndfip1在帕金森病模型小鼠黑質中的表達變化
付小敏 曲仂 徐華敏 謝俊霞
[摘要]目的觀察攜帶人突變型α-突觸核蛋白(A53T)的帕金森病(PD)轉基因小鼠及1-甲基-4-苯基-1,2,3,6-四氫吡啶(MPTP)誘導的PD模型小鼠黑質區Nedd4家族相互作用蛋白1(Ndfip1)的表達變化。方法選取12月齡A53T轉基因小鼠和同窩野生型(WT)對照小鼠,采用免疫印跡技術檢測小鼠黑質區Ndfip1蛋白的表達變化;選取8周齡雄性C57BL/6J小鼠隨機分為2組,MPTP組小鼠連續5 d給予MPTP腹腔注射(30 mg·kg-1·d-1),對照組給予等體積的生理鹽水,采用免疫印跡技術檢測小鼠黑質區Ndfip1及酪氨酸羥化酶(TH)的蛋白表達變化。結果與WT小鼠相比,A53T轉基因小鼠黑質區Ndfip1蛋白的表達降低,差異有統計學意義(t=2.294,P<0.05);與對照組相比,MPTP組小鼠黑質區Ndfip1及TH的蛋白表達均明顯降低,差異有統計學意義(t=2.149、9.935,P<0.05)。結論攜帶人突變型α-突觸核蛋白(A53T)的PD轉基因小鼠及MPTP誘導的PD模型小鼠黑質區Ndfip1蛋白的表達均下降。
[關鍵詞]帕金森病;Nedd4家族相互作用蛋白1;1-甲基-4-苯基-1,2,3,6-四氫吡啶;α突觸核蛋白;黑質;小鼠,近交C57BL
[中圖分類號]R338.2[文獻標志碼]A[文章編號]2096-5532(2023)03-0317-04
doi:10.11712/jms.2096-5532.2023.59.014[開放科學(資源服務)標識碼(OSID)]
[網絡出版]https://kns.cnki.net/kcms/detail/37.1517.R.20230302.1739.007.html;2023-03-0317:03:28
CHANGE IN THE EXPRESSION OF NEDD4 FAMILY-INTERACTING PROTEIN 1 IN THE SUBSTANTIA NIGRA OF A MOUSE MODEL OF PARKINSONS DISEASE? FU Xiaomin, QU Le, XU Huamin, XIE Junxia (Institute of Brain Science and Di-seases, Qingdao University, Qingdao 266071, China)
[ABSTRACT]ObjectiveTo investigate the change in the expression of Nedd4 family-interacting protein 1 (Ndfip1) in the substantia nigra of human mutant α-synuclein (A53T) transgenic mice with Parkinsons disease (PD) or a mouse model of PD induced by 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP).MethodsA53T transgenic mice and wild-type (WT) littermates, aged 12 months, were selected, and Western blotting was used to measure the change in the protein expression of Ndfip1 in the substantia nigra. Male C57BL/6J mice, aged 8 weeks, were randomly divided into MPTP group and control group; the mice in the MPTP group were given intraperitoneal injection of MPTP (30 mg·kg-1·d-1) for 5 consecutive days, and those in the control group were given an equal volume of normal saline; Western blotting was used to measure the changes in the protein expression of Ndfip1 and tyrosine hydroxylase (TH) in the substantia nigra. ResultsCompared with the WT mice, the A53T transgenic mice had a significant reduction in the protein expression of Ndfip1 in the substantia nigra (t=2.294,P<0.05). Compared with the control group, the MPTP group had significant reductions in the protein expression of Ndfip1 and TH in the substantia nigra (t=2.149,9.935;P<0.05). ConclusionThere is a significant reduction in the protein expression of Ndfip1 in the substantia nigra of human mutant α-synuclein (A53T) transgenic mice with PD and a mouse model of MPTP-induced PD.
[KEY WORDS]Parkinson disease; Nedd4 family interacting protein 1; 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine; alpha-synuclein; substantia nigra; mice, inbred C57BL
帕金森病(PD)是一種常見的神經系統退行性疾病,其主要病理特征是中腦黑質多巴胺能神經元的變性,以及α-突觸核蛋白(α-syn)異常聚集所致路易小體的形成[1-3]。臨床上, PD病人常出現明顯的運動遲緩等運動癥狀,以及抑郁、焦慮等非運動癥狀[4-8]。到目前為止,PD的病因仍未完全闡明,有研究表明可能涉及遺傳、環境、衰老等多種因素[9-12]。Nedd4家族相互作用蛋白 1(Ndfip1)是一種銜接蛋白,因其結構上具有PY模體可被E3泛素連接酶Nedd4的WW結構域識別,從而促進底物蛋白的泛素化降解[13]。近期研究表明,高表達Ndfip1可以保護SH-SY5Y細胞免受魚藤酮誘導的神經毒性的影響[14],提示Ndfip1可能在PD中具有潛在的神經保護作用。但Ndfip1在PD動物模型中的表達變
318青島大學學報(醫學版)59卷
化尚未見報道。因此,本實驗選用攜帶人突變型α-syn(A53T)的轉基因小鼠觀察α-syn突變對黑質中Ndfip1表達的影響,同時選用神經毒素1-甲基-4-苯基-1,2,3,6-四氫吡啶(MPTP)誘導的PD模型小鼠觀察MPTP對黑質中Ndfip1表達的影響,以期為闡明Ndfip1在PD中可能發揮的作用提供新的實驗依據。
1材料和方法
1.1實驗材料
1.1.1實驗動物A53T轉基因小鼠購于美國的Jackson實驗室,選用12月齡雄性α-syn A53T轉基因小鼠及同窩野生型(WT)小鼠作為研究對象。SPF級雄性C57BL/6J小鼠,8周齡,體質量(19±1) g,購于北京維通利華公司。所有小鼠均飼養于可自由飲水攝食、室溫25 ℃、濕度(50±5)%、晝夜循環光照(12 h/12 h)的SPF級清潔環境中。
1.1.2試劑和儀器MPTP粉末和Ndfip1抗體購自美國Sigma公司,Rabbit Anti-β-actin購于中國Bioss公司,HRP-IgG標記的二抗購于中國愛必信公司,分離膠緩沖液和濃縮膠緩沖液均購于康為公司,ECL發光液、PVDF膜購自美國 Millipore公司,過硫酸銨、四甲基乙二胺、RIPA 裂解液、BCA 試劑盒、Loading Buffer均購自中國碧云天公司。電泳儀、電轉儀購自美國 BioRad公司,凝膠成像系統購自美國 UVP公司。
1.2動物分組與處理
選取12月齡雄性WT小鼠作為對照組,α-syn A53T轉基因小鼠作為實驗組。同時選取8周齡雄性C57BL/6J小鼠,隨機分為對照組和MPTP組。MPTP粉末用生理鹽水配制成濃度為6 g/L的溶液,MPTP組小鼠連續5 d給予MPTP腹腔注射(30 mg·kg-1·d-1),對照組小鼠給予等體積的生理鹽水[15]。
1.3免疫印跡技術檢測Ndfip1以及酪氨酸羥化酶(TH)的蛋白表達
小鼠腹腔注射100 g/L水合氯醛麻醉后斷頭取腦,置于干冰盒中靜置5 s后移至冰上,按照小鼠腦圖譜迅速取出黑質放入EP管中。稱質量后按每毫克25 μL的比例加入RIPA蛋白裂解液,使用研磨機充分研磨后,靜置于冰上30 min以充分裂解組織,以12 000 r/min離心35 min后取上清液,應用BCA蛋白定量檢測試劑盒檢測蛋白濃度,加入1/4體積的Loading Buffer后95 ℃金屬浴5 min。應用聚丙烯酰胺凝膠電泳(80 V、40 min,120 V、90 min)后以濕法轉至0.45 μm的PVDF膜上(300 mA、90 min)。用50 g/L的脫脂奶粉室溫封閉2 h,分別加入Ndfip1(1∶1 000)、TH(1∶1 000)、β-actin(1∶10 000)抗體于4 ℃搖床孵育過夜。以TBST溶液洗3次,每次10 min,用山羊抗兔的HRP-IgG二抗(1∶10 000)于室溫孵育1 h;以TBST溶液洗3次,每次10 min,然后使用ECL發光液顯影。應用Image J軟件進行分析,以Ndfip1、TH蛋白與β-actin的比值作為目的蛋白的表達水平。
1.4統計學處理
應用Prism 6軟件進行統計學處理,計量資料結果以±s表示,兩組間比較采用t檢驗,P<0.05表示差異有統計學意義。
2結果
2.1A53T轉基因小鼠黑質區Ndfip1的表達變化
免疫印跡技術檢測結果顯示,12月齡WT小鼠和α-syn A53T轉基因小鼠黑質區Ndfip1蛋白的表達水平分別為1.000±0.083(n=6)和0.885±0.080(n=5),與WT小鼠相比,A53T轉基因小鼠黑質區Ndfip1蛋白的表達下降約11%,差異有統計學意義(t=2.294,P<0.05)。
2.2MPTP誘導的PD小鼠黑質區TH和Ndfip1蛋白的表達變化
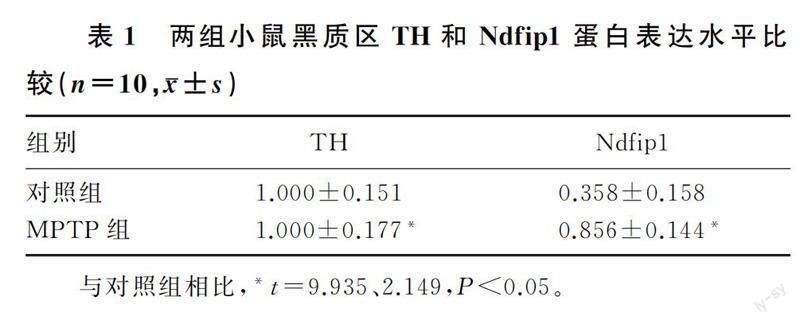
與對照組相比,MPTP組小鼠黑質區TH蛋白表達下降約64%,差異有統計學意義(t=9.935,P<0.01);與對照組相比,MPTP組小鼠黑質區Ndfip1蛋白表達下降約14%,差異有統計學意義(t=2.149,P<0.05)。見表1。
3討論
PD是一種復雜的神經退行性疾病,以老年人多見,其特征性的病理變化是中腦黑質區多巴胺能神經元的變性損傷[16]。但迄今為止,其確切的發病機制尚未完全闡明。因此,探究PD的發病機制及尋找新的治療靶點至關重要。有研究報道,在短暫性的局灶性腦缺血或創傷性腦損傷后,Ndfip1在大鼠腦損傷部位周圍幸存的皮質神經元中表達上調,提示Ndfip1可能對殘存神經元具有保護作用[17]。
本研究團隊前期實驗結果表明,Ndfip1在6-羥基多巴胺(6-OHDA)處理的MES23.5多巴胺能細胞中的表達明顯降低,其水平降低可能與二價金屬鐵轉運蛋白1(DMT1)的表達上調及多巴胺能神經元的鐵沉積有關[18]。但Ndfip1在PD動物模型中的表達及作用尚不清楚。因此,本實驗選取α-syn A53T轉基因小鼠模型和MPTP誘導的PD小鼠模型研究Ndfip1的表達變化。A53T轉基因小鼠攜帶SNCA點突變基因,可在多個腦區觀察到α-syn聚積,該模型可模擬PD的神經病理學改變過程,運動癥狀出現較晚,是研究PD早期病變的理想動物模型。我們前期的研究結果表明,12月齡A53T轉基因小鼠黑質多巴胺能神經元數目未觀察到明顯變化,而15月齡A53T轉基因小鼠黑質多巴胺能神經元數目減少了18.9%,與對照組相比,差異有統計學意義[19]。還有文獻報道,2月齡A53T轉基因小鼠黑質等腦區中即可出現明顯的α-syn聚積所形成的包涵體,但其黑質的TH陽性神經元密度變化不明顯,而紋狀體中TH陽性末梢明顯減少,提示α-syn的異常聚積可導致多巴胺能神經末梢的損傷,這可能是PD發病早期的變化,也可能是A53T轉基因小鼠運動癥狀出現較晚的原因之一[20]。本實驗中α-syn A53T轉基因小鼠黑質區Ndfip1蛋白的表達與WT小鼠相比下降約11%。MPTP是最早發現的導致神經元損傷的神經毒素,其作用機制是通過抑制線粒體復合體Ⅰ的活性損傷多巴胺能神經元,可用于模擬PD發病進程中多巴胺能神經元損傷的病理變化[15-16]。本實驗選用的是亞急性MPTP模型,此模型會出現明顯的行為學改變以及嚴重的神經元損傷,但并無α-syn聚積[21]。本文結果顯示,在MPTP誘導的PD小鼠模型中,TH蛋白水平降低約64%,提示多巴胺能神經元受到明顯損傷。同時觀察到MPTP處理小鼠的黑質區Ndfip1蛋白的表達與對照組相比下降約14%。以上結果表明,兩種PD模型小鼠黑質中Ndfip1蛋白的表達出現相似程度的下降。但是A53T轉基因小鼠黑質區TH陽性細胞數目減少并不明顯,而在MPTP誘導的PD小鼠模型中,黑質區TH陽性細胞數目明顯減少,TH蛋白的表達顯著下降[15]。這提示兩種PD模型小鼠Ndfip1表達下調的機制可能不同。一種可能的機制是,不同PD模型的發病機制及進程不同,A53T轉基因小鼠模型主要是模擬α-syn聚積,病程較長,是研究PD早期癥狀的模型;而MPTP誘導的PD小鼠模型則是亞急性模型,它的發病機制是MPTP在腦內轉換為1-甲基-4-苯基吡啶離子(MPP+),通過觸發線粒體功能障礙引起多巴胺能神經元的損傷,但并無α-syn聚積。提示兩種PD模型不同的發病機制可能在Ndfip1表達調控中發揮不同的作用。此外,有研究報道,在短暫性的局灶性腦缺血或者創傷性腦損傷后,Ndfip1在大鼠腦損傷部位周圍幸存的皮質神經元中表達上調,這可能是神經元對損傷的一種自主且有效的反應性調控策略[22]。因此我們推測,隨著PD的進展,Ndfip1表達可能會出現進行性降低,但急性損傷可能會誘導存活神經元中Ndfip1蛋白的反應性上調。
Ndfip1作為一種銜接蛋白,可以與E3泛素連接酶Nedd4家族蛋白結合參與泛素化過程,降解受損或有害的蛋白。α-syn的異常沉積是PD發病進程中的特征性病理改變。我們的前期研究結果顯示,在神經毒素魚藤酮處理24 h后細胞中出現α-syn的表達增加和Ndfip1的表達減少,而高表達Ndfip1可以抑制α-syn蛋白水平的升高,并拮抗魚藤酮誘導的TH蛋白水平的下降,保護細胞免受毒性損傷[14]。對Ndfip1神經保護作用的細胞機制研究表明,過表達Ndfip1可抑制MPP+誘導的細胞凋亡,并可與Nedd4-1結合參與泛素化過程而抑制α-syn的表達,提高細胞存活率[23]。此外,Ndfip1還可以在Nedd4-2的泛素化作用下,介導Pten蛋白降解,促進腦缺血后神經元的存活[24]。鐵沉積是PD多巴胺能神經元損傷的重要原因之一。有研究報道,在敲除Ndfip1的小鼠大腦神經元中出現明顯鐵積累,過表達Ndfip1可以招募Nedd4-2并結合鐵轉入蛋白DMT1,通過泛素化途徑介導DMT1降解,抑制細胞鐵轉運,減少細胞內的鐵沉積,從而減輕神經元損傷[25-26]。以上研究提示,Ndfip1可能通過泛素-蛋白酶體途徑在細胞凋亡、鐵穩態等過程中發揮作用,參與對PD的神經保護,探究Ndfip1在PD中的作用及可能的機制將為預防和治療PD提供新的作用靶點。
[參考文獻]
[1]GOEDERT M, COMPSTON A. Parkinsons disease-thestory of an eponym[J]. Nature Reviews Neurology, 2018,14(1):57-62.
[2]DIAO X J, WANG F, BECERRA-CALIXTO A, et al. Induced pluripotent stem cell-derived dopaminergic neurons from familial Parkinsons disease patients display α-synuclein pathology and abnormal mitochondrial morphology[J]. Cells, 2021,10(9):2402.
[3]ARAKI K, YAGI N, AOYAMA K, et al. Parkinsons di-sease is a type of amyloidosis featuring accumulation of amyloid fibrils of α-synuclein[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019,116(36):17963-17969.
[4]LATOURELLE J C, BESTE M T, HADZI T C, et al. Large-scale identification of clinical and genetic predictors of motor progression in patients with newly diagnosed Parkinsons di-sease: a longitudinal cohort study and validation[J]. The Lancet Neurology, 2017,16(11):908-916.
[5]MAHAJAN A, MARSILI L, DWIVEDI A K, et al. Timing matters: Otological symptoms and Parkinsons disease[J]. Parkinsonism & Related Disorders, 2021,90:23-26.
[6]HUSSEIN A, GUEVARA C A, DEL VALLE P, et al. Non-motor symptoms of Parkinsons disease: the neurobiology of early psychiatric and cognitive dysfunction[J]. The Neuros-cientist: a Review Journal Bringing Neurobiology, Neurology and Psychiatry, 2021:10738584211011979. doi:10.1177/10738584211011979.
[7]CRAIG C E, JENKINSON N J, BRITTAIN J S, et al. Pedunculopontine nucleus microstructure predicts postural and gait symptoms in Parkinsons disease[J]. Movement Disorders, 2020,35(7):1199-1207.
[8]LIU Y P, LAWTON M A, LO C, et al. Longitudinal changes in Parkinsons disease symptoms with and without rapid eye movement sleep behavior disorder: the Oxford discovery cohort study[J]. Movement Disorders, 2021,36(12):2821-2832.
[9]JANKOVIC J, TAN E K. Parkinsons disease: etiopathoge-nesis and treatment[J]. Journal of Neurology, Neurosurgery, and Psychiatry, 2020,91(8):795-808.
[10]HARE D J, DOUBLE K L. Iron and dopamine: a toxic couple[J]. Brain, 2016,139(4):1026-1035.
[11]MOCHIZUKI H, CHOONG C J, BABA K. Parkinsons di-sease and iron[J]. Journal of Neural Transmission (Vienna, Austria: 1996), 2020,127(2):181-187.
[12]MALPARTIDA A B, WILLIAMSON M, NARENDRA D P, et al. Mitochondrial dysfunction and mitophagy in Parkinsons disease: from mechanism to therapy[J]. Trends in Biochemical Sciences, 2021,46(4):329-343.
[13]JIANG H J, THOMAS S N, CHEN Z, et al. Comparative analysis of the catalytic regulation of NEDD4-1 and WWP2 ubiquitin ligases[J]. The Journal of Biological Chemistry, 2019,294(46):17421-17436.
[14]LIU X, QU L, ZHANG N, et al. Ndfip1 prevents rotenone-induced neurotoxicity and upregulation of α-synuclein in SH-SY5Y cells[J]. Frontiers in Molecular Neuroscience, 2020,13:613404.
[15]JACKSON-LEWIS V, PRZEDBORSKI S. Protocol for the MPTP mouse model of Parkinsons disease[J]. Nature Protocols, 2007,2(1):141-151.
[16]ARMSTRONG M J, OKUN M S. Diagnosis and treatment of parkinson disease: a review[J]. JAMA, 2020,323(6):548-560.
[17]LACKOVIC J, HOWITT J, CALLAWAY J K, et al. Diffe-rential regulation of Nedd4 ubiquitin ligases and their adaptor protein Ndfip1 in a rat model of ischemic stroke[J]. Experimental Neurology, 2012,235(1):326-335.
[18]JIA W T, XU H M, DU X X, et al. Ndfip1 attenuated 6-OHDA-induced iron accumulation via regulating the degradation of DMT1[J]. Neurobiology of Aging, 2015,36(2):1183-1193.
[19]趙晨陽. 攜帶人突變型alpha-突觸核蛋白(A53T)帕金森病轉基因小鼠運動功能及胃腸功能的評價研究[D]. 青島:青島大學, 2015.
[20]MASLIAH E, ROCKENSTEIN E, VEINBERGS I, et al. Dopaminergic loss and inclusion body formation in alpha-synuclein mice: implications for neurodegenerative disorders[J]. Science (New York, N Y), 2000,287(5456):1265-1269.
[21]CHIA S J, TAN E K, CHAO Y X. Historical perspective: models of Parkinsons disease[J]. International Journal of Molecular Sciences, 2020,21(7):2464.
[22]SANG Q, KIM M H, KUMAR S, et al. Nedd4-WW domain-binding protein 5 (Ndfip1) is associated with neuronal survival after acute cortical brain injury[J]. The Journal of Neuroscience, 2006,26(27):7234-7244.
[23]XING L F, GUO H P, WANG D T, et al. Protective effects and mechanisms of Ndfipl on SH-SY5Y cell apoptosis in an in vitro Parkinsons disease model[J]. Genetics and Molecular Research: GMR, 2016,15(2). doi:10.4238/gmr.15026963.
[24]HOWITT J, LACKOVIC J, LOW L H, et al. Ndfip1 regulates nuclear Pten import in vivo to promote neuronal survival following cerebral ischemia[J]. The Journal of Cell Biology, 2012,196(1):29-36.
[25]HOWITT J, PUTZ U, LACKOVIC J, et al. Divalent metal transporter 1 (DMT1) regulation by Ndfip1 prevents metal toxicity in human neurons[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009,106(36):15489-15494.
[26]TIAN J, ZHENG W, LI X L, et al. Lower expression of Ndfip1 is associated with alzheimer disease pathogenesis through decreasing DMT1 degradation and increasing iron influx[J]. Frontiers in Aging Neuroscience, 2018,10:165.
(本文編輯 馬偉平)

