高劑量雌孕激素序貫聯合球囊導尿管放置治療宮腔鏡術后宮腔粘連患者臨床療效
周 麗, 黃 平, 黃勤華, 鐘 茜, 蒲 莉, 丁洪會
1.成都市新都區婦幼保健院 婦產科,四川 成都 610599;2.華西第二附屬醫院 生殖內分泌科,四川 成都 610000
宮腔粘連多見于育齡期女性,是婦科較為常見的疾病之一,病因較為復雜,其中,刮宮過度、宮腔鏡手術、宮腔感染均可能導致子宮內膜基底層受損、修復困難,引起宮腔部分或全部粘連。此外,宮腔粘連還與炎癥感染性疾病相關,患者常出現下腹疼痛、妊娠異常、月經量少或閉經等表現,嚴重影響生理健康,若不及時診治,甚至影響正常的受孕能力[1]。目前,臨床主要通過宮腔鏡對其進行診斷,且可了解宮腔粘連的位置、程度及范圍等。同時,宮腔鏡下宮腔粘連分離術是此疾病較為常用的治療手段,但治療后子宮內膜修復需較長的時間。有研究報道,宮腔粘連患者術后易再形成粘連及閉塞,復發率高達16.1%,特別是中、重度宮腔粘連患者,術后妊娠結局不佳[2-3]。因此,經宮腔鏡手術將宮腔形態的正常解剖恢復后,多采用相關的輔助方式有效隔離手術創面,如放置球囊導尿管以預防新的宮腔粘連形成[4]。另有研究發現,雌孕激素序貫療法可有效預防宮腔術后粘連,但臨床上針對雌激素的應用劑量尚未統一[5]。本研究旨在探討高劑量雌孕激素序貫聯合球囊導尿管放置治療宮腔鏡術后宮腔粘連患者的臨床療效。現報道如下。
1 資料與方法
1.1 一般資料 選取自2020年5月至2022年7月于成都市新都區婦幼保健院行宮腔鏡手術治療的86例宮腔粘連患者為研究對象。納入標準:經相關標準診斷為中重度宮腔粘連[6]。排除標準:盆腔、生殖系統炎癥或惡性腫瘤;對本研究藥物存在禁忌;近期有激素治療史。依據治療手段不同將患者分為A組(n=46)與B組(n=40)。A組中,年齡21~39歲,平均年齡(33.4±4.9)歲;臨床癥狀:繼發性閉經25例,原發性閉經13例,腹痛8例;病程2個月至10年,平均病程(6.1±0.4)年;宮腔鏡手術史1~8次,平均次數(3.7±0.8)次。B組中,年齡23~38歲,平均年齡(32.1±6.2)歲;臨床癥狀:繼發性閉經22例,原發性閉經10例,腹痛8例;病程2個月至12年,平均病程(6.8±0.6)年;宮腔鏡手術史1~6次,平均次數(3.5±0.6)次。兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準。所有患者均簽署知情同意書。
1.2 治療方法
所有患者術前均行常規檢查,于月經結束3~7 d后行宮腔鏡下經宮頸宮腔粘連分離術。具體手術步驟:全身麻醉,密切監測患者生命體征,采用彩色多普勒超聲探查子宮情況,檢測宮腔形態、大小和粘連程度,使用等離子電切鏡,電極分離粘連部位至完全恢復宮腔解剖形態。兩組完成宮腔鏡粘連分離術后,在宮腔將球囊導尿管置入,置入后注入4 ml生理鹽水、3 ml宮腔用交聯透明質酸鈉凝膠,尿管留置時間為1周。
1.2.1 A組治療方法 A組采用低劑量雌孕激素序貫聯合球囊導尿管放置治療。術后第1天口服戊酸雌二醇,2片/d,用藥3周后連續1周口服地屈孕酮,每次10 mg,2次/d,此為1個周期,共3個周期,每個周期間隔1周。
1.2.2 B組治療方法 B組采用高劑量雌孕激素序貫聯合球囊導尿管放置治療。術后第1天口服戊酸雌二醇,4片/d,用藥3周后連續1周口服地屈孕酮,每次10 mg,2次/d,此為1個周期,共3個周期,每個周期間隔1周。
1.3 觀察指標及療效評價標準 (1)比較兩組術后3個月的臨床療效[7]:顯效,治療后月經周期及月經量恢復正常,下腹痛等癥狀全部消失;有效,治療后月經周期及月經量有所恢復,下腹痛等癥狀有所改善;無效,治療后月經周期仍紊亂,下腹痛等癥狀無變化。(2)應用美國生殖協會標準(American Fertility Society,AFS)評分[8],比較兩組手術前后的宮腔粘連情況。(3)比較兩組手術前后內膜厚度。(4)比較兩組術后宮腔再粘連的發生率。(5)應用健康調查簡表(the MOS item short from health survey,SF-36)評分[9],比較兩組術后6個月的預后情況。
總有效率=(顯效+有效)例數/總例數×100%
2 結果
2.1 兩組患者臨床療效比較 A組治療總有效率為78.26%(36/46),低于B組的95.00%(38/40),兩組比較,差異有統計學意義(P<0.05)。見表1。
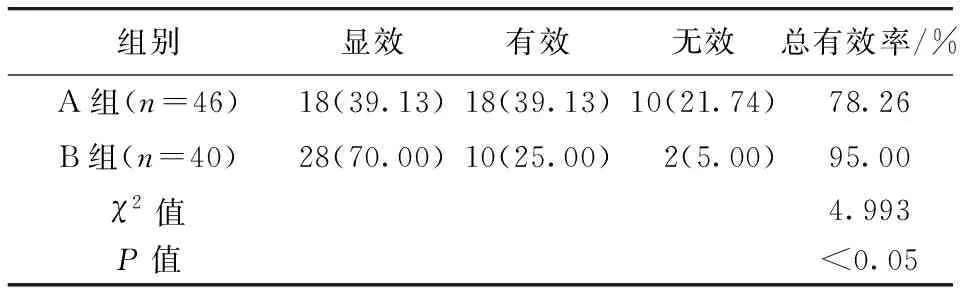
表1 兩組患者臨床療效比較/例(百分率/%)
2.2 兩組患者AFS評分比較 兩組術后AFS評分中的粘連范圍評分、粘連類型評分、月經模式評分均低于術前,且B組低于A組,差異有統計學意義(P<0.05)。見表2。
表2 兩組患者AFS評分比較評分/分)
2.3 兩組患者子宮內膜厚度比較 A組、B組患者術前子宮內膜厚度分別為(6.6±1.5)mm、(6.7±1.3)mm,術后子宮內膜厚度分別為(7.3±1.2)mm、(8.8±1.6)mm。兩組術后子宮內膜厚度均增加,且B組高于A組,差異有統計學意義(P<0.05)。
2.4 兩組患者術后宮腔再粘連發生率比較 B組術后宮腔再粘連發生率為2.50%(1/40),低于A組的15.2%(7/46),兩組比較,差異有統計學意義(P<0.05)。
2.5 兩組患者術后6個月SF-36評分比較 B組術后6個月SF-36評分為(756.7±31.3)分,高于A組的(718.2±27.6)分,兩組比較,差異有統計學意義(P<0.05)。
3 討論
宮腔粘連是指宮腔、子宮峽及子宮頸管因宮腔手術或感染等因素導致的宮腔壁互相粘連[10]。目前,臨床主要應用宮腔鏡進行粘連分離,進而恢復子宮內膜生物學功能,促進卵巢血液供應。此術式可在直視下充分分離宮腔粘連帶,從而恢復正常的宮腔形態[11]。但由于宮腔粘連患者內膜常受損較為嚴重,術后宮腔再粘連的發生率較高,無法達到理想的治療效果。因此,在恢復宮腔形態后,常需應用輔助手段預防術后宮腔的再次粘連。有研究報道,宮腔鏡下黏連分離術后放置球囊導尿管可以在一定程度上降低粘連復發率,且患者的子宮血流動力學更佳,子宮內膜恢復速度更快[12]。另有研究發現,宮腔粘連患者的月經恢復及子宮內膜厚度與激素水平密切相關,適當應用雌孕激素可促進子宮內膜和性激素水平增長,預防粘連復發[13]。
雌二醇是由卵巢分泌的重要甾體雌激素,在女性體內生物活性最強。雌二醇藥物不經肝代謝,具有吸收快、作用強等特點,在促進子宮內膜修復方面具有一定的臨床價值。本研究發現,B組術后3個月總有效率高于A組,表明高劑量雌孕激素序貫聯合球囊導尿管放置對宮腔鏡術后宮腔粘連患者的療效更佳,分析原因可能為高劑量雌激素不僅能刺激內膜增生,同時還可抑制內膜從增生期向分泌期轉化,進而促進創面上皮再生,覆蓋纖維化瘢痕,最終有效恢復宮腔形態并防止粘連復發[14]。Cao等[15]研究發現,雌激素通過激活Wnt/β-catenin信號通路減弱轉化生長因子-β1誘導的與宮腔粘連有關的上皮-間質轉化過程,從而配合宮腔粘連分離術恢復宮腔形態,預防術后再粘連。本研究中,B組術后AFS各項評分均較A組明顯改善,且B組的內膜厚度高于A組。這提示,高劑量雌孕激素序貫聯合球囊導尿管放置可更好地預防宮腔鏡術后宮腔粘連,明顯促進子宮內膜生長,恢復宮腔形態。這可能是因為高劑量雌孕激素可加速子宮內膜和間質細胞的有絲分裂,達到增生和修復的目的,同時可擴張卵巢動脈,降低血管阻力,從而促進血供,增加卵巢的血供。此外,高劑量雌孕激素可使血管擴張,在正常的月經周期中,隨著卵泡的增大,血管阻力逐漸下降,明顯促進子宮內膜生長,恢復宮腔形態,從而更好地預防宮腔鏡術后宮腔粘連[16]。本研究發現,B組術后宮腔再粘連發生率低于A組,B組術后6個月預后較A組明顯改善,進一步表明高劑量雌孕激素序貫聯合球囊導尿管放置具有一定的優勢。
綜上所述,高劑量雌孕激素序貫聯合球囊導尿管放置對宮腔鏡術后宮腔粘連患者的療效更佳,可較好地預防宮腔鏡術后宮腔粘連,促進子宮內膜生長,恢復宮腔形態,且可改善患者的預后。

