彩色馬鈴薯StANS1a基因的克隆及表達分析
聶利珍,張志成,謝 銳,常 悅,張瓊琳,韓平安,羿 靜
(1.內蒙古自治區農牧業科學院,內蒙古 呼和浩特 010031; 2.內蒙古自治區植物蛋白質組學重點實驗室,內蒙古 呼和浩特 010031;3.烏蘭察布市農林科學研究所,內蒙古 集寧 012000)
花色苷是一種常見的水溶性植物色素,其結構為花青素與糖類以糖苷鍵結合,存在于植物各器官的細胞液中,賦予其紅、紫或藍等五彩繽紛的顏色。花色苷是植物次生代謝過程中產生的黃酮類物質,在花色苷合成途徑中,花色苷合成酶(Anthocyanidin synthase,ANS)位于花色苷生物合成途徑下游,催化無色花色苷轉化成有色的花色苷,在植物著色過程中起重要作用[1]。Menssen等[2]在1990年首先從玉米突變體中利用轉座子標簽法分離得到ZmANS基因,之后陸續在紫蘇(Perillafrutescens)[3]、可可(Theobromacacao)[4]、草莓(Fragaria×ananassa)[5]等植物中分離出來ANS基因。進一步的研究表明,將郁金香(Tulipagesneriana)、丹參(Salviamiltiorrhiza)、茶葉(Camelliasinensis)、東方百合(Orientallily)、紫萼玉簪(Hostaventricosa)等植物的ANS基因進行超量表達,都能促進轉基因植株的花色苷積累[6-10]。
馬鈴薯(Solanumtuberosum)是全球第四大重要糧食作物,其營養豐富,除了具有基本的食用價值,還具有特殊的保健功效。馬鈴薯薯肉主要為白色和黃色,還具有紫、紅、黑等顏色的薯肉,這種具有彩色薯肉的馬鈴薯叫彩色馬鈴薯[11]。它除了含有馬鈴薯的營養成分之外,還含有豐富的花色苷[12]。近年來,馬鈴薯中參與花色苷生物合成的相關基因研究也取得了一定的進展[13]。研究人員在馬鈴薯中過表達了3GT基因,結果顯示,轉基因馬鈴薯塊莖中的花色苷含量和塊莖顏色顯著提高[14]。已有的研究表明,StANS基因在彩色馬鈴薯中的轉錄表達明顯高于黃色馬鈴薯,在馬鈴薯中過表達StANS基因可以提高轉基因馬鈴薯塊莖中花色苷的積累[15]。
盡管在許多植物中已克隆了ANS基因并進行相關的研究,但彩色馬鈴薯中該基因的研究還鮮見報道。本研究根據彩色馬鈴薯薯肉的特性,克隆其ANS基因的cDNA序列,通過生物信息學分析其同源性及進化特性,并將其過表達到擬南芥中進行功能驗證,揭示ANS基因在轉基因擬南芥中的表達與花色苷積累的關系,以期為了解彩色馬鈴薯花色苷合成途徑中關鍵基因的功能奠定試驗基礎,同時也為彩色馬鈴薯的分子育種提供技術指導。
1 材料和方法
1.1 試驗材料
彩色馬鈴薯品種紅美塊莖作為基因克隆的試驗材料;野生型擬南芥Columbia 生態型(Col-0)種子作為轉基因受體材料。
1.2 設計基因的特異引物
根據GenBank數據庫中報道馬鈴薯StANS基因(NM_001287930)的cDNA序列,通過Primer 5設計基因的特異引物如下:
ANS-F:5′-TGGTGAGTGAAGTGGTTCCAA-3′;ANS-R :5′-ACAGGAACATGTTTGAGGACT-3′。ANS-ORF-F:5′-CACGGGGGACGAGCTCGGTACCATGGTGAGTGAAGTGGTTCCAATTC-3′;ANS-ORF-R:5′-ACCATGGTGTCGACTCTAGATTTAGATTCTTTAGCAGGAACATCCTTGA-3′。
1.3 彩色馬鈴薯塊莖總RNA提取及逆轉錄
選用塊莖的薯皮和薯肉作為試驗材料,提取其總RNA,具體詳細的提取方法見參考文獻[11]和[16]的試驗方法。吸取1 μL 總RNA樣品作為反轉錄模板,按照反轉錄試劑盒(寶生物)的操作步驟進行反轉錄合成cDNA,獲得塊莖的cDNA樣品,以此cDNA進行PCR擴增。
1.4 彩色馬鈴薯花色苷合成酶基因PCR擴增
以反轉錄合成的cDNA為模板,利用ANS-F/R作為特異引物進行PCR擴增,擴增程序為:95 ℃ 5 min;95 ℃ 10 s,56 ℃ 10 s,72 ℃ 1 min,40個循環;72 ℃ 10 min。電泳檢測結果,利用純化回收試劑盒回收PCR產物。
1.5 ANS基因的連接及測序
將純化回收的PCR產物與克隆載體(T載體)進行連接,然后將連接產物轉化大腸桿菌Trans1-T1。過夜培養后挑取單菌落進行菌落PCR驗證,驗證正確后選取陽性菌液測序。
用上述質粒作為模板,ANS-ORF-F/R作為引物進行PCR擴增,擴增程序同上,純化回收PCR產物,連接T載體,轉化農桿菌,獲得T-ANS質粒。
1.6 ANS基因的生物信息學分析
利用BlastN對ANS基因序列進行比對分析;根據GenBank數據庫中獲得的馬鈴薯StANS(NM_001287930)和其他植物基因序列,利用DNAMAN 10軟件對克隆基因進行氨基酸序列及多序列相似性比對;利用ExPASy Prot Param tool軟件在線預測克隆基因的理化特性;根據MEGA 7.0.26軟件對多種物種來源的ANS序列構建系統進化樹[11]。
1.7 植物表達載體的構建
用KpnⅠ和XbaⅠ雙酶切植物表達載體pCAM35S-GFP和T-ANS載體,分別回收大片段和目的片段;然后利用T4DNA連接酶(NEB,美國)連接,連接產物通過凍融法轉化大腸桿菌感受態細胞,37 ℃過夜培養后,挑取單菌落進行菌落PCR鑒定,鑒定正確即完成了植物表達載體的構建。采用凍融法將StANS1a基因導入農桿菌GV3101,通過菌落PCR鑒定陽性菌落,驗證正確后挑選陽性菌落搖菌,菌液-20 ℃保存備用,用于侵染擬南芥。
1.8 轉基因擬南芥的獲得
在EP管中裝入擬南芥種子,用70%的乙醇消毒2~3 min,再用10%次氯酸鈉消毒10 min,用無菌水洗4~5次,點種在1/2 MS培養基上,4 ℃黑暗條件下春化3 d,然后置于16 h光照/8 h黑暗光周期、40~60 μmol/(m2·s)、18 ℃、濕度為70%條件下培養。10 d后,選擇生長健壯的幼苗移栽到培養土中。當幼苗生長14 d左右抽薹時進行轉化,轉化前將已經開放的花和種子剪除干凈。將冷凍保存的農桿菌菌液活化培養后,重懸于滲透緩沖液中,調節菌液濃度OD600=0.4~0.6,將擬南芥花器浸入農桿菌懸浮液30 s,繼續生長約30 d收獲種子。通過含有潮霉素的培養基篩選轉基因植株和純合植株。
1.9 花色苷含量測定
根據Laby等[17]的方法進行花色苷含量的測定。每個樣品都選用14 d左右的轉基因和非轉基因擬南芥植株3棵,稱質量后加入99∶1甲醇∶HCl(V/V)提取液,混合均勻,4 ℃提取16 h,其間每隔5~6 h顛倒混勻1次。處理結束后,4 ℃條件下,12 000 r/min 離心10 min,吸取上清液至新的離心管。花色苷采用分光光度計進行檢測,每個樣品分別讀取530,657 nm下的吸光值進行測量,每個樣品3 次生物學重復。使用以下公式確定相對花色苷水平:花色苷的相對單位/新鮮組織的質量=(OD530-(0.25×OD657))×提取體積(mL)×1/組織樣品的質量(g)。
1.10 RT-PCR檢測
分別提取轉基因擬南芥和非轉基因擬南芥植株的總RNA,按照反轉錄試劑盒(寶生物)操作步驟進行反轉錄合成cDNA作為模板,進行轉基因植株的RT-PCR檢測。PCR擴增的引物分別為:擴增StANS1a基因的特異引物為StANS1a-RT-F-5′-ATGGTGAGTGAAGTGGTTCCA-3′和StANS1a-RT-R-5′-AAGTCTTCCATGCCTCCAAC-3′,擴增片段跨StANS1a基因內含子,擴增cDNA片段長度為659 bp。擬南芥內參基因引物為Atactin-F-5′-CGGAAAACAAGGTGAGCCGA-3′和Atactin-R-5′-GATTTGAGTCATCTTCTCACG-3′,擴增cDNA片段長度為555 bp。
2 結果與分析
2.1 彩色馬鈴薯ANS基因的RT-PCR 擴增
以反轉錄獲得的彩色馬鈴薯cDNA為模板,利用ANS-F/R作為引物,擴增獲得長度約1 500 bp 的特異性條帶(圖1-A)。PCR產物回收純化后連接轉化大腸桿菌,對挑取的單克隆進行菌液PCR驗證,其結果見圖1-B。將PCR 驗證為陽性的菌液送公司測序,結果顯示,所得cDNA片段長度為1 406 bp(圖2-A),通過比對分析其包含一個1 368 bp完整的開放閱讀框,編碼 455個氨基酸殘基 (圖2-B)。
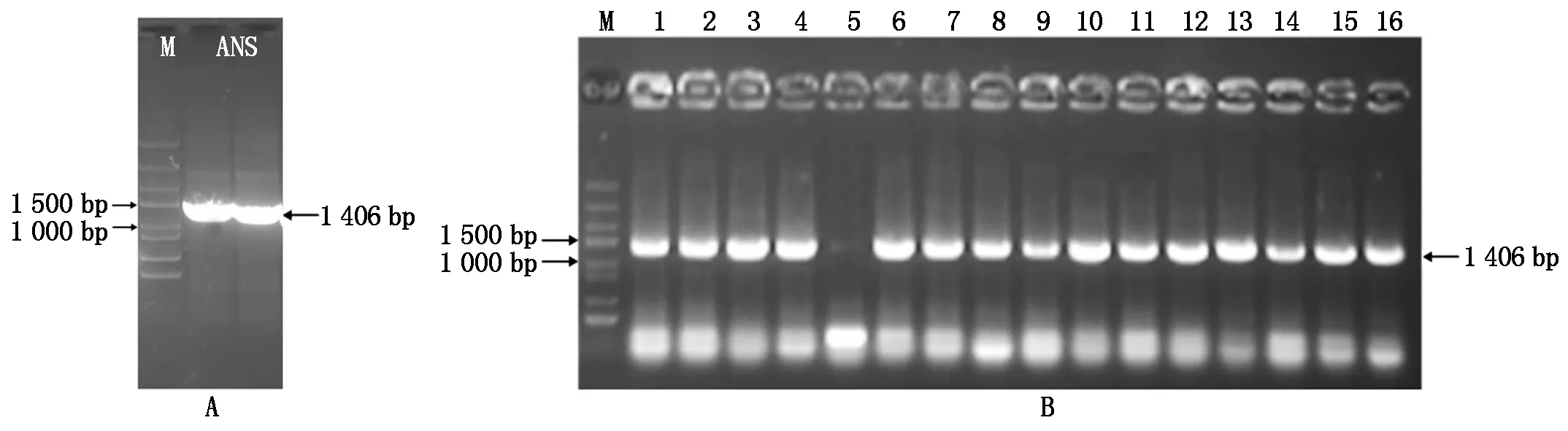
M.DNA Marker DL3000; A.StANS1a基因克隆; B.PCR驗證陽性菌落; 1—16.隨機菌落。

A.StANS1a基因cDNA序列;B.StANS1a氨基酸序列;4~228.多肽鏈N端。
Blast比對后發現,該序列與馬鈴薯StANS(NM_001287930)基因序列相似度達到84.60%(圖3-A),而開放閱讀框相似度為97.59%,氨基酸相似度為95.82%(圖3-B),通過對其氨基酸序列編碼蛋白質結構域比對,發現堿基改變未引起蛋白質結構域改變,并且具有保守的結構域DIOX_N和2OG_FeⅡ_Oxy,分別位于氨基酸序列的第52~166位和第215~312位(圖2-B)。表明克隆得到的序列為馬鈴薯StANS基因序列,命名為StANS1a(GenBank:ON512347)。
2.2 StANS1a理化性質分析
利用ExPASy ProtParam tool 軟件分析StANS1a氨基酸的理化性質,結果顯示,StANS1a 蛋白質是由455 個氨基酸殘基組成的,分子式為C2292H3633N607O696S13,原子總數為7 241個,分子質量約為51.25 ku,其中帶正、負電荷的氨基酸殘基分別有63,81 個,理論等電點(pI)是5.32,不穩定系數44.45,平均親水系數-0.496,表明StANS1a蛋白屬于親水性的不穩定蛋白質(圖4)。
2.3 StANS1a蛋白質的相似性比對分析
根據 NCBI數據庫中其他植物ANS的氨基酸序列,利用DNAMAN 10軟件分析以下幾種植物的ANS氨基酸序列的相似性,如馬鈴薯StANS (Solanumtuberosum,NM_001287930)、番茄SlANS(Solanumlycopersicum,NP_001361323.1)、茄子SmANS(Solanummelongena,ACJ02088.1)、辣椒CaANS(Capsicumannuum,PHT92526.1)、煙草NtANS(Nicotianatabacum,AWL24853.1)、擬南芥AtANS(Arabidopsisthaliana,NP_001031700.1)、蘋果MdCHS(Malusdomestica,RXI03704.1)、大豆GmANS3(Glycinemax,NP_001240884.1)、黑果枸杞(Lyciumruthenicum,QFR04941.1)、澳洲棉(Gossypiumaustrale,KAA3469013.1)、葡萄(Vitisvinifera,ABV82967.1)、胡桃(Juglansregia,XP_018847204.1)、可可(Theobromacacao,XP_007040068.2)、榴蓮(Duriozibethinus,XP_022736758.1)、阿月渾子(Pistaciavera,XP_031284664.1)、覆盆子(Rubusidaeus,AXY97021.1)。由圖5可知,StANS1a基因在氨基酸水平與StANS和番茄SlANS相似性達到98%,而與茄子SmANS、辣椒CaANS、煙草NtANS、擬南芥AtANS、蘋果MdANS和大豆GmANS3等氨基酸序列的相似性也都超過了80%,它們在氨基酸水平具有很高的相似性,揭示了在植物中ANS基因的氨基酸序列具有極強的保守性,也可能說明了不同植物ANS蛋白質功能具有較高的相似性。
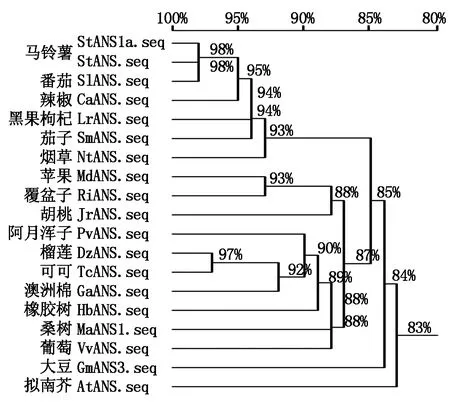
圖5 StANS1a與其他植物ANS氨基酸序列相似性的比對分析
2.4 構建StANS1a蛋白質的系統進化樹
根據NCBI數據庫比對分析,選用與StANS1a氨基酸序列同源性較高的其他植物ANS的氨基酸序列,分別為馬鈴薯(NM_001287930)、番茄(NP_001361323.1)、茄子(ACJ02088.1)、辣椒(PHT92526.1)、煙草(AWL24853.1)、黑果枸杞(QFR04941.1)、澳洲棉(KAA3469013.1)、葡萄(ABV82967.1)、胡桃(XP_018847204.1)、可可(XP_007040068.2)、榴蓮(XP_022736758.1)、蘋果(RXI03704.1)、阿月渾子(XP_031284664.1)、覆盆子(AXY97021.1)和擬南芥(NP_001031700.1)。利用MEGA 7軟件構建系統進化樹,由圖6可知,在初級聚類中,首先聚合成2大分支,其中StANS1a與同為茄科的馬鈴薯、番茄、茄子聚在同一個分支,其親緣關系較近;其他的聚為另一個分支,親緣關系較遠,進化樹的構建也反映了一些物種親緣關系的遠近。
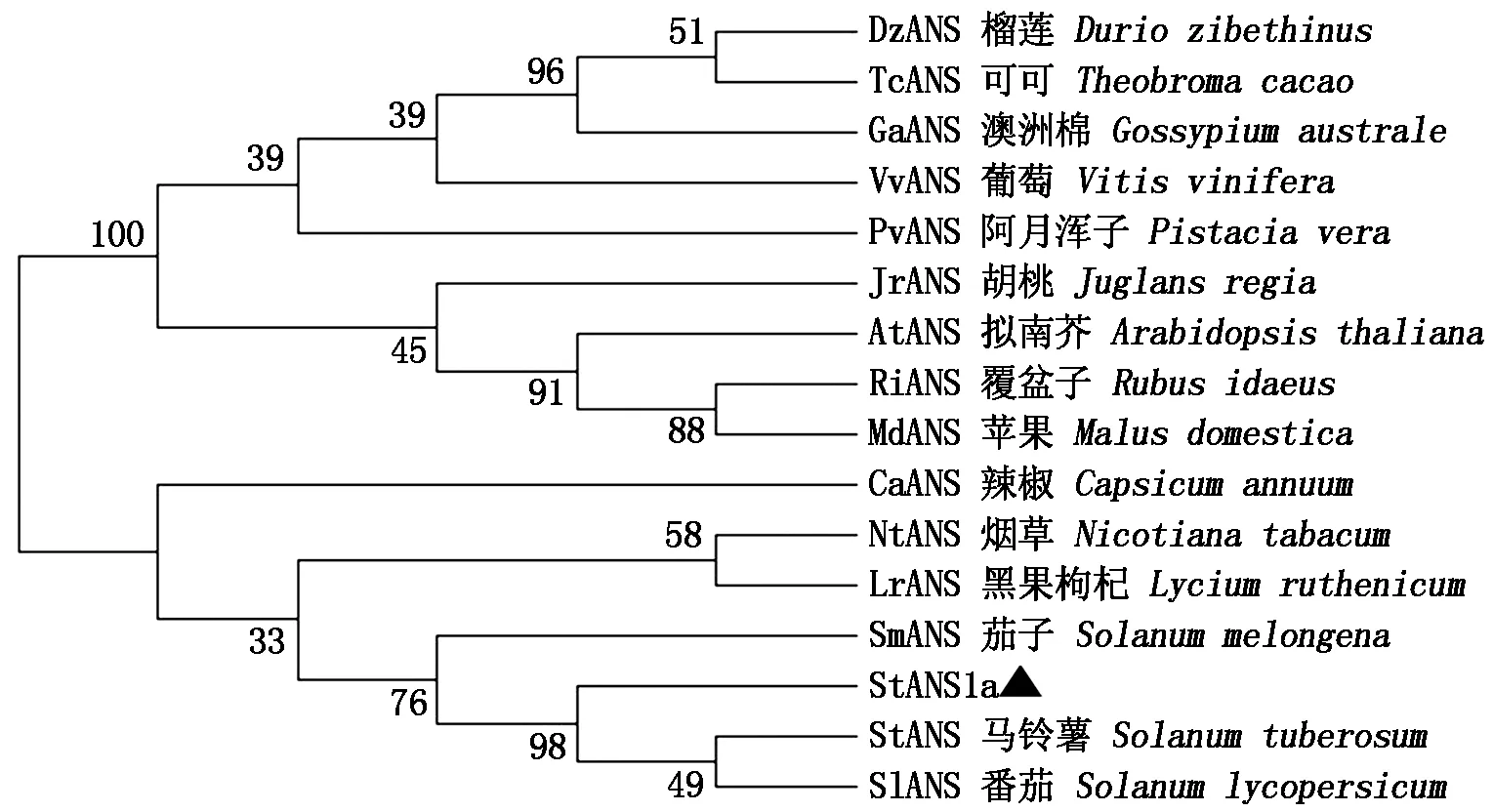
各節點處數字表示bootstrap 值(重復1 000 次)。
2.5 植物表達載體的構建
用KpnⅠ和XbaⅠ雙酶切植物表達載體pCAM35S-GFP(圖7-A)和克隆載體T-StANS1a,分別回收大片段和小片段,將所得大片段與酶切所得的StANS1a基因的cDNA小片段用同源重組連接酶重組連接,轉化至Trans1-T1感受態細胞,挑取陽性菌落進行菌落PCR驗證,載體測序驗證,構建好的植物表達載體見圖7-B,最后將構建好的植物表達載體轉入農桿菌中,菌落PCR驗證陽性菌落(圖7-C),證實彩色馬鈴薯StANS1a基因已轉入農桿菌中。
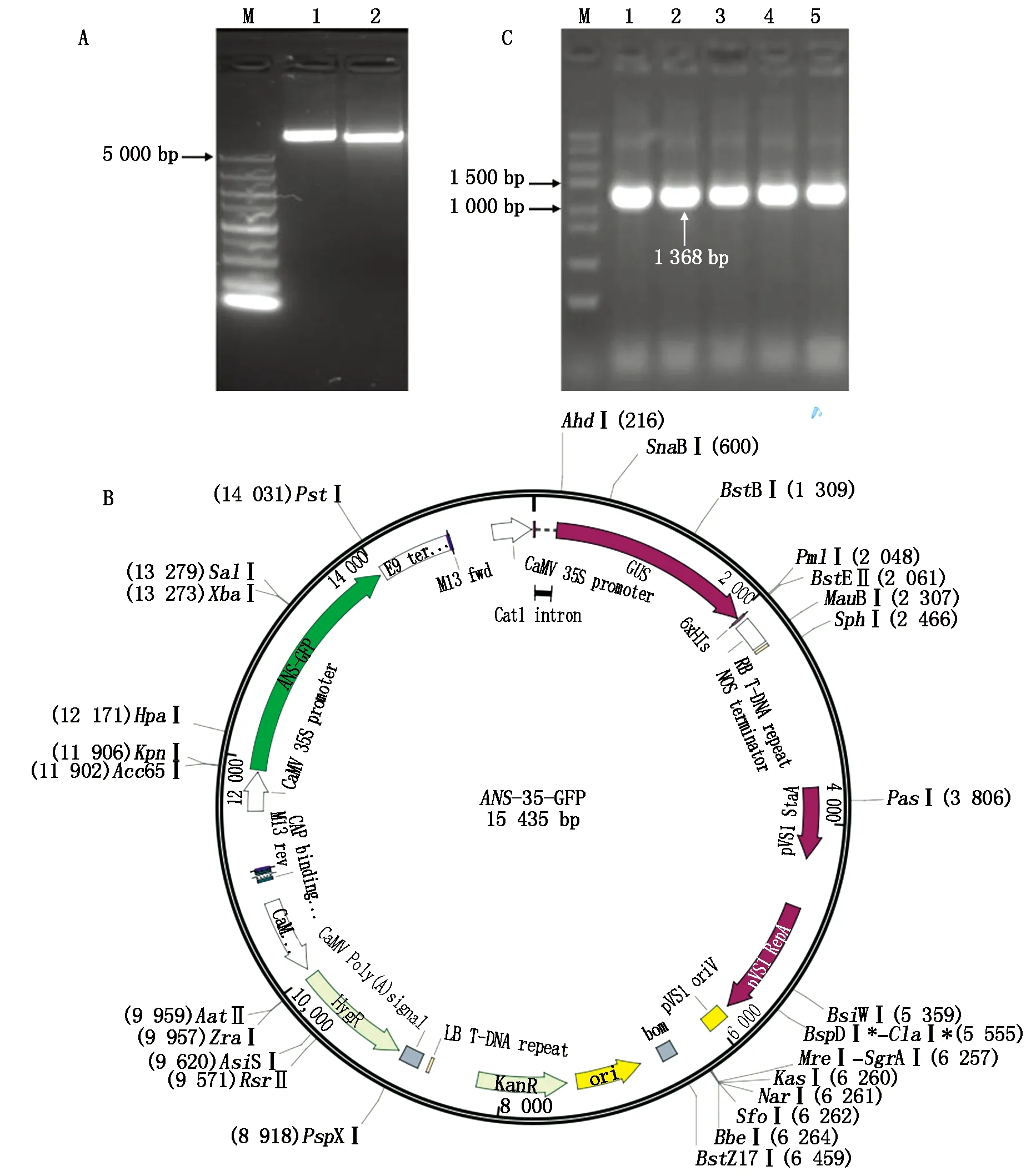
A.酶切pCAM35S-GFP和T-StANS1a載體;B.構建的植物表達載體圖譜;C.菌落PCR驗證StANS1a;1—5.隨機單菌落。
2.6 StANS1a基因轉化擬南芥
將含有StANS1a基因的植物表達載體通過農桿菌介導法轉入擬南芥中,將收獲的種子種植于含有潮霉素的培養基中,利用轉基因種子帶有抗性基因,在含有潮霉素的培養基中仍然能正常生長,而非轉基因種子不能生長而死亡,來篩選轉基因植株。通過篩選獲得了轉基因擬南芥T3純合種子。
2.7 轉基因植株中StANS1a的相對定量分析
為了驗證轉基因擬南芥植株中StANS1a基因的轉錄水平,隨機挑選7個轉基因植株,利用StANS1a的特異引物StANS1a-RT-F/R,以擬南芥的Atactin基因作為內參基因,通過RT-PCR檢測StANS1a在轉基因擬南芥中的表達。由圖8可知,7株轉基因植株中都有StANS1a基因的表達,只是表達量稍有不同。
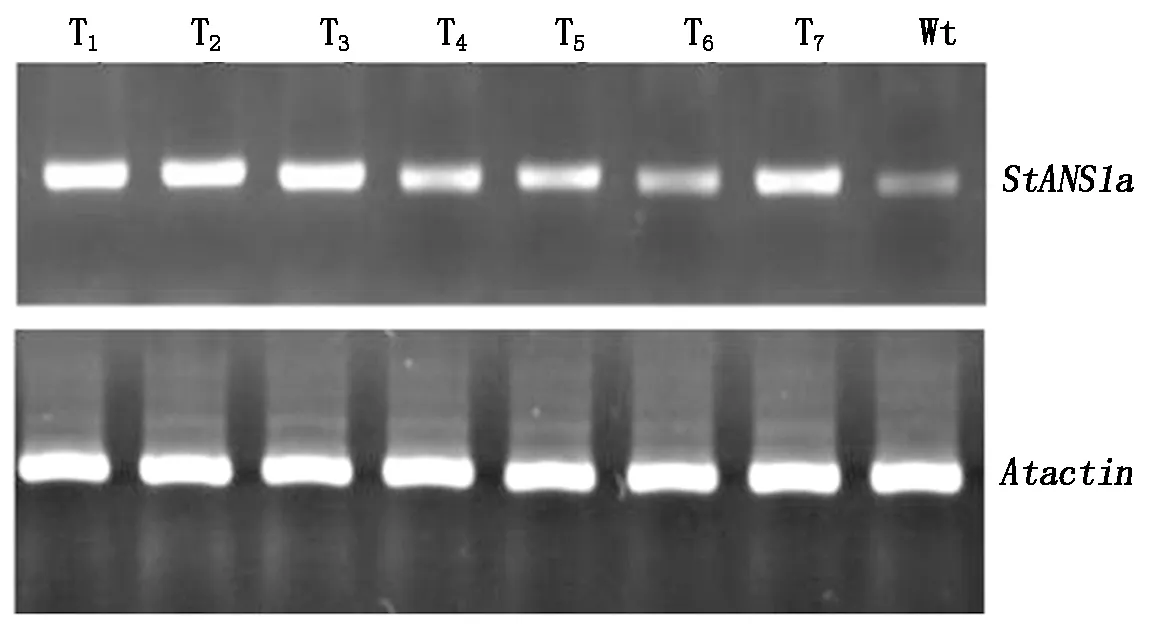
圖8 轉基因株系RT-PCR分析
2.8 轉基因擬南芥中花色苷含量的測定
為了驗證StANS1a基因參與花色苷的積累,本研究測定了不同轉基因擬南芥株系中花色苷的含量,由圖9可知,部分轉基因株系內花色苷含量與非轉基因擬南芥相比有顯著差異(P<0.05),最高T2比非轉基因擬南芥高54.61%;其次為T3,比非轉基因擬南芥高51.63%;T4比非轉基因擬南芥高40.24%;T7比非轉基因擬南芥高36.39%;T1比非轉基因擬南芥高28.76%;最低為T5,比非轉基因擬南芥略高2.17%。

不同的字母代表轉基因擬南芥與Wt 的差異達顯著水平(P<0.05)。
3 結論與討論
花色苷是植物黃酮類化合物中最大的一類,在許多植物中主要呈現紅色和藍色[18]。花色苷在合成過程中需要多種酶的參與,如ANS、DFR、F3′5′H和3GT等[14,19-20]。其中ANS 是花色苷生物合成途徑末端的關鍵酶,對植物的成色起著關鍵作用,是其生物合成途徑中重要的結構基因[21]。本研究從彩色馬鈴薯塊莖中克隆到1個包含1 368 bp的完整開放閱讀框,編碼 455個氨基酸殘基的花色苷合成酶基因的cDNA序列。分析比對后發現,該序列部分堿基發生改變,但與StANS序列相比蛋白質結構域未發生變化,具有ANS保守的結構域DIOX_N和2OG_FeⅡ_Oxy,這些 ANS 的保守結構域與其他植物是一致的[22]。進化分析表明,StANS1a與同為茄科的馬鈴薯、番茄和茄子處在同一分支,親緣關系最近,與蘋果和擬南芥等親緣關系較遠,這與植物學傳統分類一致。本研究構建了StANS1a過表達載體轉化擬南芥,轉基因株系中StANS1a基因的轉錄水平較非轉基因植株有了明顯提高,這與楊成龍等[9]將東方百合ANS轉入擬南芥,轉基因株系ANS基因的表達量顯著上升的結果是一致的。轉基因植株花色苷含量比非轉基因植株中高2.17%~54.61%,這些結果證實StANS1a基因具有花色苷合成酶的功能,且促進了轉基因擬南芥中花色苷含量的積累,這與ANS基因在草莓和蘋果中的結果是一致的[5,23]。
對轉基因植株進行表型觀察,轉基因擬南芥在幼苗期未出現明顯的表型變化,推測可能有兩方面的原因,一是轉基因株系中StANS1a在苗期表達量低,形成的花色苷含量也低,不足以在表型上體現出來;二是在擬南芥顏色形成的過程中,StANS1a基因可能并不是擬南芥成色的主效基因,只是催化無色花色苷變成有色花色苷,具體的原因還有待于進一步的深入研究。本研究也證實了過表達單一的StANS1a基因并不能引起擬南芥幼苗植株顏色的變化,只能改變擬南芥幼苗體內花色苷的積累量,說明ANS基因在植物花色苷形成過程中起了關鍵作用。綜上所述,彩色馬鈴薯StANS1a基因在花色苷代謝途徑中起著重要作用,為后續利用該基因對馬鈴薯的分子改良提供了基因資源。

