產(chǎn)前尼古丁暴露對子代大鼠血管內(nèi)皮祖細胞的影響
王綿綿 王振華 余二梅
(1 福建醫(yī)科大學附屬第二醫(yī)院心內(nèi)科,福建 泉州 362000;2 福建醫(yī)科大學附屬第二醫(yī)院超聲科,福建 泉州 362000)
近年來,越來越多的證據(jù)顯示,作用于生命早期(組織可塑性生長發(fā)育特異時間窗)的環(huán)境因素,明顯影響成年期慢性疾病發(fā)生的危險。醫(yī)學界首先提出成年期疾病的“早”或“胎兒”起源假說。該假說認為,環(huán)境因素(特別是營養(yǎng))作用于生命早期,可程序性控制成年期心血管與代謝性疾病的發(fā)生和早產(chǎn)兒死亡的風險。最近的研究表明,孕婦吸煙、產(chǎn)前尼古丁暴露可導致子代長期持續(xù)性新陳代謝系統(tǒng)與心血管系統(tǒng)異常。尼古丁作為膽堿能受體激動劑可以在心血管和內(nèi)分泌體內(nèi)平衡中扮演重要的角色。妊娠期間尼古丁暴露會導致許多胎兒問題,包括宮內(nèi)生長遲緩和早產(chǎn)[1]。煙草中的尼古丁可透過胎盤,并優(yōu)先集中在胎兒,導致其在胎兒循環(huán)和羊水中的含量比孕婦更高[2]。循環(huán)內(nèi)皮祖細胞(circulating endothelial progenitor cell,EPC)在EC細胞再生中起重要作用。EPCs全身輸注或內(nèi)在動員可增強局部內(nèi)皮剝脫后的修復,從而使血管再內(nèi)皮化。本研究旨在明確PNE對子代大鼠血管EPCs的影響,探討這些效應是否存在潛在的性別依賴性差異,并進一步明確這些效應是否可持續(xù)作用至日后成年期。
1 材料與方法
1.1 實驗動物 健康雌性Sprague-Dawley(SD)大鼠(清潔級,6周齡,體質(zhì)量150~200 g)20只,健康雄性SD大鼠(清潔級,6周齡,體質(zhì)量200~250 g)10只,總共30只(由上海斯萊克動物實驗中心提供),許可證號SCXK(滬)2012-0002。
1.2 實驗試劑 尼古丁購自美國Sigma公司,PBS緩沖液購自賽默飛世而生物化學制品有限公司,Rabbit Anti-CD133/PE antibody、Rabbit Anti-CD34/FITC antibody、Rabbit IgG(H+L)/PE conjugated、Rabbit IgG/FITC conjugated均購自英國Abcam公司。
1.3 模型的建立 將SD大鼠飼養(yǎng)于自然光照,空調(diào)控制溫度(20±2)℃,由吊扇及排氣扇通風的飼養(yǎng)室中,自由攝取大鼠標準飼料(購自福州吳氏實驗動物有限公司)和清潔自來水。參考先前的報道建立大鼠產(chǎn)前尼古丁暴露(perinatal nicotine exposure,PNE)模型。將28周齡SD大鼠,按1∶1雌雄隨機合籠,用托盤法監(jiān)測陰栓,平均每12 h檢查1次,以發(fā)現(xiàn)陰栓記為妊娠第1天。將孕SD大鼠隨機分成兩組,PNE組10只,正常組10只。孕SD大鼠經(jīng)氯胺酮和賽拉嗪麻醉,于背部作一切口,將滲透微泵(2ML4型)植入切口后縫合。其中PNE組植入的1/2滲透微泵攜帶102 mg/mL尼古丁,另一半則為生理鹽水作為正常組,每日按6 mg/(kg·d)劑量率給予。每只孕鼠1個籠子。所有孕鼠自然分娩,仔鼠與母鼠籠養(yǎng)4周后,根據(jù)觀察肛門跟生殖器的距離以及乳頭突的有無,將雌雄子代分籠喂養(yǎng)。分別于子代1、3、4、6、12月齡時進行實驗,測量數(shù)據(jù)。
1.4 流式細胞術(shù)檢測EPCs數(shù)量
1.4.1 實驗動物的取血 分別于子代大鼠1、3、6、12月齡時給每只大鼠稱重,按0.3 mL/100 mg的劑量給予10%水合氯醛麻醉,將大鼠尾部拉起,待大鼠安靜時,快速從腹腔注射,必要時追加麻醉。待大鼠麻醉滿意后,將大鼠平放于手術(shù)器皿上,頭朝下,用備皮刀刮去大鼠右側(cè)頸部毛發(fā),將1 mL注射管用生理鹽水稀釋的肝素鈉潤洗,觸摸到大鼠頸部血管搏動,在搏動最明顯的三角處快速進針,回抽形成負壓,緩慢退針,見回血后,保持位置,抽血至1 mL,拔掉針頭(因1 mL注射器針頭太細,直接打出來可能會破壞細胞),打開血常規(guī)管的橡皮塞,將血液注入后快速蓋上橡皮塞,再往血常規(guī)管內(nèi)打入空氣,防止橡皮塞脫出;若未成功抽出血,于進針處剪開皮膚,探查頸靜脈,抽血。將血常規(guī)管放入裝有冰袋的泡沫盒內(nèi),送至醫(yī)院中心實驗室4 ℃冰箱內(nèi),待檢。
1.4.2 測定EPCs數(shù)量 ①取樣:將血液樣本從4 ℃冰箱中取出,將血常規(guī)管放入離心機1 000 r/min,離心30 s,將管壁上的血液離到管底,再在震蕩機上震蕩10 s,取流式細胞管標記空白、IgG、CD34、CD133、1~n PF。分別從1~n號管中取400 μL血樣于1~n號流式管中。②溶血:按1∶5比例加入紅細胞裂解液,分別于1~n號管中加入2 000 μL紅細胞裂解液,震蕩機上震蕩后避光反應20 min,觀察溶血情況(以血液清澈透亮為優(yōu)),再放入CH80-2S臺式低速離心機中離心2 000 r/min,5 min,去上清液,再分別加入1 000 μL紅細胞裂解液,再震蕩機上震蕩后避光反應10 min。③離心:將流式管配平后放入離心機離心(2 000 r/min,5 min),去上清(一次傾倒,至少保證100 μL剩余)。洗滌:分別于1~n號管中加入2 000 μL中性PBS液,震蕩(將沉在管底的細胞震勻)后放入離心機離心5 min,去上清;再分別加入2 000 μL中性PBS液,離心5 min,去上清;震蕩后再分別加入1 000 μL中性PBS液,離心5 min,去上清(反復洗2~3次)。④染色:為了保證細胞濃度,去上清液后不再加入PBS液,而是將去完上清的剩余樣本放入震蕩機上震勻。將4個抗體旋緊后放在小離心機上離心3 s,在IgG管中加入3 μL IgG-PE和3 μL IgG-FITC,在CD34管中加入3 μL CD34-FITC,在CD133管中加入3 μL CD133-PE,分別在1~n PF管中加入3 μL CD133-PE和3 μL CD34-FITC。分別從1~n號管中取100 μL血樣于1~n PE號流式管中。分別再1、2、3、4號管中加入100 μL中性PBS液,再從中抽取100 μL樣品于空白管,IgG管,CD34管,CD133管。震蕩10 s,避光孵育30 min。上機:取出后加入200 μL生理鹽水,搖勻,放入離心機離心(2 000 r/min,5 min),去上清,再加入200 μL生理鹽水,搖勻,上機檢測。
1.5 統(tǒng)計學方法 采用 SPSS 19.0統(tǒng)計軟件包對數(shù)據(jù)進行分析,計量資料采用()表示。正態(tài)分布資料兩組間均值比較,采用t檢驗,非正態(tài)分布資料兩組間均值的比較采用Mann-WhitneyU非參數(shù)檢驗。采用一般線性模型的Univariate過程,進行完全隨機分組析因設計的多因素方差分析,分析各因素的主效應及交互作用。血管環(huán)內(nèi)皮功能的檢測則采用GraphPad Prism 5軟件中的Two-way ANOVA檢驗,P<0.05為差異有統(tǒng)計學意義。
2 結(jié)果
2.1 經(jīng)流式細胞術(shù)檢測1月齡子代大鼠外周血EPCs數(shù)量 雌性子代外周血EPCs,PNE組較正常組顯著降低(P<0.05),雄性子代,PNE組與正常組相比差異無統(tǒng)計學意義(P>0.05),見圖1A;PNE組,雌性子代較雄性子代顯著降低(P<0.05),正常組,雌性子代與雄性子代差異無統(tǒng)計學意義(P>0.05),見圖1B。
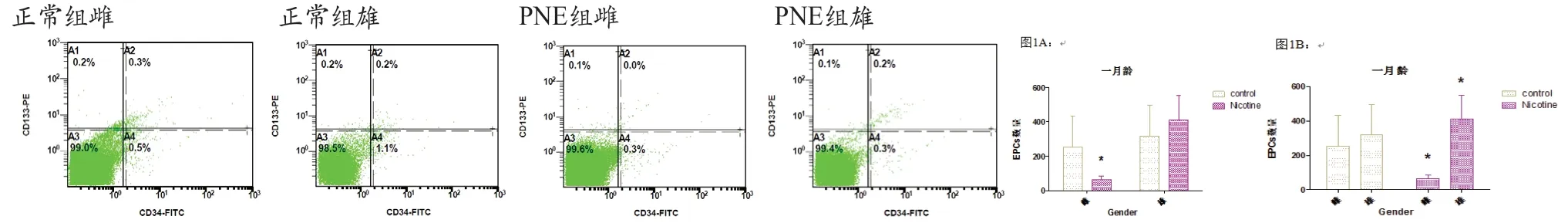
圖1 經(jīng)流式細胞術(shù)檢測1月齡子代大鼠外周血EPCs數(shù)量
2.2 經(jīng)流式細胞術(shù)檢測3月齡子代大鼠外周血EPCs數(shù)量 雌性子代,PNE組與正常組差異無統(tǒng)計學意義(P>0.05),雄性子代,PNE組與正常組差異無統(tǒng)計學意義(P>0.05),見圖2A;PNE組,雌性子代與雄性子代差異無統(tǒng)計學意義(P>0.05),正常組,雌性子代與雄性子代差異無統(tǒng)計學意義(P<0.05),見圖2B。

圖2 經(jīng)流式細胞術(shù)檢測3月齡子代大鼠外周血EPCs數(shù)量
2.3 經(jīng)流式細胞術(shù)檢測6月齡子代大鼠外周血EPCs數(shù)量 雌性子代,PNE組較正常組顯著升高(P<0.05),雄性子代,PNE組較正常組顯著升高(P<0.05),見圖3A;PNE組,雌性子代較雄性子代顯著升高(P>0.05),正常組,雌性子代與雄性子代差異無統(tǒng)計學意義(P<0.05),見圖3B。

圖3 經(jīng)流式細胞術(shù)檢測6月齡子代大鼠外周血EPCs數(shù)量
2.4 經(jīng)流式細胞術(shù)檢測12月齡子代大鼠外周血EPCs數(shù)量 雌性子代,PNE組與正常組差異無統(tǒng)計學意義(P>0.05),雄性子代,PNE組與正常組差異無統(tǒng)計學意義(P>0.05),見圖4A;PNE組,雌性子代與雄性子代差異無統(tǒng)計學意義(P>0.05),正常組,雌性子代與雄性子代差異無統(tǒng)計學意義(P<0.05),見圖4B。

圖4 經(jīng)流式細胞術(shù)檢測12月齡子代大鼠外周血EPCs數(shù)量
2.5 PNE、性別、年齡對EPCs數(shù)量變化的影響 PNE、性別、年齡對EPCs數(shù)量的變化有影響,且三者之間存在交互作用。見表1~3。

表1 性別對EPCs水平的影響

表2 PNE對EPCs水平的影響
3 討論
PNE可誘導子代內(nèi)皮功能病理生理改變,而內(nèi)皮功能障礙主要表現(xiàn)在NO的生物利用度減少和EC的進行性丟失。對于EC的丟失,在生理條件下,可通過增加EC的更新對損傷進行修復。另一方面,EPCs對EC的再生以及內(nèi)皮的損傷修復起重要作用。EPC水平已被提議作為血管內(nèi)皮功能障礙的重要的生物標志物。然而,EPCs水平與血管內(nèi)皮功能障礙之間的關(guān)系仍存在爭議[11]。EPCs是體內(nèi)的一種干細胞,其能分化為內(nèi)皮細胞,后者是新生血管的重要組成部分。本研究采用流式細胞儀對CD34、CD133雙染熒光標記分離EPCs并對其進行定量檢測,結(jié)果表明,PNE影響雌性子代EPCs的數(shù)量變化,而雄性子代無明顯變化,提示PNE可誘導EPCs水平的改變,該效應存在性別差異,且持續(xù)作用至成年期。有動脈粥樣硬化性血管疾病的風險因素的患者其外周EPCs的數(shù)量顯著減少[3-4]。PNE可導致子代長期持續(xù)性新陳代謝系統(tǒng)與心血管系統(tǒng)異常,誘導子代內(nèi)皮功能病理生理改變,且大量研究證實,EPCs對EC的再生以及內(nèi)皮的損傷修復起重要作用。EPC水平已被提議作為血管內(nèi)皮功能障礙的重要生物標志物。EPCs可通過增殖分化為成熟內(nèi)皮細胞的方式,使受損的血管再內(nèi)皮化,故EPCs具有防止動脈粥樣硬化的作用[5-6]。由于EPCs具有強大的增殖能力,其數(shù)量能在一定程度上反映內(nèi)皮細胞的功能及其對血管修復的程度,從而在一定程度上利于血管存在危險因素風險的分析以及對血管功能的評價。
到目前為止,國內(nèi)外罕見對PNE與EPCs的關(guān)系的研究資料,本研究發(fā)現(xiàn)EPCs的數(shù)量變化受很多因素的影響,通過單因素的方差分析可知,PNE、性別以及年齡均對其變化均有影響,且兩兩之間、三者之間均存在交互關(guān)系,提示PNE、性別以及年齡共同作用EPCs的數(shù)量變化。本研究對PNE的1、3、6、12月齡的子代大鼠進行觀察,發(fā)現(xiàn)在其他條件相同的情況下,年齡對EPCs數(shù)量的變化起作用。除了年齡的影響,還發(fā)現(xiàn)性別對EPCs數(shù)量也存在影響。近期的研究表明,EPCs在雌激素的作用下能對損傷血管進行修復[7-8]。另一項研究發(fā)現(xiàn),雌二醇不僅對內(nèi)皮細胞有調(diào)控作用,還可誘導外周血循環(huán)EPCs的數(shù)量增加,從而抑制受損血管的內(nèi)膜增厚[9]。通過以上研究可推測雌激素作用的血管修復可能是通過EPCs介導的。最近的研究發(fā)現(xiàn),高血壓模型大鼠與正常對照組相比,骨髓EPCs的功能有所下降,另一方面用雌激素干預的實驗組與正常對照組相比,其EPCs的功能明顯增強[10-11]。用雌激素干預體外培養(yǎng)EPCs,分不同時間段,分不同溶度加入雌激素,發(fā)現(xiàn)在一定范圍內(nèi)EPCs的數(shù)量和功能呈時間依賴性差異以及溶度依賴性差異特征[12-13]。目前,雌激素對EPCs的生物學功能、動員及改善的具體機制尚不清楚。而雌激素與EPCs的數(shù)量改變有關(guān),但二者不符合線性關(guān)系[14-15]。
與雄性子代血管內(nèi)皮功能損傷相比,雌性子代的內(nèi)皮功能未損傷反而升高,考慮其原因可能是雌激素的保護作用。但雌激素是通過什么機制對血管內(nèi)皮功能進行保護的尚不清楚。本研究發(fā)現(xiàn),在PNE的作用下,雌性子代的EPCs數(shù)量有升高,而雄性子代的EPCs的數(shù)量未見變化,結(jié)合之前的研究報道雌激素對EPCs有激動作用,認為雌激素可能通過刺激EPCs的動員、增殖、促進血管修復,從而使雌性子代的內(nèi)皮功能代償性升高,而雄性子代可能因為缺乏雌激素對EPCs的激動,EPCs數(shù)量沒有發(fā)生變化,從而使血管內(nèi)皮功能發(fā)生損傷。到目前為止,國內(nèi)外對PNE與EPCs的關(guān)系的研究資料非常少,雖然研究發(fā)現(xiàn)PNE、性別、年齡對EPCs數(shù)量的變化有影響,且這三者之間存在交互作用,但對其相互作用的機制尚不明確,需在以后的研究工作中一步深入探討。由于孕婦煙草暴露是最廣泛的產(chǎn)前損傷刺激之一[16-17]。因此,明確孕婦吸煙對動脈粥樣硬化發(fā)病的影響,有助于進一步揭示這種發(fā)生在子宮內(nèi)的程序性控制,導致子代出生后動脈粥樣硬化疾病的病理現(xiàn)象,并有助于深入理解該現(xiàn)象潛在的病理生理機制,從而對優(yōu)生優(yōu)育及心血管疾病的防治具有重要的實際意義和理論價值。

