質膜膜泡關聯蛋白的生物學功能研究進展
郭文惠,雷皓月,潘友卓,張 琦
(1.甘肅中醫藥大學 第一臨床醫學院,甘肅 蘭州 730000;2.甘肅省人民醫院 老年醫學科,甘肅 蘭州 730000)
內皮細胞是血液與組織之間的關鍵守門人。在正常條件下,內皮細胞調節組織的發育、穩態和代謝。在病理條件下,它與炎癥和腫瘤發生密切相關[1-3]。內皮隔膜是一種約40~80 nm的亞細胞結構,對生命至關重要[4],它們存在于特定血管床的毛細血管和小靜脈的內皮細胞中。隔膜是與內皮特異性結構(即窗孔、跨內皮通道、小窩和囊泡-空泡細胞器)相關的薄層蛋白質屏障,在維持血管通透性、血液及組織穩態和免疫功能方面發揮作用[5]。小窩、跨內皮通道和窗孔存在于內皮細胞子集中的亞細胞器,可調節微血管通透性[6]。質膜膜泡關聯蛋白(plasmalemma vesicle-associated protein-1,PLVAP)是隔膜已知唯一的分子成分[7]。PLVAP于全身各組織廣泛存在,多項研究表明 PLVAP與細胞膜流動性、內皮開窗功能、白細胞遷移以及血管生成功能相關[8-10]。PLVAP的表達和許多疾病有關,如腫瘤、非酒精性脂肪肝病、蛋白丟失性腸病、缺血性腦病及糖尿病視網膜病變[11-14]。PLVAP在這些疾病中表達上調,伴隨著促血管生成或促炎反應。因此,PLVAP 除了被認為是一種內皮細胞標記物外,還被認為是一種新的治療靶點。本文就PLVAP的結構、功能及其在病理生理過程中的作用作一綜述。
1 PLVAP的蛋白結構
PLVAP是一種脊椎動物基因,是高度糖基化的Ⅱ型整合膜糖蛋白,這種蛋白質,也稱為PV-1、PAL-E和MECA-32抗原[15]。PLVAP相對分子質量為55~65 k,可原位形成二聚體并在生理pH下與肝素結合[15]。在人類中,PLVAP有一個短的(27個氨基酸)細胞內尾巴和一個長的(358個氨基酸的)細胞外C端結構域[15-17]。PLVAP的胞內結構域由兩段相同的短氨基酸組成:一個緊鄰跨膜區(8個氨基酸),包含一個假定的小窩蛋白-1結合域[18],另一個位于N端(8個氨基酸),可能在PLVAP的生物學中起作用。胞外結構域由4個N-糖基化位點、1個靠近C端的富含脯氨酸的區域和2個大的卷曲螺旋結構域組成。卷曲螺旋結構域的α螺旋的每7個氨基酸都是疏水的,以促進分子間超螺旋的形成[19]。見圖1。
PLVAP是以八角形的輪狀對稱性排列在隔膜中,PLVAP二聚體可形成放射狀纖維[18]。PLVAP大部分由其細胞外結構域組成,跨膜結構域占PLVAP總質量的15%,通過跨膜結構域附近的顯著糖基化位點防止PLVAP二聚體塌陷[19]。此外,細胞內通過直接結合或細胞骨架連接分子與細胞骨架的連接,進一步穩定膜內PLVAP。
2 PLVAP的蛋白表達模式
PLVAP基因編碼于哺乳動物中高度保守的蛋白質家族,PLVAP mRNA在大多數器官和組織中表達,在肺、腎、脾、所有內分泌腺和消化道中水平最高[15],在大血管、心臟、骨骼肌、皮膚、腦和睪丸中的水平適中[19]。遺傳譜系顯示PLVAP在心內膜的毛細血管和小靜脈的內皮細胞中特異性表達,而在淋巴管內皮細胞中不存在。然而,也有研究發現在外周淋巴結的竇淋巴管內皮細胞中證實了PLVAP表達,同時證實了在其他的外周淋巴管中不存在[7]。
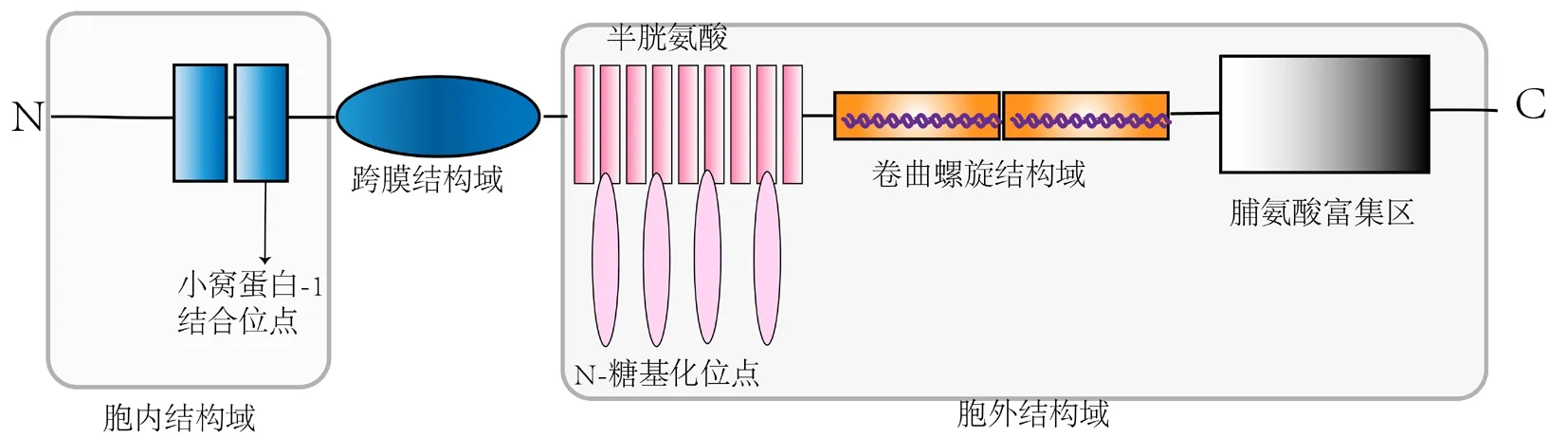
圖1 PLVAP的蛋白結構
3 PLVAP的調控
血管內皮生長因子(vascular endothelial growth factor,VEGF)可刺激血管通透性增加和血管生成,是PLVAP的主要調節因子。多項研究表明,VEGF正向調節PLVAP的表達。Strickland等[20]證明VEGF通過激活VEGF受體2增加了人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVECs)上PLVAP的mRNA和蛋白質表達水平,用磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)抑制劑LY294002或p38絲裂原活化的蛋白激酶(p38 mitogen-activatedprotein kinase,P38 MAPK)抑制劑SB203580可導致PLVAP表達水平降低。因此推測VEGF誘導PLVAP的表達可能與PI3K和P38 MAPK信號通路有關。與此相一致,Hofman等[21]研究得出微血管滲漏條件下視網膜內皮細胞上PLVAP表達增加與VEGF有關,提示VEGF可直接或間接誘導PLVAP。然而,關于VEGF調節PLVAP的表達也有爭議。有研究表明在小窩蛋白-1缺失的小鼠中肺PLVAP的表達受到負向調控,而相同實驗條件下,小窩蛋白-2缺失的小鼠PLVAP的表達未受影響[22]。引起這些結果的原因可能與其他內皮蛋白,如小窩蛋白-1有關。此外,VEGF對PLVAP表達的影響可能因不同器官或者不同物種而異。
肉豆蔻酸佛波醇(phorbol myristate acetate,PMA)是蛋白激酶C的激活劑,PLVAP的表達已被證明受PMA的調節[22]。PMA在原代培養的內皮細胞中可以誘導大量窗孔、跨內皮通道和小窩形成[23]。除此之外,PMA還可誘導PLVAP的表達。有研究用PMA作用于HUVECs,PLVAP mRNA顯著增加;然而,當存在蛋白質合成抑制劑環己酰亞胺(cycloheximide,CHX)的情況下,PLVAP mRNA及蛋白質表達沒有增加。在下游通路方面,抑制絲裂原活化蛋白激酶激酶1(mitogen-activated proteinkinase kinase 1,MEK1)/細胞外信號調節激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)抑制PLVAP的上調,而抑制p38和JNK MAP激酶或PI3K和Akt對PMA誘導的PLVAP表達無影響。因此,可推斷PMA上調PLVAP是通過MEK1/Erk1/2信號通路來發揮作用[24]。總之,VEGF與其他分泌蛋白協同作用,以MEK1/Erk1/2依賴性方式上調PLVAP,使我們進一步了解內皮隔膜的基本結構PLVAP的起源。見圖2。
VEGF通過激活PI3K和P38MAPK信號通路刺激PLVAP的表達。PI3K抑制劑LY294002和P38MAPK抑制劑SB203580降低PLVAP的mRNA和蛋白表達水平。PMA通過激活MEK1和ERK1/2信號通路刺激PLVAP的表達,并誘導窗孔、跨內皮通道和窗孔生成。
在最近的研究中發現,刺激性G蛋白α亞基(stimulatory G-protein α subunit,Gsα)通過環磷酸腺苷cAMP/cAMP反應元件結合蛋白(cyclic-AMP response binding protein,CREB)信號傳導刺激PLVAP基因表達[25]。
此外,PLVAP還受血管緊張素Ⅱ[26]、WNT/β-連環蛋白信號[14]、Notch信號[27]、轉化生長因子-β、炎癥介質如腫瘤壞死因子-β和剪切應力等的調控[28]。
4 PLVAP的生理功能
4.1PLVAP 形成氣孔隔膜和窗孔隔膜 PLVAP是氣孔隔膜和窗孔隔膜的唯一已知的分子組分,可形成同源二聚體[15,29]。PMA作用于內皮細胞后,PLVAP的表達上調與氣孔和窗孔的形成有關,這些氣孔和窗孔被證明含有PLVAP[29]。此外,PLVAP基因沉默后會抑制小窩、跨內皮細胞通道和窗孔的隔膜形成[30]。PLVAP基因敲除后導致了氣孔隔膜和窗孔隔膜的完全缺失。這些發現提示,內皮細胞中氣孔隔膜和窗孔隔膜的形成需要PLVAP。目前,尚不清楚PLVAP是否是隔膜中存在的唯一蛋白質。
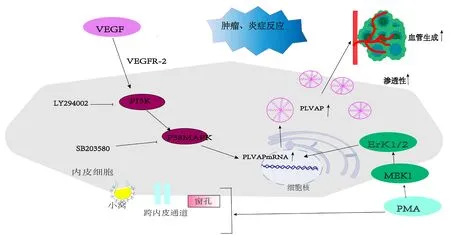
圖2 PLVAP表達的調控
4.2PLVAP調節血管通透性 PLVAP對于生成跨越內皮細胞小窩頸部區域的輻條狀隔膜結構至關重要。Stan等[5]證明了在BALB/c-C57BL/6J-129Sv/J混合背景的小鼠中,敲除PLVAP基因會由于缺乏隔膜而導致小鼠存活率降低。因為隔膜的喪失破壞了窗孔上毛細血管的屏障功能,血漿蛋白大量丟失,從而導致低蛋白血癥、高甘油三酯血癥和乳糜微粒殘留物的血漿濃度增加,最終小鼠由于嚴重的腸道、腎臟和胰腺水腫而死亡。因此,PLVAP對血管通透性的調節可能由于其屏障功能而起著至關重要的作用。
在連續型血管內皮中,燒瓶狀小窩的頸部(腦和骨骼肌除外)被一個5~7nm的隔膜所覆蓋[5]。小窩隔膜在小窩的形成、形態和運輸中的作用仍然知之甚少[4]。現已知這些隔膜的唯一蛋白質組分是PLVAP,能產生高度有序的寡聚體,負責隔膜的形成[5,29]。有研究發現敲除內皮細胞特異性PLVAP基因小鼠會出現腹腔積液和肺部出血,肺血管外水分含量也明顯高于對照組,且觀察到肺對液體和白蛋白的內皮通透性增加[31]。Jones等[32]研究表明在敲除PLVAP基因的小鼠中,可觀察到小窩隔膜的丟失及肺血管對液體和白蛋白的通透性增加。由于水和蛋白質的滲出而導致動脈壓降低,包括肺在內的多個組織的水腫形成。還觀察到,在內毒素導致的小鼠急性肺損傷模型中,PLVAP的表達顯著減少,因此肺內皮細胞的通透性增加。基于上述研究,我們推測PLVAP的主要功能是通過限制血漿蛋白如白蛋白進入小窩并通過內皮屏障轉運的能力來調節肺內皮通透性。這些結果共同表明,PLVAP是小窩隔膜的關鍵組成部分,是白蛋白攝取的關鍵限制性屏障,也是肺血管內皮細胞通透性的決定因素。
PLVAP是內皮血管通透性的重要調節因子。在胚胎發生過程中,PLVAP可直接促進血管生成或為毛細血管提供機械支持。在成熟的血管系統中,PLVAP具有關鍵的把關功能,允許小分子進入,但限制血漿蛋白的通過。
4.3PLVAP在免疫中發揮作用 免疫反應的發展與內皮細胞介導的白細胞遷移到炎癥部位有關。抑制PLVAP可減輕體內炎癥。在小鼠急性腹膜炎模型中,用PLVAP抗體MECA-32,可使白細胞遷移減少約85%,且中性粒細胞、巨噬細胞和淋巴細胞的數量均顯著減少。TNFα激活HUVECs,導致PLVAP重新分布到細胞的外周區域。此外,使用抗PLVAP抗體可顯著抑制淋巴細胞通過內皮細胞層的遷移,而滾動和黏附不受影響。這些結果表明,PLVAP是一種控制白細胞轉運的重要功能分子[10]。
PLVAP是在覆蓋遠端管道的竇壁淋巴管內皮細胞中合成的一種血管原型內皮蛋白,可調節可溶性淋巴抗原選擇性地進入導管和淋巴細胞,通過淋巴竇底部遷移到淋巴結實質。從機制上講,淋巴竇內皮的過濾功能依賴于PLVAP在內皮通道中形成的隔膜。因此,PLVAP 在淋巴竇中形成了一個物理篩子,可調節淋巴細胞和可溶性抗原的進入。敲除PLVAP基因的小鼠表現出通過竇底的淋巴細胞遷移增加。同樣,因PLVAP缺失而隔膜無法形成的情況下,淋巴細胞向外周淋巴結的遷移也會增加[7]。當PLVAP形成的隔膜與抗體相互作用時,在竇-皮層界面處禁止淋巴細胞進入淋巴結。這些結果表明,淋巴細胞和抗原選擇性進入淋巴結需要PLVAP,且淋巴細胞通過淋巴結竇-皮質界面的遷移是由PLVAP介導的[7]。
綜上,PLVAP通過促進炎癥部位的白細胞滲出、控制外周淋巴結形態和可溶性抗原進入淋巴結導管而在免疫中發揮作用[33]。
5 PLVAP與疾病
5.1腫瘤 關于癌組織,首次在惡性膠質瘤微血管中觀察到PLVAP與窗孔增加、灌注不良和高滲透性有關[34]。PLVAP通常在成人肺、腎和內分泌組織中表達,但在中樞神經系統中被抑制,并與血腦屏障的完整性有關。Carson-Walte等[35]研究表明,PLVAP在多形性膠質母細胞瘤患者的內皮細胞中顯著上調,但在顳葉癲癇患者(非腫瘤對照)中表達降低,且發現在HUVECs上PLVAP表達是上調的,證實了中樞神經系統惡性腫瘤和PLVAP表達之間的直接聯系[36]。此外,發現了VEGF和肝細胞生長因子可誘導PLVAP表達,這表明神經膠質瘤分泌這些生長因子可能會增加PLVAP的表達。Wang等[37]研究發現與非腫瘤組織相比,膽管癌組織中的PLVAP表達水平顯著更高。另外,熊志勇等[38]研究了肝癌組織及癌旁組織中PLVAP的表達水平,結果顯示肝癌組織中PLVAP明顯高于癌旁組織。因此,證明了PLVAP表達水平與肝癌的發生發展密切相關。除上述疾病,在近年來的研究中發現,PLVAP與結直腸癌[39]、胰腺癌[40]、黑色素瘤[41]均相關。PLVAP在腫瘤中廣泛表達,原因可能是PLVAP通過VEGF促進了血管生長。
5.2中樞神經系統疾病 血腦屏障完整性是維持神經元功能所需微環境的關鍵[42]。血腦屏障的缺陷會導致神經系統疾病。Laksitorini等[14]研究證明將乙醇作用于永生化人腦微血管內皮細胞,可導致Wnt/β-連環蛋白信號的下調、緊密連接蛋白表達的減少和PLVAP的上調。而Wnt/β-catenin 信號可以改善腦內皮細胞血腦屏障表型,導致PLVAP下調。在缺血性腦病中,血腦屏障受損導致微血管通透性增加和細胞外積液,從而出現腦缺血、缺氧并最終導致死亡。在急性缺血患者的腦組織中檢測到PLVAP表達上調,推測PLVAP可能在缺氧環境下表達[43]。在患有局灶性腦缺血的C57/B6小鼠模型中,可觀察到PLVAP染色為陽性,并且5天后檢測到PLVAP顯著上調。此外,有PLVAP陽性表達的細胞均位于缺血性損傷周圍的區域[43]。
5.3肝臟疾病 有研究表明PLVAP與肝竇功能障礙有關。Herrnberger等[44]研究敲除PLVAP基因,細胞窗孔結構內膜、小窩和跨膜通道的形成均受損。通過敲除PLVAP基因的C57BL/6N小鼠研究表明:肝臟 PLVAP的缺乏導致肝臟毛細血管床數量顯著減少,肝竇內皮窗孔形成受損,窗孔數量明顯減少,小鼠出現明顯的高脂血癥,肝臟發生廣泛的脂肪變性和脂肪性肝炎。Desroches-Castan等[45]研究發現,敲除骨形成發生蛋白9(bone morphogenetic proteins,BMP9)基因的小鼠PLVAP表達下調,窗孔數量顯著減少,在肝竇內皮細胞中加入BMP9可以維持PLVAP的水平,控制去窗孔化,從而防止血管周圍肝纖維化。以上研究提示 PLVAP在肝竇內皮細胞窗孔調節、基底膜形成、脂質運輸及肝竇功能中起重要作用。
5.4蛋白丟失性腸病 蛋白丟失性腸病(protein-Losing enteropathy,PLE)是由于黏膜完整性破壞或淋巴管異常導致胃腸蛋白滲出,其主要特點是低蛋白血癥和高甘油三酯血癥。已有多例病例報告報道了PLVAP基因突變引起PLE。PLVAP的缺失導致內皮窗孔隔膜的破壞。因此,PLVAP突變導致內皮窗孔隔膜缺失,血漿蛋白滲出過多從而導致蛋白丟失性腸病,最終死亡[46]。
5.5糖尿病黃斑水腫 VEGF等因素誘導的血視網膜屏障(blood-retinal barrier,BRB)特性喪失是糖尿病性黃斑水腫(diabetic macular edema,DME)的重要原因[46]。在之前研究中發現視網膜毛細血管中PLVAP的表達與BRB破壞有關,并且與DME中血管通透性增加相關。DME是糖尿病視網膜病變患者最常見的視力喪失原因[47]。BRB的破壞會導致蛋白和液體異常流入視網膜組織,從而導致中心凹增厚和視力喪失。VEGF-A是血管通透性和血管生成的有效誘導劑,是這一過程中的主要介體[48-49]。為了模擬DME體內的病理生理,用VEGF刺激牛視網膜血管內皮細胞,小窩蛋白-1和PLVAP mRNA表達水平增加[50]。此外,以細胞為基礎的酶聯免疫吸附試驗檢測到,VEGF作用于牛視網膜血管內皮細胞72h后PLVAP含量顯著增加[51]。Wisniewska-Kruk等[52]研究使用慢病毒轉染的shRAN或siRNA來抑制小鼠PLVAP的表達,會導致體內和體外VEGF誘導的熒光示蹤劑BRB通透性的降低。PLVAP在正常BRB中表達很低,但高糖和VEGF可誘導其表達,導致通透性會增加。根據以上研究表明,PLVAP在調節BRB的通透性方面發揮重要作用。見表1。

表1 PLVAP與相關疾病
6 PLVAP作為治療靶點
由于PLVAP可促進癌癥中的血管生長,因此它被認為是癌癥治療的新靶點[35]。PLVAP與多種腫瘤的血管生成有關,體內PLVAP靶向治療已被證明對肝細胞癌和胰腺癌有效[40,53]。PLVAP被鑒定為在肝細胞癌血管內皮細胞中特異性表達且在非腫瘤肝組織中不表達的基因,將人組織因子(human tissue factor,TF)胞外結構域的重組單克隆抗PLVAP抗原結合片段(antigen-binding fragment,Fab)輸注到主要的腫瘤供血動脈中,可誘導腫瘤血管血栓形成和廣泛的腫瘤壞死。這項研究的結果表明,抗PLVAP Fab-TF可用于治療目前使用經導管動脈化療栓塞的肝細胞癌病例,并可能避免化療栓塞乳劑黏度高的缺點,從而改善治療效果。抗PLVAP Fab-TF 可能成為晚期肝臟疾病和肝功能受損患者的可行治療劑[53]。Wang等[37]研究發現膽管癌細胞中PLVAP表達上調,且增加了內皮細胞的血管生成,可能與PI3K/蛋白激酶Bα,(protein kinase B α,Akt)/細胞骨架相關膜蛋白4(cytoskeleton-associated membrane protein,CKAP4)相關,證明了攜帶CKAP4和PLVAP過表達的腫瘤患者預后不良。因此,Dickkopf相關蛋白1(dickkopf-related protein 1,DKK1)/CKAP4/PI3K/PLVAP通路增加膽管癌的血管生成,是潛在的抗血管生成靶點。
除了肝癌、膽管癌,抗PLVAP Fab-TF 還可能用于治療惡性膠質瘤。PLVAP在各類腫瘤中均有表達,因此也可以在這些疾病中被確定為一種可能的治療靶點。
除了作為腫瘤疾病的治療靶點,PLVAP療法作為DME更安全的新型治療具有巨大潛力[54]。PLVAP在BRB病理狀態下的選擇性表達,使PLVAP成為預防DME的一種新的有希望的治療靶點。
以RNA為基礎的治療是新興的和有前途的一類藥物,但技術障礙阻礙了這些藥物的廣泛應用。脂質納米粒(lipid nanoparticles,LNPs)作為非常有前景的多種治療劑載體,已備受關注。因PLVAP維持血管完整性且與小窩蛋白有關聯,在肺中高表達,將LNP包裹的mRNA與抗體共價結合,特異性結合PLVAP作為靶向肺組織的手段,以包裹mRNA的非靶向抗體同型LNP作為對照。Li 等[55]研究發現與對照LNPs相比,PLVAP靶向LNPs的全身給藥顯示mRNA向肺部的遞送顯著增加,并使肺部蛋白質表達提高了40倍。將 mRNA 靶向遞送至肺部是治療肺部疾病的一種有前途的方法。同樣的,Marchetti等[56]研究發現在博萊霉素誘導的特發性肺纖維化小鼠模型中,αPV1與前列腺素E2(一種已知的抗纖維化劑)偶聯顯著降低了膠原蛋白含量和纖維化,而非靶向前列腺素E2抗體偶聯物未能減緩纖維化進展。結果表明,PLVAP靶向給藥可用于向肺部提供治療,這種方法可能適用于各種肺部疾病。
除作為上述疾病的治療靶點,PLVAP在日本腦炎病毒感染的小鼠腦和神經細胞中均顯著上調,將PLVAP基因沉默后可致病毒載量減少,表明PLVAP是控制日本腦炎病毒進入和神經元中繁殖的關鍵細胞受體[57]。關于PLVAP作為疾病的治療靶點見表2。

表2 PLVAP作為疾病治療的靶點
7 小結
PLVAP被確定為某些內皮細胞窗孔和小窩相關的隔膜結構成分,由于小窩、跨內皮通道和窗孔都被認為與內皮細胞通透性和(或)跨內皮轉運有關,因此PLVAP不僅具有結構重要性,而且還可能參與調節內皮細胞通透性和運輸。PLVAP具有血管內皮特異功能,PLVAP基因缺失的小鼠由于嚴重的腸病和腸道、腎臟和胰腺水腫而過早死亡,這可能是因為小窩橫隔膜丟失以及增加了肺血管液體和蛋白質的通透性。PLVAP還在免疫中發揮著重要作用。PLVAP存在于淋巴竇的淋巴管內皮細胞中,形成了一個物理篩子,有助于抗原和淋巴細胞從淋巴竇選擇性進入淋巴結實質。
在病理發展過程中,PLVAP參與了腫瘤、肝臟疾病、PLE、DME等多種疾病的發生,可能是因為PLVAP參與對血管屏障的破壞、促進了血管生成,且導致血管通透性增加。且近年來研究發現PLVAP在多種疾病中可作為治療靶點。但對于PLVAP的產生機制、作用通路等問題還不夠明確,需要進一步的研究。隨著未來對PLVAP更加深入的研究,PLVAP有望為成為靶向藥物提供新的思路。

