STEMI伴多支血管病變患者非梗死相關動脈的處理時機
周漢力 夏中華 黃興杰 林創標 劉瓊 黃敏 周國良 張羽中
ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)是冠心病最嚴重的臨床類型,占急性心肌梗死的25%~40%。目前發現STEMI患者約41%~67%除梗死相關血管(infarct-related coronary artery,IRA)外同時合并多支血管病變(multi-vessel disease,MVD),即除罪犯血管外至少合并1支狹窄≥50%的直徑>2 mm的血管病變[1]。與單支血管病變相比,合并MVD尤其是合并1支或多支血管狹窄≥75%的患者主要心血管不良事件(MACE)發生率更高,臨床預后更差[2]。有研究報道單支病變和MVD急性心肌梗死患者90 d的全因死亡率分別為3.1%和6.3%,合并MVD是患者死亡與再梗死的獨立危險因素[3]。以往指南在STMEI伴MVD患者處理策略上推薦急診PCI開通IRA,術后擇期對non-IRA進行血運重建(Staged PCI)的治療方法是安全可行。然而歐美指南推薦對合并心源性休克的患者的SETMI患者建議同期處理non-IRA,但是對于對血流動力學穩定的患者不推薦同期處理non-IRA,建議出院前對non-IRA血運重建[4,5],國內指南均不推薦對血流動力學穩定患者的non-IRA進行急診PCI[6,7]。對血流動力學穩定的患者non-IRA血運重建的時間仍然存在爭議[8]。我國急性心肌梗死平均住院時間為7~14 d,本研究將結合臨床實際合理設立分期PCI時機,對患者進行隨訪最后比較分析不同處理時機預后情況,為國內STMEI合并MVD的PCI治療策略制定提供依據。報告如下。
1 資料與方法
1.1 一般資料 選擇2019年1月至2020年8月在桂林醫學院第二附屬心內科治療的STEMI患者共282例,其中合并MVD而且符合入組標準的126例被納入本研究,男103例,女23例;平均年齡(60.58±11.30)歲。所有患者的隨訪截止時間為2021年5月。本研究得到醫院倫理委員會的審批,患者均簽署知情同意書。
1.2 納入與排除標準
1.2.1 納入標準:①符合中華醫學會制定的《ST段抬高型急性心肌梗死患者的診斷與治療標準》的STEMI診斷標準[6];②癥狀發作12 h內行急診PCI治療;③冠狀動脈造影證實除罪犯血管外至少合并1支狹窄≥75%的主要血管病變,即:除罪犯血管外至少合并1支狹窄≥75%的主要血管病變(直徑>2 mm);④無抗凝、抗血小板治療禁忌證。
1.2.2 排除標準:溶栓失敗后行補救PCI,急診PCI失敗,既往行冠狀動脈旁路移植術,慢性閉塞病變,急性感染性疾病,血液疾病及惡性腫瘤等慢性病等患者以及研究資料不完整者。
1.3 方法
1.3.1 根據對non-IRA血運重建時間將患者隨機分為3組,A組:急診PCI同時處理non-IRA 共44例;B組:急診PCI開通IRA,3~10 d時間內處理non-IRA;C組:急診PCI開通IRA,11~60 d時間內處理non-IRA;術前術后均給予患者急性冠脈綜合征常規藥物治療,包括抗血小板聚集、他汀類降脂穩定斑塊等藥物。
1.3.2 記錄患者的吸煙、性別、高血壓、冠心病及糖尿等臨床資料;收集三酰甘油、總膽固醇、低密度脂蛋白、高密度脂蛋白、肝功能(ALT、AST)和腎功能(肌酐)等實驗室數據;記錄患者的左心室舒張末期直徑(LVDD)、左心室射血分數(LVEF)以及入院時心功能killip分級等基線資料。
1.3.3 記錄冠狀動脈造影結果及PCI相關資料:造影結果由兩名介入經驗豐富的獨立術者判讀,本研究將除罪犯血管外至少合并1支狹窄≥50%的直徑>2 mm血管病變,定義為MVD,合并左主干病變也歸類為MVD;左前降支、左回旋支及右冠狀動脈均存在狹窄≥50%病變定義為三支病變。
1.3.4 研究終點為在中位數14(8,26)個月的隨訪期內患者出現MACE,包括:全因死亡、心原性死亡、非致死性心肌梗死、靶血管或者非靶血管再次血運重建、及因心力衰竭或心絞痛再入院。
2 結果
2.1 3組一般資料及影像學相關資料
2.1.1 3組一般資料:3組年齡、性別比、吸煙、冠心病、高血壓、糖尿病等差異無統計學意義(P>0.05);使用阿司匹林片、替格瑞洛片、他汀類、ACEI/ARB、利尿劑等用藥史無差異(P>0.05);丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、三酰甘油、總膽固醇、低密度脂蛋白、高密度脂蛋白、肌酐等實驗室檢測結果無明顯差異(P>0.05);Killip≥Ⅱ級、左心室舒張末期直徑(LVDD)、左心室射血分數(LVEF)等心功能指標差異無統計學意義(均P>0.05)。見表1。
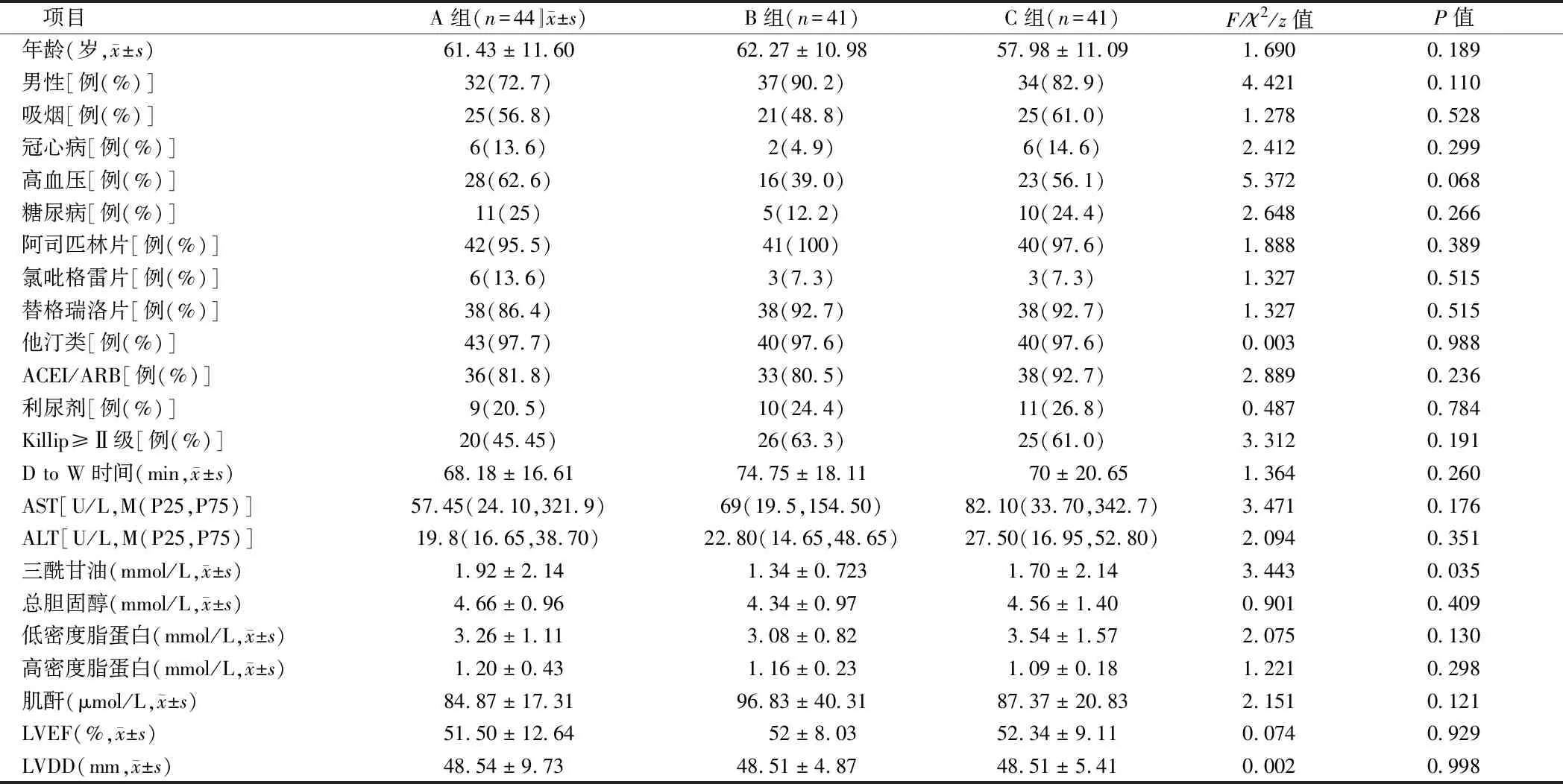
表1 3組患者基線資料比較
2.1.2 冠狀動脈造影和PCI結果資料比較:3組患者中三支病變的占比A組為29(65.9%),B組18(43.9%),C組16(39.0%),差異有統計學意義(P=0.030);IRA及術前TIMI血流分級、術后血流TIMI分級、支架植入數量及植入支架長度均無明顯差異(均P>0.05),non-IRA的分布及狹窄程度、non-IRA植入的支架數量及植入支架長度均無明顯差異(均P>0.05)。見表2。
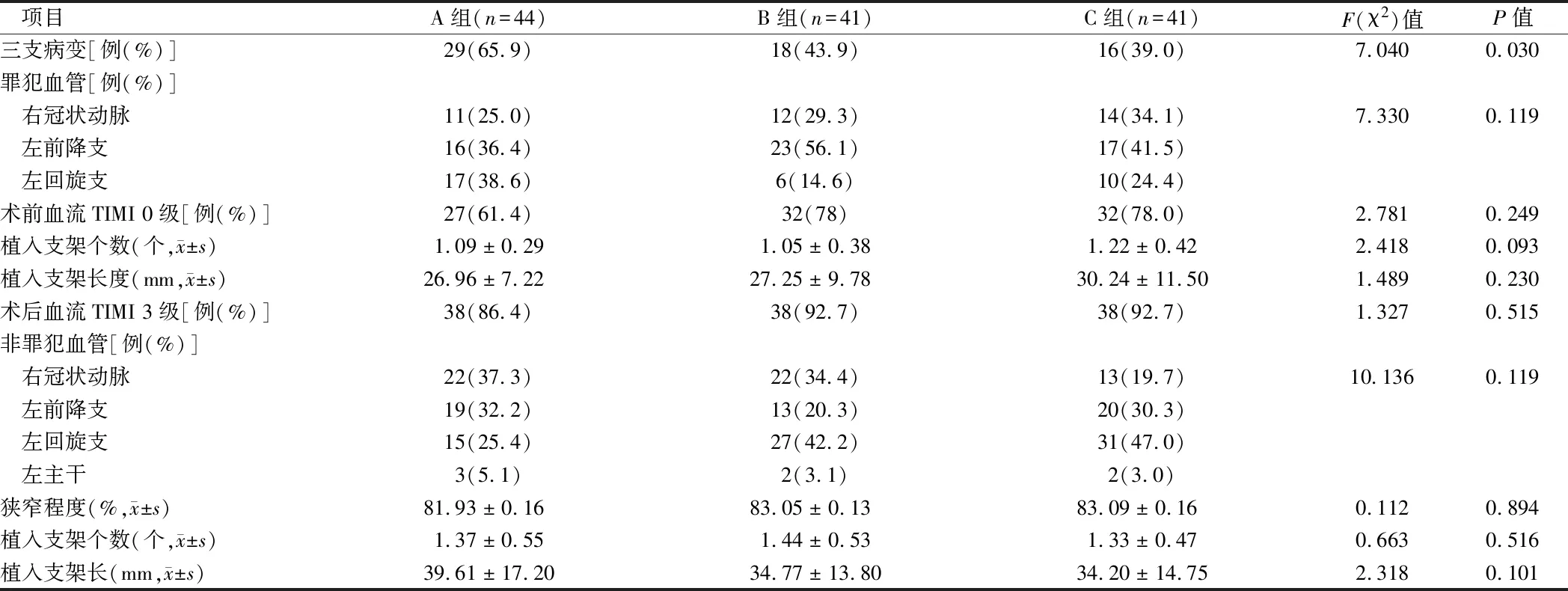
表2 冠狀動脈造影和PCI結果比較
2.2 臨床隨訪結局
2.2.1 3組患者隨訪期間內出現MACE情況:A組有7例(15.9%),B組有9例(22.0%)及C組有16例(39.0%)發生MACE總事件,組間比較差異有統計學意義(P<0.05)。但是在全因死亡、心源性死亡、非致死性心肌梗死、再次血運重建及因心力衰竭或心絞痛再次住院的發生概率方面,3組間比較差異無統計學意義(均P>0.05)。 3 組患者無MACE生存率比較差異有統計學意義(Log Rank,P=0.030)。見表3,圖1。
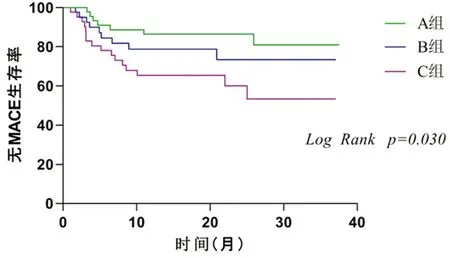
圖1 3組患者無MACE的K-M生存曲線

表3 3組患者隨訪臨床終點事件比較 例(%)
2.2.2 Cox回歸分析:以是否發生MACE為因變量,檢驗納入標準α=0.05,排除標準設為α=0.1,通過單因素Cox回歸對各自變量進行篩選,最后結果顯示分組情況、高血壓、性別、Killip≥Ⅱ級、高血壓、肌酐及三支病變等自變量有統計學差異,將單因素篩選出的自變量納入多因素Cox回歸模型得到處理non-IRA時間11~60 d、高血壓及Killip≥II級是患者發生MACE的獨立危險因素。其中C組MACE發生風險高于A組(HR: 2.681,95%CI:1.064~6.758,P=0.037),B組MACE發生風險高于A組(HR: 1.188,95% CI: 0.374~3.776,P=0.770),但是差異無統計學意義(P=0.770)。見表4。
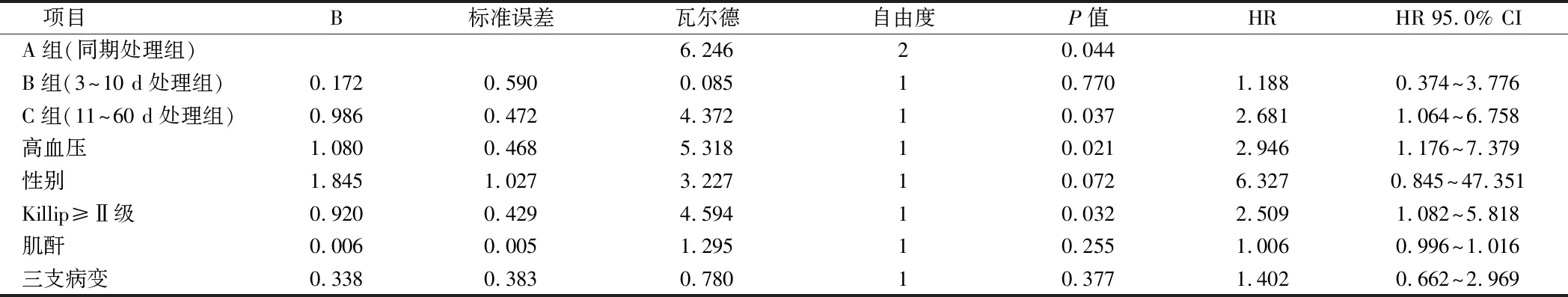
表4 MACE的Cox回歸分析結果
3 討論
本研究結果顯示同期處理non-IRA組MACE發生率為15.9%,3~10 d處理組為22.0%,而11~60 d處理組為39.0%,11 d以后處理non-IRA的MACE發生率最高,多因素Cox回歸風險模型顯示C組MACE發生率高于A組(HR: 2.681,95%CI:1.064~6.758,P=0.037),B組高于A組發生MACE的風險為(HR: 1.188,95% CI: 0.374~3.776,P=0.770),但差異無統計學意義(P>0.05)。與同期對non-IRA進行PCI和3~10 d的早期對non-IRA進行PCI相比,11 d后對non-IRA進行PCI發生MACE風險最高,出院前對STEMI患者non-IRA行PCI術可明顯改善預后。本研究還發現了合并高血壓病及入院時心功能Killip≥Ⅱ級是STEMI患者發生MACE的獨立危險因素。
目前針對STEMI合并MVD需要干預non-IRA的情況有3種PCI策略:(1)僅處理IRA,術后進行規范藥物治療;(2)在PCI術中同時處理IRA和全部或部分non-IRA;(3)PCI術中僅處理IRA,術后擇期處理non-IRA(Staged PCI)。從2013年的PRAMI研究開始,CvLPRIT研究、DANAMI-3 PRIMULTI研究結果相繼提示相比于僅處理IRA的策略,對non-IRV進行血運重建具有更低的MACE發生率,而在手術安全性方面鮮有差異[9-12]。因此2014年ECS以及2021年ACC/AHA介入指南中對血流動力學穩定的患者急診PCI術中進行嚴重狹窄的non-IRA血運重建的推薦等級由Ⅲ級(B級證據)改為Ⅱb級(B級證據)[13]。但是2017年、2018年歐洲的兩部相關指南發布的STEMI管理指南則直接提出應考慮在出院前常規對non-IRA進行血運重建(Ⅱa級推薦,A級證據),對合并心源性休克患者在處理IRA以后,建議進行處理non-IRA(Ⅱa級推薦,C級證據)[4,14]。
然而筆者發現目前國內外關于處理non-IRA的最佳處理時機尚無定論。目前可以明確的是國內外研究staged-PCI時間均在60 d以內進行,并且多數在住院期間同期完成,但是均未明確具體在哪個時段行staged-PCI能使患者有更多獲益。Kim等[8]研究發現7 d以后行處理non-IRA組患者MACE發生率明顯高于急診PCI同時處理non-IRA組(P<0.05),但7 d內行處理non-IRA組患者與急診PCI同時處理non-IRA組MACE發生率無明顯差別,提示STEMI合并MVD患者在首次PCI干預IRA之后,盡快行staged-PCI干預non-IRA可能更安全,對患者有更好獲益。Kim等[8]的研究結果與2017歐洲指南推薦一致,值得關注的是他研究的對象為亞洲人群,因此其結論與國內研究具有可比性。
在國內早在2015年耿學峰等[15]在對704例急診PCI術患者研究中認為對合并MVD的急性心肌梗死患者,在行急診PCI后7 d內對non-IRA采取積極的PCI策略是安全可行的。但是田相亭等[16]認為:心肌梗死后第28~35天干預AMI患者non-IRA可能更有利于改善患者的預后;李曉寧等[17]認為急診PCI一次性完全血運重建風險較大,心肌梗死后31~60 d為干預AMI患者non-IRA的較理想時機。國內學者對Staged PCI 手術實施時機有不同看法,這個可能和數年前國內各地區PCI水平發展不均衡,每一個中心PCI技術水平不一致有關。隨著介入技術水平的不斷提高,研究報道在急診PCI術后1~3 d,術后3~7 d,術后7~30 d干預non-IRA隨訪研究發現1周內干預non-IRA對STEMI合并MVD患者的預后有利[18],其結論與本研究結論相似。
本研究發現11~60 d對non-IRA進行PCI,術后患者發生MACE的風險有所增加,可能是急診PCI后早期處理non-IRA改善了心肌缺血,有助于急性心肌梗死的恢復,維持心功能,改善長期臨床預后。本研究還發現了Killip≥Ⅱ級是MACE發生的獨立危險因素,可能與本研究中發生MACE事件的患者多為三支病變有關。
有研究報道STEMI患者不只是罪犯病變處于易損狀態,non-IRA的斑塊往往也具有不穩定性,容易導致再發缺血事件以及non-IRA病變導致非梗死區域心肌供血不足,使得患者整體心功能受到更大的影響,從而增加MACE的發生[19]。長期的高血壓產生的過高的剪切力對血管內皮造成損害可增加STMEI患者MACE發生風險,閆潔等[20]研究報道了高血壓是STEMI行急診PCI術后發生MACE的獨立危險因,與本研究發現結果相似。
因此我們認為對于合并MVD的STEMI患者,干預non-IRA的最佳時機為10 d內,11 d后干預non-IRA增加MACE的發生風險。但是本研究為單中心、小樣本的前瞻性研究,結論尚需要更多多中心,大樣本量的RCT研究進一步驗證。

