SLC6A11基因多態性與耐藥性癲癇之間的關聯性的Meta分析
趙明洋 胡雪梅 王東森 吳慶建
(1.濟寧醫學院臨床醫學院,山東 濟寧,272100;2.濟寧市第一人民醫院急診內科,山東 濟寧,272011)
癲癇是由多種病因引起的慢性腦部疾病,特征是腦部神經元過度放電所致的突然、反復和短暫的中樞神經功能失常[1]。耐藥性癲癇(drug resistant epilepsy, DRE)是指正確選擇至少2 種可耐受的抗癲癇藥物單用或聯用,在服用足夠的劑量和療程后,患者在治療前最長發作間隔的3 倍或1年(取決于兩者之間哪一段更長)的時間內仍發作[2]。造成DRE 的機制主要有藥物代謝酶假說、藥物轉運體假說、受體通道結構改變假說等[3]。一旦發生DRE,往往會引起嚴重的后果,癲癇患者的生活也會被癲癇反復發作、并發癥的影響以及抗癲癇藥物的不良反應所破壞,長期的癲癇發作也使癲癇患者面臨很多心理壓力,甚至縮短生存期[4-5]。
一般來說,癲癇的耐藥性是多因素共同作用而產生的,是環境、遺傳以及疾病和藥物相互作用的結果[6]。癲癇發作與興奮性和抑制性的突觸傳遞活動之間的不平衡有關,抑制性的突觸活動由γ-氨基丁酸(γ-aminobutyric acid,GABA)介導,GABA 是哺乳動物大腦中主要的抑制性神經遞質[7]。GABA 轉運體3(GABA transporter 3,GAT-3)是大腦中主要的GABA 轉運體之一,主要表達在能與GABA 能神經元直接接觸的遠端星形細胞上,可以將突觸中的GABA 轉運至突觸前末端或周圍的星形膠質細胞,來終止GABA 能的抑制性突觸傳遞[8]。所以我們可以通過降低GAT-3 的水平來抑制GABA 的再攝取,從而抑制癲癇的發生[9]。SLC6A11位于3p25.3 的最小重疊區域,編碼GAT-3,GAT-3 的表達程度影響著GABA 能神經元傳遞的功能[10]。所以我們認為SLC6A11 基因的多態性與DRE 的產生有關。
在既往對DRE 的研究中,由于樣本量不足、研究人群不同以及在疾病的不同階段應用藥物,導致結果產生分歧。因此,本研究納入了最新研究,進行全面的Meta 分析,以評估SLC6A11 基因的多態性與DRE 的相關性。
1 資料與方法
1.1 檢索策略
采用主題詞加自由詞的檢索方式,在中國知網、萬方數據知識服務平臺和維普資訊中文期刊服務平臺、Pubmed、Embase、Cochrane、Web of Science 數據庫,并輔以文獻追溯及手工檢索等方法檢索公開發表的SLC6A11 基因多態性與DRE 之間關系的研究。納入研究的時間是各數據庫建庫開始至2022年10月26日。該搜索策略是在濟寧醫學院圖書館服務專家的指導下制訂和實施的。主要的搜索策略如下。中文檢索詞為:“SLC6A11”“耐藥性癲癇”,英文檢索詞為:“Drug Resistant Epilepsy”“Esistant Epilepsies”“Epilepsies,Medication Resistant”“Resistant Epilepsy”“gaba transporter 3”“GAT-3”以及“SLC6A11”等檢索。詳細檢索策略見補充文件1(文獻檢索策略)。
1.2 納入和排除標準
文獻納入標準:①國內外已發表的SLC6A11 多態性與DRE 的研究。②研究類型為病例對照試驗。病例組為難治性癲癇患者,對照組為藥物敏感性癲癇患者[2]。③數據完整,具備完整的基因型和等位基因頻數數據,直接提供或有足夠的數據可計算比值比(Odds Ratio,OR)和95%置信區間(Confidence Interval,CI)。④病例組和對照組均符合哈迪-溫伯格(Hardy-Weinberg,HWE)平衡定律。
文獻排除標準:①文章質量差,信息少或經各種途徑仍然無法獲取主要數據的文獻。②有數據重復或重復發表的文獻。③綜述、摘要、個案、會議文件等以及Meta 分析類文獻。④研究對象為動物模型。
1.3 數據提取
基于上述文獻納入與排除標準,由兩名研究人員單獨對納入的文獻進行數據提取并核對,提取的內容包括:第一作者、文獻發表年份、研究人群的地區國家、樣本量、癲癇患者中耐藥組和敏感組患者基因型和等位基因分布頻率。若基因型的分布是以[n(%)]表示,則將其轉化為例數錄入數據庫。若未給出等位基因分布頻率,則通過基因型分布計算得出可使用數據,詳細見表1。
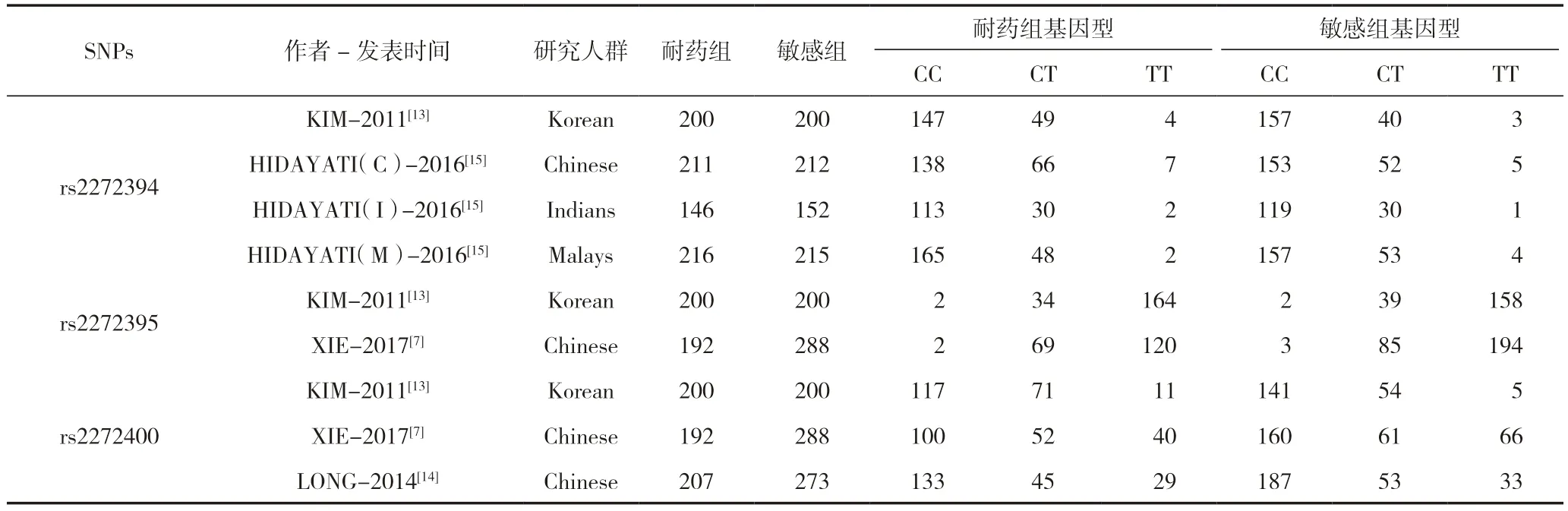
表1 4 篇文章中9 項研究探討SLC6A11 多態性rs2272394、rs2272395 和rs2272400 與DRE 的關系
1.4 數據分析
我們研究了rs2383206、rs2383207 和rs10757278 的Hardy-Weinberg 平衡;通過R 程序,我們使用χ2檢驗研究了SLC6A11 多態性與DRE 的關系[11]。采用Q 檢驗對各研究結果進行異質性檢驗,根據所得I2進行判斷。如果I2>50%,則認為存在顯著異質性,采用隨機效應模型進行數據計算;如果I2<50%,則認為異質性較低,采用固定效應模型進行數據計算[12]。采用漏斗圖和Egger’s 檢驗評估納入文獻是否存在發表偏倚。P<0.05 表示差異有統計學意義。如果異質性檢驗存在差異且有統計學意義,則對納入的研究進行逐一排除后重新計算OR 值,并與之前結果相比較,確定異質性來源。
1.5 基因模型
本研究應用以下5 種基因模型進行分析,等位基因模型(C/T),共顯性基因模型(CC+TT/CT),顯性基因模型(CC+CT/TT),隱性基因模型(CC/CT+TT)以及加性基因模型(CC/TT)。分別計算相應的OR 值及95%CI。
2 結果
2.1 檢索結果及文獻納入情況
根據檢索策略共檢索到33 篇相關文獻,通過閱讀文獻標題、摘要和全文,最終共有4 篇符合納入標準的文獻[7,13-15],檢索及篩選流程見圖1。
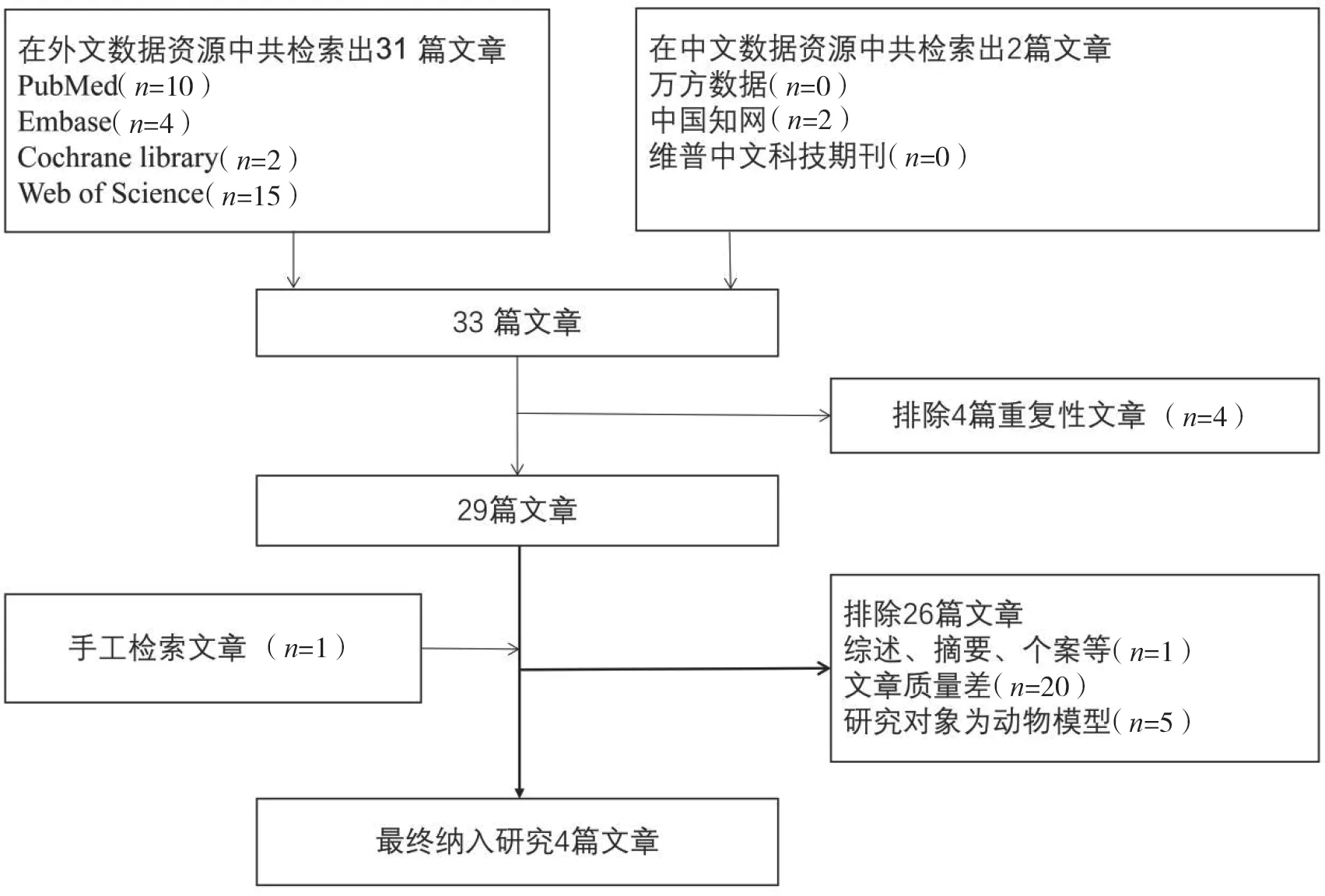
圖1 SLC6A11 基因多態性的流程圖
2.2 連鎖不平衡
經過SNIPA 驗證,rs2272394、rs2272395、rs2272400 位于同一條染色體,彼此距離為0 kb,顯示三者具有連鎖不平衡,所以我們可將三者認為是同一個基因多態性進行整合分析(https://snipa.helmholtz-muenchen.de/snipa3/)。
2.3 納入文獻研究特征
我們選取了SLC6A11 基因rs2272394、rs2272395 以及rs2272400 三種多態性,經過SNIPA 驗證,三個核苷酸距離相近,我們進行研究時可將三者進行整合分析,在納入的4篇文獻中共有9 項研究被納入Meta 分析,其中有3 項研究的單核苷酸多態性(single nucleotide polymorphism,SNP)為rs2272400,2 項研究的SNP 為rs2272395,4 項研究的SNP 為rs2272394。在納入的9 項研究中,耐藥組病例共有1 172 例,藥物敏感組病例共有1 340 例,其中4 項研究中的研究人群為中國人,3 項研究中的研究人群為韓國人,1 項研究中的研究人群為印度人,1 項研究中的研究人群為馬來西亞人,基本信息見表1 和表2。
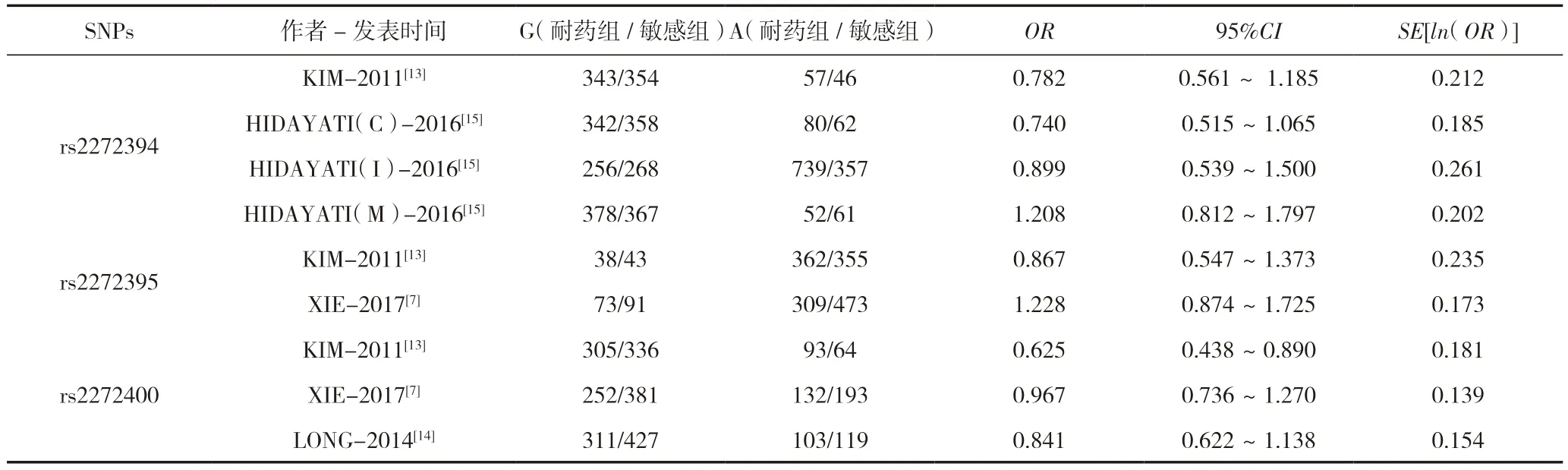
表2 SLC6A11 基因多態性rs2272394、rs2272395 和rs2272400 不同遺傳方式與DRE 易感性的相關性分析
2.4 Meta 分析結果
2.4.1 SLC6A11 等位基因Meta 分析
2.4.1.1 異質性分析
我們將9 項研究進行分析,結果顯示等位基因模型的I2=30%,所以采用固定效應模型計算,結果顯示該等位基因模型與DRE 的發生無關(P>0.05),表明該等位基因與DRE 無確切關系(OR=0.89,95%CI=0.79~1.01,P=0.18),見圖2A。

圖2 等位基因的森林圖
2.4.1.2 發表偏倚
在我們的研究中,采用的是Egger’s 分析方法,得出該9項研究不存在發表偏倚(P=0.82),本研究所形成的漏斗圖分布較為均勻,顯示本研究不存在明顯的發表偏倚,見圖3A。
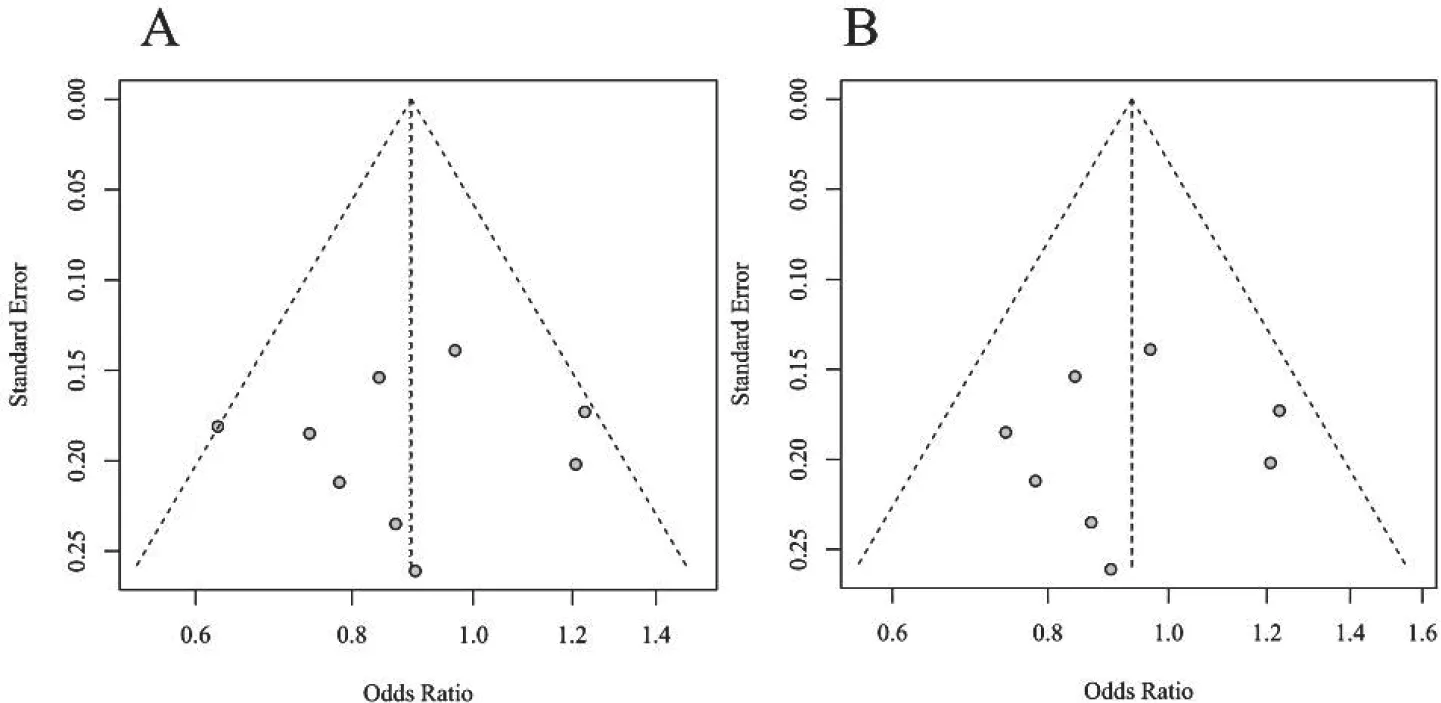
圖3 等位基因的漏斗圖
2.4.1.3 敏感性分析
本文采用逐篇剔除的方法進行敏感性分析,并未發現有對研究結果產生明顯影響的文章。
2.4.2 剔除邊緣性研究后的Meta 分析
對納入文章進行全面分析,漏斗圖分布較為均勻對稱,但有一篇文獻在漏斗圖中的位置臨近邊緣,雖未在數據上顯示存在異質性,但基于對過往試驗的經驗總結,將其剔除后再次進行分析。
在剔除邊緣性研究后的研究中,森林圖顯示異質性(I2=1%)較前明顯減小,我們采用固定效應模型進行分析,結果顯示剔除邊緣性研究后的該等位基因與DRE 仍無確切關系(OR=0.93,95%CI=0.82~1.06,P=0.42),具體結果見圖2B。剔除邊緣性研究后OR 值與總體數據差異無統計學意義,且漏斗圖分布對稱且均勻,見圖3B,說明不存在發表偏倚,結果較為穩定。
2.4.3 SLC6A11 基因模型Meta 分析
由于本研究對SLC6A11 基因分析中并未得到陽性的結果,為進一步全方位了解該基因與DRE 之間的關系,我們選取4 種主要的基因模型再次進行Meta 分析。
2.4.3.1 異質性分析
我們通過對基因模型進行分析發現,隱性基因模型不是明顯的DRE 致病基因模型(OR=0.79);顯性基因模型與DRE 不存在顯著聯系(OR=0.99);加性基因模型不會引起DRE 的明顯發生(OR=0.86);超顯性模型與DRE 之間差異無統計學意義(OR=0.83),見表3、圖4。
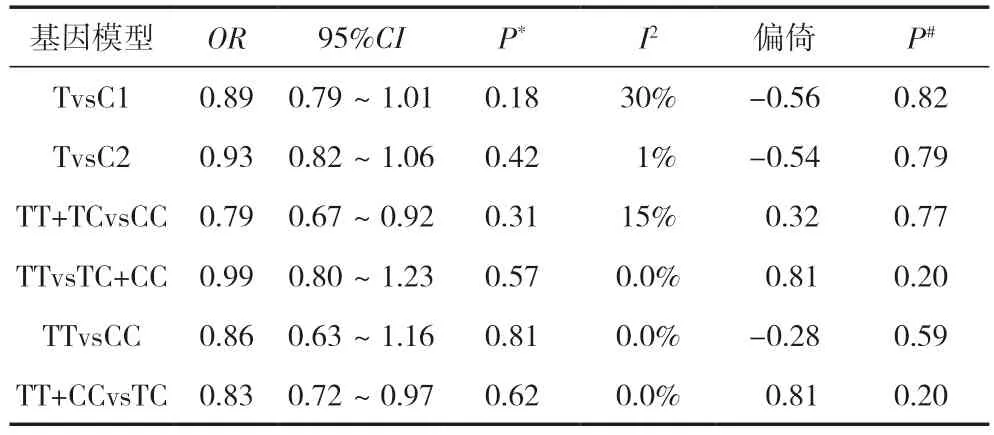
表3 SLC6A11 多態性rs2272394、rs2272395 和rs2272400五種遺傳模式與耐藥癲癇的相關性分析
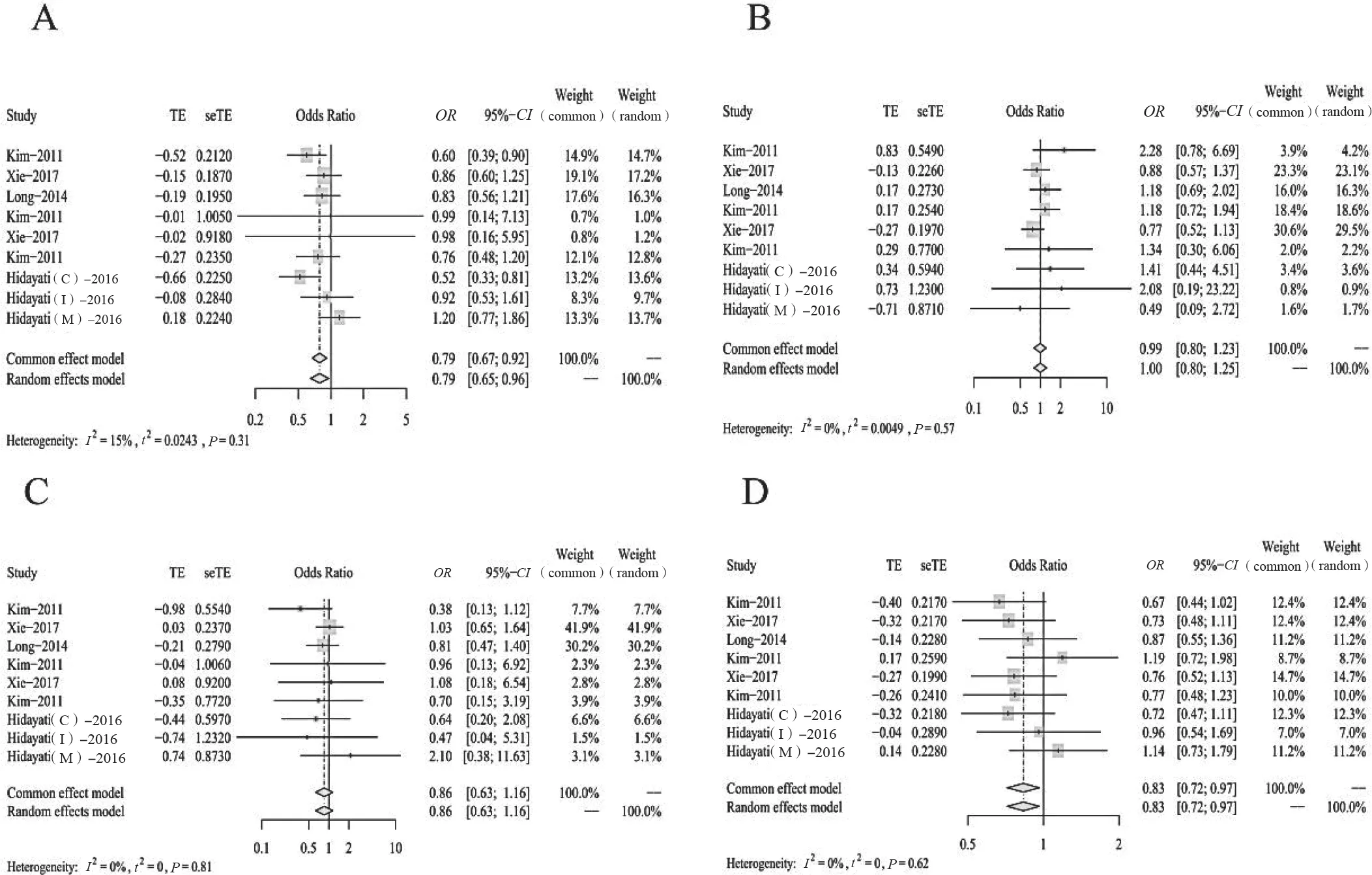
圖4 四種基因模型的森林圖分析
2.4.3.2 發表偏倚
我們對四種基因模型采用Egger’s 檢驗進行發表偏倚檢測,隱性基因模型不存在發表偏倚(P=0.77);顯性基因模型不存在發表偏倚(P=0.20);加性基因模型不存在發表偏倚(P=0.59);超顯性基因模型不存在發表偏倚(P=0.20)。各基因模型的漏斗圖分布較為均勻對稱,大部分點都位于95%區間內,見圖5,顯示本研究的發表偏倚較小。
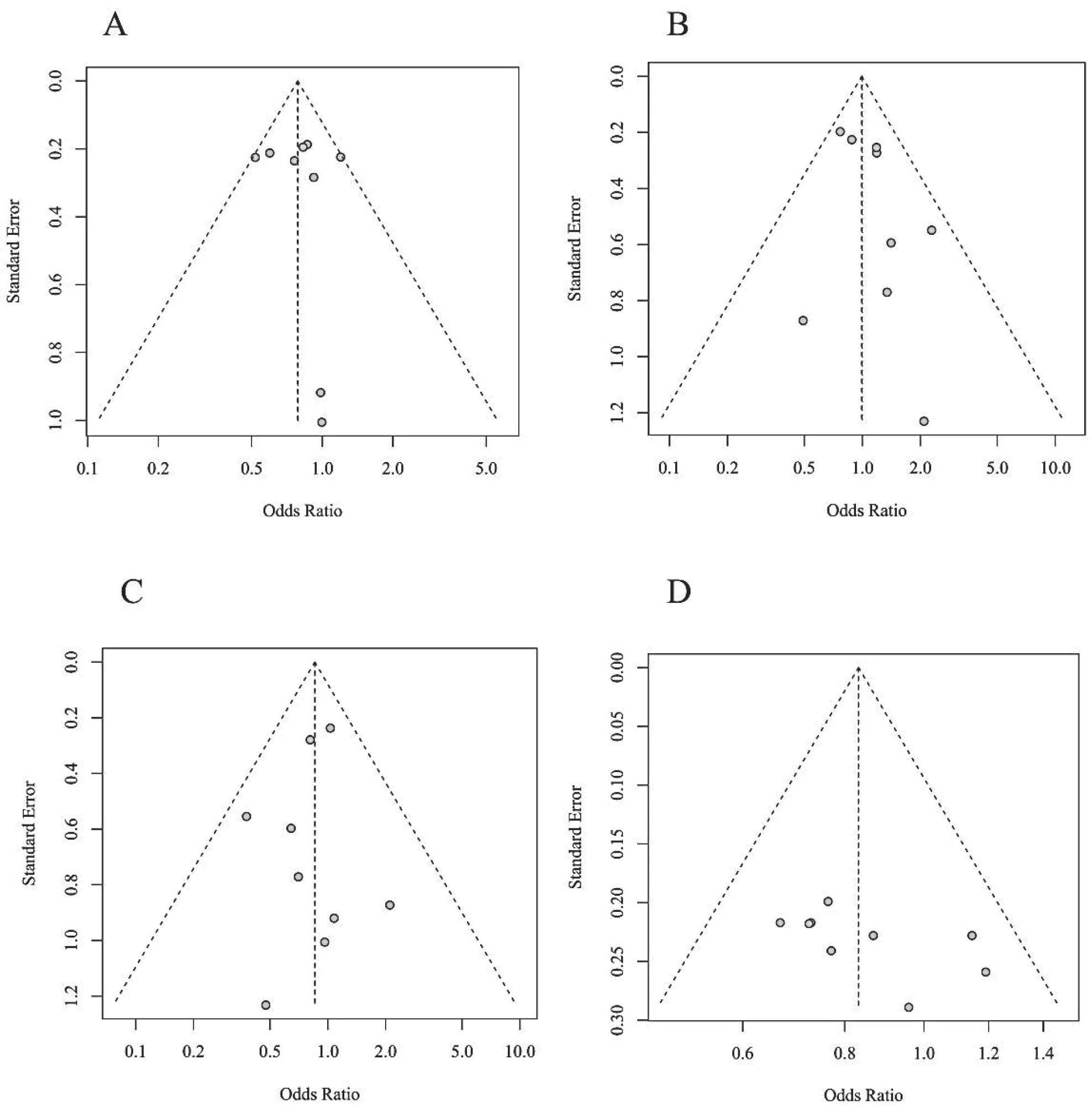
圖5 四種基因模型的漏斗圖
3 討論
癲癇在全球范圍內影響超過6 500 萬人,是最常見的慢性神經系統疾病[16]。藥物治療是目前應用較為廣泛的治療手段[17]。目前,抗癲癇藥物主要針對的是電壓門控陽離子通道或者影響GABA 介導的神經抑制,苯二氮?類藥物可增強GABA 的活性作為抗癲癇藥物使用[18-19]。GABA 轉運體可將突觸中的GABA 轉運至突觸前末端或周圍的星形膠質細胞,通過神經末梢吸收的GABA 可被包裹在神經末梢中重新利用,而被GAT-3 回收進星形膠質細胞中的GABA 可能會通過代謝而丟失[20]。SLC6A11 基因的多態性可影響GAT-3 的表達,進而影響抗癲癇藥物的治療效果,基于上述研究機制,本文通過Meta 分析進一步探究SLC6A11 的基因多態性與DRE的相關性。
2011年一項來自韓國的研究指出,SLC6A11 基因的rs2272400 會使患者抗癲癇藥物耐藥性產生的風險增加[13]。然而2014年中國學者研究中國人群中的SLC6A11 基因與癲癇耐藥性的相關性,未能得到陽性結果[14]。HIDAYATI[15]、丁晶等[7]的幾項研究均未取得陽性結果,為了明確SLC6A11與DRE 的關系,我們進行了Meta 分析,通過擴大樣本量的方法來得到更加科學的結果。在研究中,尚無明確證據證明SLC6A11 多態性與抗癲癇藥物產生耐藥性之間的關系,且進一步研究了各基因模型與癲癇耐藥性之間的關系,但仍然沒有證實SLC6A11 會增加抗癲癇藥物耐藥性產生的風險。雖然本研究嚴格按照文獻納入標準進行文章的篩選,但仍然存在不足。一方面,本研究納入文章數量過少,馬來西亞、印度人群的研究僅納入一篇文章,樣本數量不足,可能導致統計學差異,對研究的結果造成影響。另一方面,必須考慮可能存在的人群分層對研究結果的影響,在研究人群中,涉及亞洲各地區,包括韓國、中國、馬來西亞以及印度,但缺乏西方國家人群的研究,所以我們尚無法做出肯定性的結論,認為SLC6A11 基因多態性rs2272394、rs2272395、rs2272400 與癲癇耐藥性的產生無關。雖然本研究最終并沒有證實SLC6A11會增加DRE 發生的風險,但也給我們帶來了一些啟示和思考。SLC6A11 基因在不同人種之間是否存在差異性,在西方人群中是否體現與DRE 之間的相關性仍需后續的研究。
4 結論
本研究在納入的9 項研究中暫未發現SLC6A11 基因會明顯增加DRE 的發生風險。

