中性粒細胞與淋巴細胞比值對立體定向放療后非小細胞肺癌患者預后價值的meta分析
解嘯明,孫恒亮
(海安市中醫院 檢驗科,江蘇 南通 226600)
肺癌是全球范圍腫瘤相關死亡的第一大原因,嚴重威脅健康[1],由于吸煙、空氣污染和職業暴露等因素,我國肺癌患者發病和病死人數逐年上升。非小細胞肺癌(non-small cell lung cancer,NSCLC)是該病常見的類型,起病隱匿,其中20%~30%的患者在診斷時為局限期,對于這部分患者,手術雖然是推薦的主要治療方式,但部分患者存在慢性阻塞性肺疾病等基礎疾病,往往限制了手術的應用,另外,30%~50%患者會出現術后復發,大多數只能接受姑息治療,其生存時間有限[2]。立體定向放療(stereotactic body radiotherapy,SBRT)是利用圖像引導結合運動呼吸等鎖定靶區活動范圍,精準、集中多野照射,治療時間短,靶區高劑量,邊緣劑量陡峭。由于正常組織照射劑量較低,以往常規放療技術對早期NSCLC的局部控制率僅為50%,而SBRT可達到90%以上,且風險較小,SBRT還可激活免疫細胞,與免疫治療發揮協同作用。對于存在手術禁忌證或不愿手術的患者,SBRT是一種可行根治方案[3-5],另外,對于術后復發后的寡轉移患者,SBRT也有較好的優勢[6],但接受SBRT的患者中,仍然有30%以上患者會出現遠處轉移,預后較差,因此需要探索可靠的生物標志物以識別預后較差的人群,實現患者的精準管理。
炎癥反應與NSCLC等發生發展的關系密切,中性粒細胞與淋巴細胞比值(neutrophil to lymphocyte ratio,NLR)是一種常用的炎癥反應指標,可反映機體應激和免疫狀態,被認為是NSCLC等惡性腫瘤的預后指標[7]。多項研究證實NLR也可預測SBRT治療后NSCLC患者的生存和疾病復發風險,SBRT治療前NLR增高與接受SBRT治療的患者的病死率相關,此外,治療后NLR較治療前顯著增加,并與總生存率相關[8]。但有研究發現,NLR與這類患者生存無明顯相關性[9]。因此,本研究檢索全部相關研究,利用meta分析重新評估NLR在SBRT治療后NSCLC患者中的預后價值。
1 資料與方法
1.1 文獻檢測
檢索Cochrane、Embase、Web of science和PubMed數據庫,檢索時間范圍為建庫至2021年10月9日。采用以下檢索策略:“non-smallcelllungcancer/NSCLC”AND “stereotactic body radiotherapy/SBRT”AND “neutrophiltolymphocyteratio /NLR”,利用主題詞和自由詞檢索,手工檢索相關文獻。
1.2 納入和排除標準
納入標準:(1)研究所納入的患者均經病理學診斷為NSCLC;(2)接受SBRT治療前的NLR基線水平可獲得;(3)研究比較了SBRT治療后不同NLR水平患者的總生存期(overall survival,OS)、無病生存期(disease-free survival,DFS)差異;(4)研究均為英文文獻。排除標準:(1)研究為綜述、案例報道、實驗室研究或會議摘要;(2)研究包含了接受非SBRT治療的患者;(3)病例數少于20例;(4)生存結局的HR和其95%置信區間(confidence interval,CI)不可獲得。
1.3 資料提取和文獻質量評估
通過上述納入標準依次排除并篩選研究,該過程由2名研究者獨立完成,如果出現爭議,2名研究者充分討論決定最終納入研究。2名研究者獨立并嚴格完成對納入文獻的數據提取,主要研究終點為DFS和OS,以風險比和95% CI作為效應變量,多因素回歸模型計算出的HR和95% CI作為最佳選擇。
利用Cochrane循證醫學證據中心系統(2009)評估證據等級,Newcastle-Ottawa scale(NOS)文獻質量評估表[10]評價研究質量,量表中包括受試者篩選、可比性和結局評估3個方面,總分為9分,6分以上定義為高質量研究。
1.4 統計學方法
數據分析采用Stata 14.0,利用薈萃分析合并DFS和OS的HR和95% CI,χ2檢驗分析異質性,當I2>50%或P<0.05時認為研究具有異質性,須通過隨機效應模型計算,否則采用固定效應模型計算;本研究還采用逐一剔除法評估結果的穩定性;采用漏斗圖、Egger和Begg檢驗評價發表偏倚風險。
2 結果
2.1 納入研究特點
綜合4個數據庫的檢索結果,去除重復文獻后,納入174項研究,閱讀標題及摘要后排除144項不符合的研究,最主要的排除原因為實驗室研究(n=83),其次為主題不相關(n=31)。30項研究經全文閱讀篩選,排除了24項研究,最主要的排除原因為患者未接受SBRT(n=17),風險比和95% CI不可獲得為次要原因。最終7項研究(包含1 621例患者)被納入分析。見圖1。
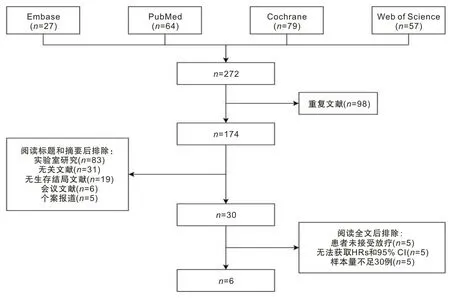
圖1 文獻篩選流程圖
7項研究均為回顧性隊列研究[9,11-16],證據等級均為2a,NOS評分6~9分,NLR的cut-off值為2.05~4.00。6項研究均報道了OS,僅2項研究報道了DFS。1項研究為復發轉移灶的SBRT治療,其余6項均為早期原發灶的根治性放療。見表1。
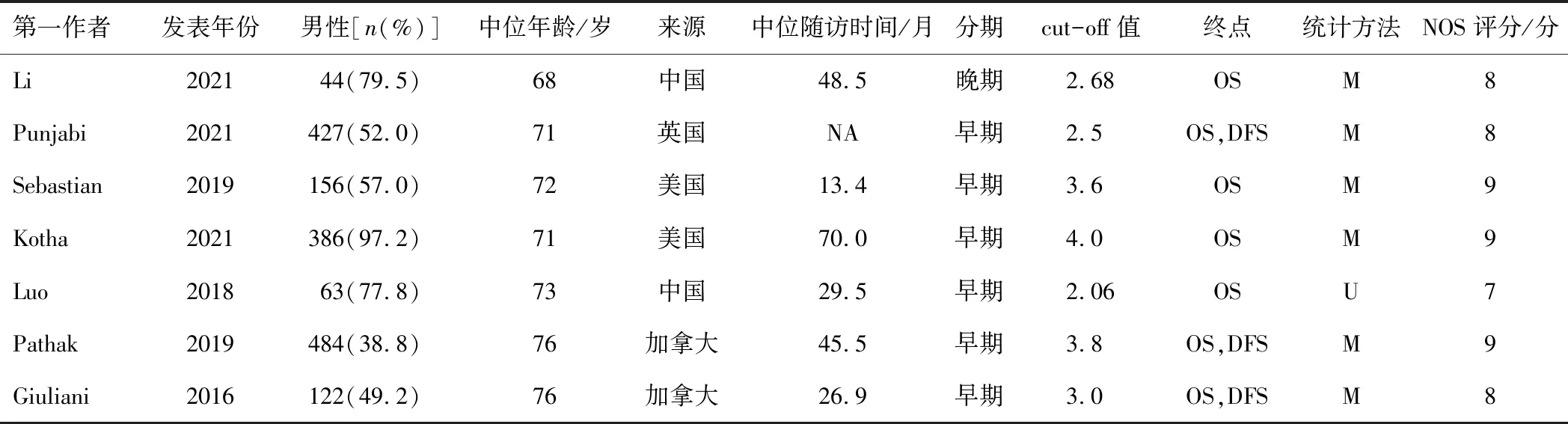
表1 納入研究的基本特征
2.2 NLR的預后價值
7項研究(包含1 621例患者)報道了NLR與OS的相關性,根據異質性檢驗結果,采用隨機效應模型分析,結果顯示,NLR升高增加了患者死亡風險(P<0.05)。3項研究(包含1 033例患者)報道了NLR與DFS的關系,采用固定效應模型分析,結果顯示,NLR升高同樣增加了SBRT后NSCLC患者復發的風險(P<0.05)。見表2、圖2。
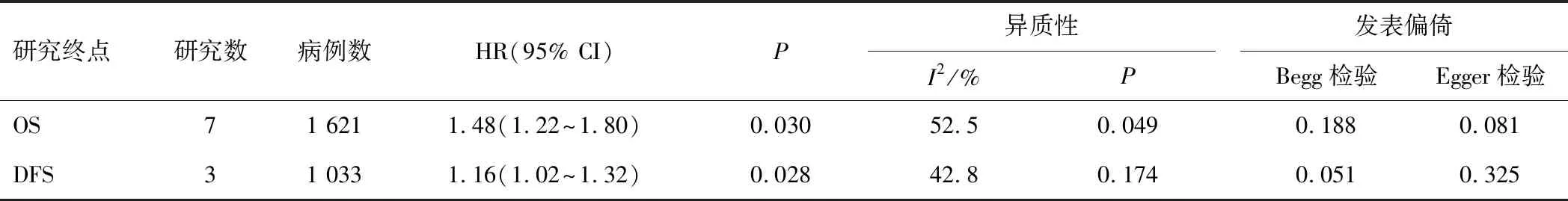
表2 NLR的預后價值

A為NLR與OS的相關性;B為NLR與DFS的相關性。
2.3 敏感性分析和發表偏倚分析
本研究采用逐一剔除法評估結果的穩定性,結果顯示穩定性較好。漏斗圖結果顯示了較好的對稱性,結合Egger和Begg檢驗(P均>0.05),說明本研究偏倚風險較小。見圖3。
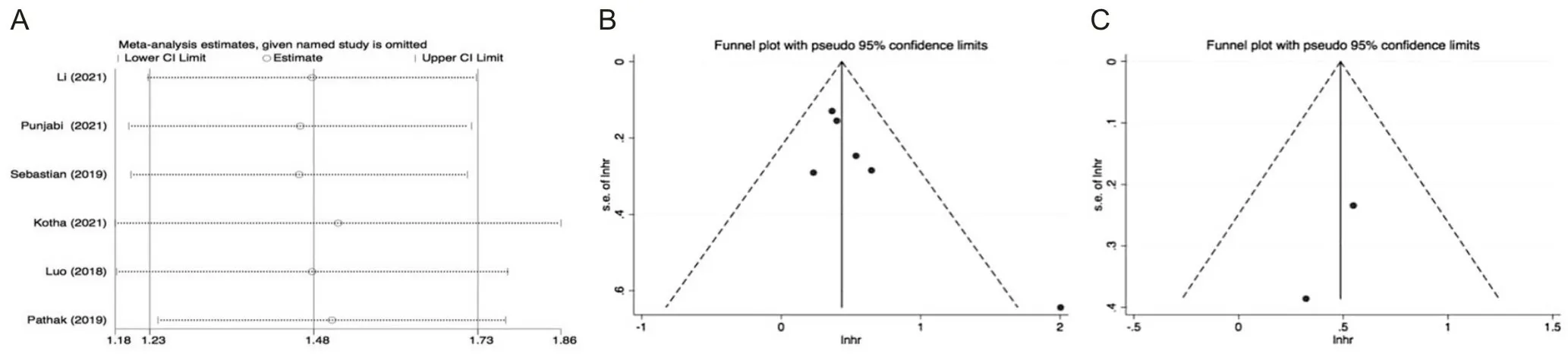
A為NLR預測OS的敏感性分析;B為NLR預測OS的發表偏倚;C為NLR預測DFS的發表偏倚。
3 討論
SBRT作為一種新型的放療技術,是一種聚焦式放療,定位精準,憑借立體定向原理對特定靶區進行一次性大劑量的精準照射,從而減少對周圍組織的損傷,該技術已廣泛用于NSCLC的治療,尤其對于早期原發灶的根治性放療,其療效可與手術相媲美[17-18],且對于寡轉移、顱內轉移等也有一定的應用,不但能改善癥狀,還能延長生存時間。盡管如此,仍然有部分患者會經歷放療后復發和進展,預后較差。
一直以來,NLR被作為簡便的系統炎癥指標,用于判斷機體炎癥狀態和疾病轉歸,也可用于預測惡性腫瘤患者的預后[19],但其在SBRT治療后的NSCLC患者中的預后價值結果缺乏一致性。本研究通過嚴格檢索和篩選策略,檢索出符合標準的NLR在SBRT后NSCLC患者預后價值的全部研究,經過meta分析證實了NLR也可預測患者的OS和DFS,且結果穩定性較好,發表偏倚風險低,結果可靠。
目前,NLR預測預后的具體機制尚不完全明確,但與系統炎癥反應密切相關,炎癥是惡性腫瘤的基本特征之一,是驅動NSCLC等惡性腫瘤發生發展的重要因素之一[20]。中性粒細胞是一種重要的炎癥細胞,參與細菌感染等的防御過程。在腫瘤微環境中,中性粒細胞存在2種極化方式,即N1和N2型,前者能夠發揮免疫促進作用,而后者發揮免疫抑制作用,在惡性腫瘤組織中,N2型中性粒細胞浸潤比率偏高,且與預后和治療抵抗相關[21]。另外,N2型中性粒細胞也可分泌多種細胞因子,如白細胞介素、血管內皮生長因子,促進NSCLC轉移和血管形成,靶向中性粒細胞可作為NSCLC潛在的治療策略[22]。
淋巴細胞是機體免疫的重要成分,其功能和亞型有多種,如CD8細胞、輔助性T細胞和調節性T細胞,主要發揮免疫促進和免疫調節作用,維持人體免疫平衡。在惡性腫瘤中,外周血淋巴細胞升高患者預后較好[23]。另外,腫瘤浸潤淋巴細胞增加,也意味著更好的預后[24]。因此,NLR不僅能反映NSCLC患者的系統炎癥狀態,還與腫瘤微環境有關,可預測SBRT治療后患者的轉歸和結局。
本研究首次利用meta分析,探索系統炎癥指標NLR與接受SBRT放療肺癌患者預后的關系,證實了NLR是這類患者生存和疾病復發可靠的生物標志物,無論是疾病分期、患者來源等因素,值得臨床廣泛應用。盡管如此,本研究還存在諸多局限性。首先,所納入的研究較少,其中僅3項研究報道了NLR與DFS的關系,需要今后更多的研究報道后進一步分析;其次,NLR的cut-off值不統一,需要未來設計研究進一步確定最佳的cut-off值;最后,部分研究的HR和95% CI采納了單因素回歸分析結果,可能放大了NLR的預后價值。
4 結論
本研究揭示了NLR這一炎癥指標對接受SBRT治療NSCLC患者的預后價值,值得在臨床中廣泛應用和進一步研究,同時也預示在給予SBRT放療的同時,可結合調控系統炎癥狀態治療策略以改善患者預后。

