NLRP3、IL-1β與視神經脊髓炎譜系障礙嚴重程度的相關性
李東瑞,王瑞,崔璨,荊婧,何霞
(鄭州大學第一附屬醫院 神經內科,河南 鄭州 450052)
視神經脊髓炎譜系障礙(neuromyelitis optica spectrum disorder,NMOSD)是中樞神經系統(central nervous system,CNS)的自身免疫性炎癥性脫髓鞘疾病。NMOSD主要累及部位為視神經和脊髓[1-3],其病變多數可累及腦干和大腦,表現為相應炎癥,如視神經炎和脊髓炎及某些腦、腦干綜合征,且可多次復發。NMOSD大多是由針對水通道蛋白4(aquaporin-4,AQP-4)的IgG抗體引起,隨后發現它是一種AQP-4特異性抗體,存在于中樞神經系統星形膠質細胞足突表面[4]。AQP-4是雙向滲透的水通道,陰離子和甘油均不能透過,其大多分布在星形膠質細胞的終足上[5],少部分存在于室管膜細胞膜上,而其余如少突膠質細胞、神經元或脈絡膜上皮細胞等并不表達AQP-4蛋白[6]。
在神經系統中,神經元細胞、小膠質細胞、少突膠質細胞、星形膠質細胞和施旺細胞均可以感知周圍環境的變化而發揮免疫作用。核苷酸結合寡聚化結構域樣受體蛋白3(nucleotide-binding oligomerization domain-like receptor protion 3,NLRP3)炎癥小體是CNS中最豐富的一種炎癥小體,是多數神經系統疾病神經炎癥產生的關鍵因素之一,也是研究最為廣泛的炎癥小體[7]。在神經系統中,神經元、少突膠質細胞、小膠質細胞、星形膠質細胞和施旺細胞均可以感知周圍環境的變化而發揮免疫作用,CNS中各種炎癥小體的表達具有特異性:小膠質細胞主要表達NLRP3、NLRP1和NLRC4[8-9],在大鼠的抑郁模型中,小膠質細胞是NLRP3表達上調后產生白介素-1β(interleukin 1β,IL-1β)的主要細胞[9]。
通過檢測NMOSD患者及非炎癥性神經系統疾病(noninflammatory neurological disorders,NND)患者腦脊液中NLRP3、IL-1β水平,分析NMOSD組患者腦脊液中NLRP3、IL-1β水平與疾病嚴重程度的相關性,探尋診斷NMOSD及評估該疾病嚴重程度的新的潛在生物標志物。
1 資料與方法
1.1 一般資料
收集鄭州大學第一附屬醫院2021年10月至2022年10月AQP-4陽性的NMOSD患者35例,以20名年齡、性別相匹配的NND患者作為對照組。本項目參考臨床數據與樣本資源庫標準操作規程和國際生物和環境知識庫學會最佳實踐,制定樣本收集、儲存的標準化操作規范,通過倫理審查(2019-KY-123)。
1.2 納入與排除標準
1.2.1納入標準
(1)NMOSD組:①符合NMOSD診斷標準[3],AQP-4為陽性;②>18歲;③處于首次發作。(2)對照組:①同期以頭痛為主訴入院的患者,可伴有惡心、全身無力等;②入院后神經系統查體、影像學資料及腦脊液檢測指標等均無異常。
1.2.2排除標準
拒絕參與研究;有神經系統腫瘤、腦外傷、腦膿腫、血管疾病、感染者;無法排除其他原因的神經系統疾病。
1.3 數據收集和分組
研究數據主要包括患者年齡、性別等指標。并有2名神經科醫生采用擴展致殘量表評分(expanded disability status scale,EDSS)[10]對NMOSD組患者入院時疾病嚴重程度進行評估。
1.4 NLRP3、IL-1β測定
標本取樣時間為發病7 d內及任何免疫抑制治療前,所有合格樣本均保存于-80 ℃冰箱內,最后統一從樣本庫出庫。利用酶聯免疫吸附試驗試劑盒(CSB-E15885h武漢、中國)測定NLRP3水平,利用酶聯免疫吸附試驗試劑盒(Bender MedSystems GmbH,維也納,奧地利)測定IL-1β水平。
1.5 統計分析
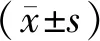
2 結果
2.1 臨床資料
30名NMOSD患者中,NMOSD組患者入院時EDSS評分為(4.41±1.90)分。兩組臨床資料比較見表1。

表1 各組間一般臨床資料及腦脊液比較
2.2 NMOSD主要臨床表現及影像學特征
NMSOD組主要臨床表現為視力下降、運動障礙、感覺障礙、惡心嘔吐、頭暈共濟失調及大小便障礙,其中視力下降占比42.86%,運動障礙占比45.71%,感覺障礙占比51.42%。NMOSD組患者入院后均于我院行頭顱及全脊髓MRI檢查,結果顯示:共有23名患者有脊髓病變,占65.71%;5名患者視神經病變,占14.29%;8名患者腦干病變,占22.86%;9名患者存在顱內多發病變,占25.71%。
2.3 兩組腦脊液NLRP3、IL-1β水平
兩組腦脊液中均檢測到NLRP3,NMOSD組、對照組水平分別為(1 127.96±394.61)、(679.53±176.81)ng·L-1,NMOSD組腦脊液NLRP3水平高于對照組(t=4.864,P<0.001)。NMOSD組和對照組患者腦脊液中均可以檢測到IL-1β,水平依次為(1.42±0.45)、(0.51±0.39)ng·L-1,NMOSD組腦脊液IL-1β水平高于對照組(t=7.772,P<0.001)。
2.4 NMOSD組NLRP3、IL-1β水平與EDSS評分的相關性分析
NMOSD組腦脊液NLRP3水平與EDSS評分呈正相關(r=0.360,P=0.033),IL-1β水平與EDSS評分呈正相關(r=0.359,P=0.034)。見圖1。

NMOSD為視神經脊髓炎譜系障礙;EDSS為擴展殘疾狀態量表;NLRP3為核苷酸結合寡聚化結構域樣受體蛋白3;IL-1β為白介素-1β;A為NMOSD組腦脊液NLRP3水平與EDSS評分的相關性分析;B為NMOSD組腦脊液IL-1β水平與EDSS評分的相關性分析。
3 討論
神經免疫炎癥反應是多種神經系統疾病產生的重要病因,包括腦血管病、神經系統感染性疾病、神經系統退行性疾病和神經系統自身免疫性疾病等。神經炎癥在本質上是固有免疫反應,在正常情況下神經系統可通過此反應對入侵的病原體及宿主的受損細胞作出應答,清除病原體及相關受損細胞,從而促進組織的損傷修復[11]。在病理狀態下,免疫炎癥受到刺激而過度激活,會引起促炎細胞因子的產生,進一步引起組織損傷,從而導致嚴重的神經功能障礙[12]。目前,神經系統自身免疫性疾病是由靶向神經元表位的自身抗體引起,多于年輕人群中起病,發病率高且個體之間具有異質性[13],NMOSD和MS便是其中較為常見的兩種自身免疫性脫髓鞘疾病。
NMOSD是一種嚴重的CNS炎癥性疾病,其發病大多數是由AQP4-IgG引起。研究發現,AQP-4-IgG陽性的患者中樞神經系統病變特征為血管周圍出現大量IgG、IgM和補體的沉積物以及炎癥細胞的浸潤,包括小膠質細胞、嗜中性粒細胞、嗜酸性粒細胞、B細胞和T細胞[14]。本研究共納入35例NMOSD患者,所有患者腦脊液或血清AQP-4抗體均為陽性,發病年齡為(45.40±13.42)歲,男女比例為10∶25,男性占比低于對照組。在納入的患者中,多數以視力下降、感覺及運動障礙為首發癥狀,少部分出現頭暈、共濟失調及大小便障礙,病灶多集中于脊髓,可少部分累及腦干及顱內,與既往研究[15]相符合。盡管AQP-4-IgG在NMOSD的發病中起核心作用,但炎癥細胞因子也在NMOSD的發生發展中起到十分重要的作用。
炎癥小體在顱內存在于神經細胞、小膠質細胞和星形膠質疾病,是一組蛋白復合體。目前較為熟悉的炎癥小體有NLRP1、NLRP3和NLRC4,其中NLRP3因其形成和激活特點成為目前研究的重點。目前尚不清楚NLRP3炎癥小體如何在鞘內被激活,已知各種外源和內源信號可以通過TLR-4信號通路上調NLRP3基因的轉錄和翻譯[16]。K+流出、Ca2+信號、活性氧、線粒體功能障礙都可以激活NLRP3炎性體[17]。mtDNA由受損的線粒體釋放,mtDNA 的細胞外(無細胞)水平反映了線粒體功能障礙的程度。mtDNA已被證明可作為激活人類先天免疫系統的損傷相關分子模式,包括 NLRP3炎癥小體[18-19]。有研究表明,NMOSD和MS患者的CSF中無細胞mtDNA水平升高[20-22],這也表明神經炎癥的復雜性。NLRP3炎癥小體的激活可以催化半胱天冬酶原-1并裂解為半胱天冬酶-1,從而促進原IL-1β和原IL-18轉化為活性IL-1β和IL-18,從而加重炎癥反應[23-24]。在多發性硬化的動物模型中,觀察到IL-1β和IL-18可上調CD4+T細胞的相關趨化因子的受體表達,從而促進Th1和Th17細胞遷移中樞神經系統[25]。Malhotra等[26]在原發-進展型多發性硬化患者腦組織的髓系細胞上檢測到NLRP3和IL-1β的表達,和外周單個核細胞中NLRP3和IL-1β的mRNA表達上調相一致。
NLRP3通過激活半胱氨酸蛋白酶-1(Caspase-1)對病原體相關分子模式和損傷相關分子模式做出反應。這反過來又激活促炎因子,如IL-1β和IL-18[27]。IL-1β可誘導輔助性T細胞到中樞神經系統,在那里釋放IL-6和IL-17并引發炎癥級聯反應,導致NMOSD中樞神經系統病變[28]。細胞焦亡(pyroptosis)是一種對免疫至關重要的細胞死亡方式,而焦亡的關鍵效應物GSDMD(gasdermin D)被Caspase-1激活[29-30],目前仍需要在細胞焦亡方面做進一步的研究。同時已有研究指出在NMOSD的患者腦脊液中的NLRP3和IL-1β、IL-6、IL-17水平高于對照組[31],本項研究與其基本相符。
本研究也有一定的局限性。首先,本研究只是在入院時進行了一次基線檢測,未進一步探索NLRP3及IL-1β在該疾病整個過程中的變化規律,同時未進一步追蹤患者預后情況。另外,本研究檢驗的指標相對單一,未與其他炎癥小體及相關細胞因子進行相互驗證和對比分析。這項研究是一項單一中心臨床觀察研究,樣本量小,偏倚是不可避免的,未來需要多中心、大樣本檢測。
4 結論
NMOSD是一種涉及星形膠質細胞損傷和炎癥因子的自身免疫性疾病。NLRP3、IL-1β可能在炎癥過程及發病機制中發揮重要作用。本研究提供了有關NLRP3、IL-1β在NMOSD中的作用的重要證據。NLRP3、IL-1β可作為NMOSD患者嚴重程度的生物標志物和治療NMOSD的潛在靶點。

