血清IL-18、APN與心房顫動射頻消融術后復發的關系
劉闖,陳雅麗,李向輝,閆佩佩
(鄭州大學第一附屬醫院 綜合科,河南 鄭州 450000)
射頻消融術(catheterradiofrequency ablation,RFCA)是治療心房顫動(atrial fibrilltion,AF)的首選方式,能改善AF癥狀[1]。但部分AF患者RFCA后仍有復發風險,如未及時治療,可威脅生命。故找到與AF患者RFCA術后復發有關的指標較為重要。研究顯示,AF患者RFCA后復發與炎癥反應密切相關[2]。白細胞介素-18(interleukin-18,IL-18)屬于白細胞介素-1超家族,可通過促進血管內皮細胞及平滑肌細胞表達白細胞介素-6(interleukin-6,IL-6),經IL-6刺激肝合成并分泌C反應蛋白(C-reactive protein,CRP),從而加劇炎癥反應,對心肌細胞造成損傷[3]。脂聯素(adipose tissue,APN)是一種分泌性血漿激素蛋白,可通過抑制核因子-κβ途徑,降低白細胞介素-8、單核細胞趨化蛋白-1等炎癥因子水平,緩解機體炎癥反應,保護心肌細胞[4]。綜上,推測血清IL-18、APN水平可能與AF有一定聯系。鑒于此,本研究著重分析血清IL-18、APN與AF患者RFCA后復發的關系。
1 對象與方法
1.1 研究對象
本研究在得到醫院醫學倫理委員會批準后開展。前瞻性研究,納入鄭州大學第一附屬醫院收治的96例AF患者,納入時間為2020年3月至2022年6月。其中男62例,女34例;年齡55~76(67.02±2.98)歲;體重指數21.20~25.24(23.01±0.85)kg·m-2;基礎疾病糖尿病8例,高血壓21例,高脂血癥15例,冠心病10例;生活習慣吸煙史56例,飲酒史70例。患者及家屬均簽署知情同意書。
1.2 入選標準
(1)納入標準:①接受超聲心電圖檢查,并結合第9版《內科學》[5]中AF相關診斷標準明確診斷;②符合RFCA治療適應證,成功接受手術治療;③術后無嚴重并發癥;④肝、腎功能正常;⑤陣發性AF。(2)排除標準:①既往有RFCA史;②先天性心臟病;③陣發性室上性心動過速;④合并心肌病;⑤有急性代償性心力衰竭;⑥伴凝血功能障礙;⑦有惡性腫瘤。
1.3 研究方法
1.3.1RFCA治療
局部麻醉,穿刺左鎖骨下靜脈,經頸內靜脈鞘管3550-18[美敦力(上海)管理有限公司,國械注進20173142128]置入冠狀靜脈竇電極40493D[飛利浦(中國)投資有限公司,國械注進20162072428],經右側股靜脈途徑置入2支Swartz長鞘管,穿刺送入左心房;隨后置入環狀標測電極(伯恩森斯韋伯斯特股份有限公司,國械注進20163072815)及三維電標測系統(Philips Medical Systems Nederland B.V.,國械注進20203070319)專用的冷鹽水消融導管至肺靜脈及左心房。使用3.5 mm標測消融導管(圣猶達醫療用品有限公司,國械注進20163010760)于左心房取點構建左心房三維結構圖,消融功率設定為30~35 W,溫度上限為43 ℃,鹽水流動速率為12~14 mL·min-1,每點消融終點是局部雙極電位振幅下降70%以上。
1.3.2復發評估方法及分組方法
術后隨訪6個月,以門診隨訪為主,電話隨訪為輔,術后第2周返院行第1次隨訪,之后每1個月隨訪 1次。AF復發標準參照第9版《內科學》[5],心電圖檢查顯示P波消失,表現為f波,頻率為350~600次·min-1;心室率不規則;QRS波形態通常正常,當心室率過快則發生室內差異性傳導,QRS波增寬。符合上述標準患者則定義為AF復發。將復發患者納入復發組,將未復發患者納入未復發組。
1.3.3一般資料調查方法
根據研究內容,明確需要收集的資料,自制調查表進行調查與填寫。包括性別(男、女)、年齡(≥60歲、<60歲)、體重指數(≥24 kg·m-2,<24 kg·m-2)、合并糖尿病、合并高血壓、合并高脂血癥、合并冠心病、吸煙史、飲酒史;所有患者均行心臟彩超,記錄左室舒張末期內徑(left ventricular end diastolic dimension,LVEDD)(正常值45~50 mm)、左室射血分數(left ventricular ejection fraction,LVEF)(正常值50%~70%)、左心房前后徑(left atrial diameter,LAD)。于患者入院當天采集肘靜脈血5 mL,經3 000 r·min-1離心15 min后取樣本待檢,檢測IL-18、APN、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、內脂素、谷草轉氨酶(glutamic-oxaloacetic transaminase,GOT)、谷丙轉氨酶(glutamic-pyruvic transaminase,GPT)、血紅蛋白(hemoglobin,Hb)、白細胞(white blood cell,WBC)水平。
1.4 統計學方法
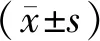
2 結果
2.1 96例AF患者RFCA治療后復發情況
96例AF患者術后隨訪6個月,復發28例,復發率為29.17%。
2.2 復發與未復發患者一般資料
復發組合并高血壓、冠心病占比較未復發組高,差異有統計學意義(P<0.05)。兩組其他資料比較差異無統計學意義(P>0.05)。見表1。

表1 兩組一般資料比較
2.3 實驗室指標
復發組入院時血清IL-18、內脂素高于未復發組,入院時血清APN較未復發組低,差異有統計學意義(P<0.05);兩組其他實驗室指標比較,差異無統計學意義(P>0.05)。見表2。

表2 兩組實驗室指標比較
2.4 AF患者RFCA術后復發的影響因素
將AF患者RFCA術后復發與否作為因變量(未復發=0,復發=1),將差異有統計學意義的變量作為自變量(合并高血壓無=0,有=1;合并冠心病無=0,有=1;LAD、IL-18、APN取實際值),logistic回歸結果顯示,AF患者入院時的LAD、血清IL-18過表達可能是RFCA術后復發危險因素(OR>1,P<0.05);入院時血清APN高表達可能是AF患者RFCA術后復發的保護因素(OR<1,P<0.05)。見表3。

表3 AF患者RFCA術后復發影響的二元logistic回歸分析
2.5 血清IL-18、APN水平與AF患者RFCA術后復發的劑量反應關系
橫坐標為IL-18、APN連續變化,縱坐標為相對應的預測值,見圖1、圖2,限制性立方樣條分析結果顯示,AF患者RFCA術后復發與入院時血清IL-18呈線性劑量反應關系,呈正相關(P<0.05),與入院時APN水平呈非線性劑量反應關系,但整體呈負相關(P<0.05)。

圖1 血清IL-18水平與AF患者RFCA術后復發的劑量反應關系

圖2 血清APN水平與AF患者RFCA術后復發的劑量反應關系
3 討論
AF是較為嚴重的心律失常類型之一,RFCA雖可有效改善AF患者癥狀,但術后仍有較高的復發率。李閃悅等[6]研究結果顯示,AF患者RFCA術后12個月復發率約41.00%,高于本研究,可能與本次研究隨訪時間短有關,但仍表明AF患者RFCA術后復發率高。因此,探尋可能的影響因子較為重要。
IL-18屬于干擾素-γ誘導因子,是炎癥敏感標志物,在免疫及獲得性免疫中起到關鍵作用,可通過激活T細胞及巨噬細胞,促進機體分泌細胞因子,激活炎癥反應[7]。APN是由244個氨基酸組成的單肽,屬于可溶性防御性膠原家族成員,可通過抑制成熟巨噬細胞活性,降低炎癥因子水平,緩解機體炎癥反應[8]。AF的發生主要是原有心臟疾病或衰老所導致的心房肌的變性及纖維化[9]。而炎癥反應可減少心肌細胞的鈣離子電流,導致新房組織電重構,增加心房電活動紊亂風險,同時炎癥反應還可改變心肌細胞附著形式,使心房肌細胞重新排列,導致心肌重構,從而增加心臟疾病風險[10]。由此推測血清IL-18、APN表達可能與AF患者RFCA術后復發相關。
本研究在對比復發與未復發患者資料及主要實驗室指標后,經回歸分析發現,患者入院時血清IL-18高表達、APN低表達與RFCA術后復發有關,前者過表達是風險因子,后者過表達是保護因子。IL-18可與磷脂酰膽堿特異性結合,形成溶血磷脂酰膽堿及長鏈酰基卡尼丁,抑制肌質網鈉鈣交換,導致心肌細胞鈣超載,造成心肌細胞凋亡,形成纖維瘢痕,促使心肌間質纖維化,造成電傳導不均一,使心房內及心房間的傳導阻滯及折返,影響心肌細胞電信號傳導,造成心房電活動紊亂,進而在術后誘發AF,導致復發[11]。同時IL-18還可通過誘導TNF-α、IL-6分泌增加心肌損傷,使心肌重構發生并造成心房電活動紊亂,繼而增加AF復發風險[12]。心房電重構及心房肌細胞離子通道、腎素-血管緊張素系統改變是誘發AF的重要原因。APN能夠通過加快心房肌細胞外基質Ⅰ型膠原蛋白降解產物羧基端型Ⅰ膠原肽合成,對心肌肥厚、間質纖化產生抑制,并防止心肌細胞及毛細血管的丟失,從而逆轉心房重構,降低RFCA術后AF復發風險[13]。反之APN降低,將減少線粒體生物合成,導致肝臟糖異生,加重炎癥反應及氧化應激,從而損傷血管內皮,加重心肌細胞損傷程度,導致AF復發[14]。為驗證推論,本次研究經限制性立方樣條法分析,結果顯示,AF患者RFCA術后復發與入院時血清IL-18呈線性劑量反應關系,呈正相關,與入院時APN水平呈非線性劑量反應關系,但整體呈負相關。同時本研究還發現,入院時LAD高水平也可能是AF患者RFCA術后復發的影響因素。其原因可能是,左心房變大導致左心房內折返環變短變多,使組織電不均一性提升,產生碎裂電位,導致復發。相關研究顯示,高血壓與AF患者RFCA術后復發也有聯系[15],但本研究顯示兩者無相關,這可能與研究納入樣本量小有關。
4 結論
AF患者RFCA術前血清IL-18、APN水平與術后復發有一定關系,二者異常表達可能是復發的風險因子,應引起臨床重視。

