基于術前DCE-MRI特征的肝癌患者術后MVI風險模型效能分析*
溫桂海 孔維
(邯鄲市中心醫院普外科,河北 邯鄲 056000)
肝細胞肝癌(Hepatocellular carcinoma,HCC)作為一種富含血管的實體瘤,瘤體一旦血管化,則其生長和轉移的速率會明顯加快。血管侵犯也被認為是影響HCC預后的主要因素[1-2]。臨床上肝臟的血管侵犯大致可分為大血管和微血管兩類,大血管侵犯術前通過CT和MRI較容易的檢測到,而微血管侵犯目前主要依靠術后病理檢查。研究表明,微血管侵犯已經成為肝癌術后早期復發的主要原因[3-4]。因此早期發現HCC是否存在微血管侵犯(Microvascular invasion,MVI)對于臨床確定治療方案和評估預后有重要意義[5]。有研究顯示,動態對比增強磁共振成像(DCE-MRI)能夠通過注射對比劑分析定量和定性指標的方式來評估腫瘤組織的微循環狀態和環境[6]。因此,本研究通過分析術前DCE-MRI的定量和定性特征,期待術前能夠預測MVI的存在,現報告如下。
1 資料與方法
1.1 納入與排除標準 納入標準:①符合《原發性肝癌診療規范2019》中關于HCC的診斷標準[7]。②術后病理確診為HCC。③能夠通過術后病理確定是否存在MVI。④均接受肝葉切除或部分切除術。⑤術前2周均行DCE-MRI檢查。⑥臨床資料完整。排除標準:①肝癌復發或轉移性肝癌者。②合并心肝肺腎其他部位功能障礙,無法耐受DCE-MRI檢查者。③存在代謝性疾病或免疫性疾病者。④術前接受任何形式的放化療者。⑤需要緊急手術患者。共納入我院在2020年1月—2022年4月收治的接受手術治療的HCC患者242例。按7∶3比例隨機選取170例作為訓練集,72例作為測試集。
1.2 DCE-MRI檢測方法 于術前2周進行DCE-MRI檢測。仰臥位,檢查前禁食水8 h,采用PHILIPS Achieva 3.0MRI掃描儀,首先進行常規掃描覆蓋整個肝臟,T1W1、T2W1平掃采用TSE序列,參數設置具體為T1W1:TR450 ms、TE8.0 ms,T2W1:TR2680 ms、TE100 ms,層間距為1.0 mm,層厚4.0 mm,DWI:TR4400~4800 ms、層間距3 mm。采集橫斷面、矢狀面積冠狀面圖像。采集時間定為100 s。DEC-MRI采用3D回波序列,TR7.0 ms、TE3.0 ms,層厚1.5 mm。以0.2 ml/kg劑量,3 ml/s速率經肘靜脈注入釓噴酸葡胺對比劑,注入后再注入15 ml生理鹽水。對比劑注射前掃描1期圖像,注射對比劑后掃描18期圖像,總時間為235 s。①圖像定量分析:使用DCE-MRI圖像處理軟件,在偽彩圖上選擇感興趣區域,測量血管容積積分(Vp),血管外細胞外間隙體積百分比 (Ve),血管內至血管外細胞外間隙的轉運系數Ktrans,血管外細胞外間隙轉運至血管內的速率常數(Kep)值。每個參數值重復測量3次,以平均值作為本研究的數值。②圖像定性分析:區分腫瘤內有無血管、包膜,腫瘤邊界,腫瘤邊緣強化程度和肝膽期瘤周信號強度。所有圖像處理分析均由兩名主治醫師以上級別的影像學醫生分別評判,給出共同結論。
1.3 相關標準 ①MVI定義:顯微鏡下可見腫瘤侵犯至血管內皮細胞[8]。②腫瘤內血管:動脈期掃描時可見不連續的血管影出現于瘤體內部。③腫瘤邊緣:在肝膽期MRI圖像上區分出腫瘤邊界光整程度,區分光整和不光整。④腫瘤包膜:動脈期掃描圖像上可見低信號環存在于腫瘤周圍,此為腫瘤包膜,觀察低信號環的完成度。⑤瘤周低信號(肝膽期):瘤周低信號在肝膽期主要表現為腫瘤邊緣的楔形、火焰狀或不規則的信號區域,其信號強度多低于周圍正常肝實質,但高于瘤體實質信號強度,記為低信號區。
1.4 資料采集 記錄患者性別、年齡、腫瘤直徑、是否合并乙肝、肝炎、肝硬化等、肝功能分級、甲胎蛋白(AFP)、白蛋白(ALb)、腫瘤分化程度等臨床資料。
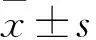
2 結果
2.1 訓練集分組結果及兩組患者一般資料比較 訓練集170例患者中共出現70例MVI,據此分組后對比兩組臨床資料顯示,兩組患者一般資料方面比較無統計學差異(P>0.05),見表1。
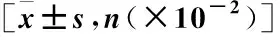
表1 兩組患者一般資料比較
2.2 訓練集兩組患者DCE-MRI征象比較 DCE-MRI征象方面,MVI組Ktrans、Kep、Ve、Vp指標明顯高于對照組,MVI組腫瘤邊緣不規則、肝膽期瘤周低信號比例高于對照組(P<0.05),見表2、圖1。

表2 兩組患者DCE-MRI定性指標比較

圖1 兩組患者DCE-MRI定量指標的比較[n(×10-2)]
2.3 訓練集HCC早期MVI的Logistic回歸分析 多因素Logistics回歸分析顯示,Ktrans、Kep、Ve、Vp、腫瘤邊緣不規則、肝膽期瘤周低信號是HCC出現MIV的獨立相關因素(P<0.05),見表3。

表3 訓練集HCC早期MVI的Logistic回歸分析
2.4 基于訓練集的列線圖模型的構建與評估 將Logidtic回歸得出的相關因素建立列線圖模型后顯示,模型在預測CHD危險度的C-index為0.948(0.911~0.973),見圖2。

圖2 基于訓練集相關因素構建的列線圖模型
2.5 預測模型的外部驗證效果 在測試集的72例患者中,30例術后病理發現MVI,其中敏感性為88.00%,特異性為96.36%,準確率為93.75%,陽性預測值為91.67%,陰性預測值為94.64%,見圖3。

圖3 預測模型的外部驗證效果
3 討論
MVI是肝癌手術切除或肝移植后生存不良的獨立預測因子,其發生率達15.4%~57.1%[9]。但MVI是一種組織病理學特征,目前的成像技術無法直接觀察到,這意味著在術前準確識別MVI是存在困難的。然而,盡管術前難以直接觀測,但通過分析影像學特征和病理學變化之間的關系,也能夠在一定程度上預測MVI。DCE-MRI作為一項無創性成像技術,能夠通過測量對比劑經過的組織器官的TWI信號強度變量來展現腫瘤組織內部的微血管結構和血管通透性,進而反映病變區域血管密度和血流強度[10]。目前DCE-MRI被廣泛用于評估惡性腫瘤的微循環狀態和環境,但用來預測肝癌患者術后MVI的研究較少,且多為單一研究。
本研究通過對比分析DCE-MRI定量和定性兩類指標分析其征象與MVI的關系,結果顯示,Ktrans、Kep、Ve、Vp、腫瘤邊緣不規則、肝膽期瘤周低信號是HCC出現MIV的獨立相關因素;列線圖模型的外部驗證結果顯示,模型在早期預測HCC存在MVI的敏感性為88.00%,特異性為96.36%,這對于指導臨床術前評估具有重要意義。分析認為:①HCC內新生血管能夠為瘤體細胞提供大量的影響物質,是腫瘤發生發展的重要基礎。另外,由于新生血管內皮細胞間隙大,基底膜不完整,導致血管的通透性增加,DCE-MRI檢查采用注入對比劑進入腫瘤組織后,能夠通過新生血管快速滲透至整個血管外細胞間隙,再次回流至血管內,在此過程觀察灌注定量參數就能夠對HCC的微血管狀態進行評價[11-12]。Ktrans和Kep主要反映了對比劑滲透至血管外和從血管外細胞間隙回流至血管的速率,兩者升高則表示腫瘤組織局部血管滲透性較大,也就是腫瘤組織內部新生血管較多,存在微血管侵犯[13-14]。②Ve主要反映對比劑滲透至血管外的體積,此值增大說明腫瘤組織周邊也存在微血管侵犯,這對于手術切除率和后期復發率均具有影響[15];而血管容積積分Vp則是指微血管侵犯的強度也就是腫瘤組織中微血管密度,此值增高說明肝癌組織中微血管侵犯較重。關于DCE-MRI定量指標與MVI數量的相關研究研究也指出,Ktrans、Kep、Ve、Vp指標與MVI呈正相關[16-17]。③定性指標方面,腫瘤細胞阻塞微小門靜脈分支導致了血流動力學的改變進而在肝膽期出現瘤周低信號,表現為腫瘤周圍組織攝取對比劑的面積減少,大部分對比劑被瘤體微血管存留,所以MRI征象上出現瘤周低信號就說明瘤體內存在微血管侵犯。多項研究表明,肝膽期瘤周低信號在早期預測HCC存在MVI方面具有良好的預測價值[18-20]。④本研究還得出了MRI征象顯示腫瘤邊緣不規則也是預測MVI的獨立相關因素,結合前文講述HCC中存在MVI,就能夠獲得和更強大的增殖和遷移能力,相對于沒有MVI的HCC,發展速度更快,表現出形態邊緣不規則。許多研究也表明,低分化的HCC存在MVI的風險更大,且高分化的HCC進化為中分化時,多數存在MVI[21-23]。HCC出現的MVI主要分為肝竇型 、毛細血管型 、中間型3種,其中低分化的HCC僅呈現毛細血管型,中高分化的HCC則3種形態均有可能呈現。新生的MVI缺乏足夠的內皮細胞,通透性大,癌細胞很容易通過新生的MVI轉運至全身各個器官,加上肝臟本身具有兩套血流系統,灌注量大,一旦合并MVI則極易導致患者預后不良[24-25]。通過DCE-MVI灌注定量和定性參數進行早期評價,則能夠對腫瘤組織進行更加科學的評估,制定科學的手術和治療方案。
本研究還存在一定局限性,首先限于樣本量較小,科學性有限。其次,對于通過DCE-MVI預警HCC存在MVI是否可以有效干預手術方案的制定,以及指導手術治療后的效果,后期仍需要加以研究。
4 結論
Ktrans、Kep、Ve、Vp、腫瘤邊緣不規則、肝膽期瘤周低信號是HCC出現MVI的獨立相關因素,基于術前DCE-MRI特征建立的風險模型在早期預測HCC出現MVI方面具有良好的預測效能。

