COPD合并Ⅱ型呼吸衰竭患者外周血HMGB1 IL-17及呼出氣一氧化氮濃度對預后的預測價值
柏 媛, 李 麗, 和 瑾, 吳 濤, 李梅華
(云南省昆明市第一人民醫院, 云南 昆明 650000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)臨床特征為持續漸進性呼吸困難、不完全可逆性氣流受限,其發病率約為8.2%,5年內病死率約為50%[1,2]。隨著病情進展可引起二氧化碳潴留,致使Ⅱ型呼吸衰竭發生,血清因子可參與COPD合并Ⅱ型呼吸衰竭發生過程[3]。因而血清因子可能作為評估患者病情及預后的潛在指標。高遷移率族蛋白B1(HMGB1)屬于炎性介質,可調節炎性反應、氧化應激反應,參與COPD發生過程[4]。白細胞介素-17(IL-17)屬于典型炎性因子類物質,且與COPD等呼吸道系統疾病發生發展密切相關[5]。呼出氣一氧化氮(FeNO)濃度變化可反映COPD病情嚴重程度[6]。目前HMGB1、IL-17、FeNO與COPD合并Ⅱ型呼吸衰竭相關性研究較少,本研究探討COPD合并Ⅱ型呼吸衰竭患者外周血HMGB1、IL-17水平及FeNO濃度,并分析其對預后的預測價值,為臨床治療提供參考依據。
1 資料與方法
1.1一般資料:選取2021年1月至2022年12月本院收治的100例COPD合并Ⅱ型呼吸衰竭患者作為觀察組,另選取同期COPD未合并呼吸衰竭患者60例作為對照組,選取同期健康體檢者60例作為健康組。觀察組:男59例、女41例,年齡60~76(68.02±2.61)歲,體質量指數(BMI)20~26(22.85±0.85)kg/m2,平均動脈壓75~92(83.65±2.73)mmHg,吸煙史20例,飲酒史19例,COPD病程2~10(6.20±1.18)年,合并癥:糖尿病20例、高血壓27例;COPD分級:Ⅲ級56例、Ⅳ級44例。對照組:男35例、女25例,年齡62~75(68.74±2.08)歲,BMI 19~26(23.01±0.92)kg/m2,平均動脈壓75~94(84.32±3.01)mmHg,吸煙史12例,飲酒史11例,COPD病程1~10(6.09±1.07)年,合并癥:糖尿病12例、高血壓16例;COPD分級:Ⅲ級33例、Ⅳ級27例。健康組:男38例、女22例,年齡61~75(68.19±2.19)歲,BMI 19~27(22.93±1.03)kg/m2,平均動脈壓75~93(83.96±2.81)mmHg,吸煙史15例,飲酒史14例。各組一般資料比較無明顯差異(P>0.05),具有可比性。本研究經本院倫理委員會批準。
1.2納入與排除標準:納入標準:符合COPD診斷標準;符合Ⅱ型呼吸衰竭診斷標準,且經血氣分析證實;機械通氣時間>48h;依從性良好者;認知功能、言語溝通正常者;簽署知情協議。排除標準:閉塞性細支氣管炎、支氣管擴張癥;合并間質性肺炎、肺結核、肺部腫瘤者;入組前兩周使用抗生素、抗菌藥物治療者;伴有嚴重血流動力學不穩定者。
1.3方 法
1.3.1治療方法:觀察組、對照組研究對象入院后予以常規治療。抗生素:依據常見致病菌類型、耐藥流行趨勢選擇抗生素;支氣管擴張劑:靜脈滴注氨茶堿注射液0.25g,1次/d;祛痰藥:靜脈滴注注射用鹽酸氨溴索30mg,1次/d。依據住院28d預后情況分為病死者、存活者。
1.3.2收集臨床資料:采用問卷調查方式收集受試者臨床資料,包括性別、年齡、BMI、COPD病程、Ⅱ型呼吸衰竭病程、急性加重次數、吸煙史、飲酒史、糖尿病、高血壓、總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、pH值、氧分壓(PO2)、二氧化碳分壓(PCO2)、心率、急性生理和慢性健康狀況(APACHEⅡ)評分。APACHEⅡ包括急性生理、慢性健康、年齡,總分為70分,評分越高表明病情越危重。
1.3.3檢測外周血HMGB1、IL-17水平及FeNO濃度:健康組于體檢當日,觀察組、對照組于入院時,分別采集空腹靜脈血5mL離心后取血清,置于-80℃冰箱保存。采用ELISA法檢測血清HMGB1、IL-17水平,上海酶聯生物公司提供IL-17檢測試劑盒,上海江萊生物科技有限公司提供HMGB1檢測試劑盒,檢測儀器為Bio-Rad 550型酶標儀(美國Bio-Rad公司)。采用SUNVOU納庫倫呼出氣一氧化氮分析儀(無錫市尚沃醫療電子股份有限公司)檢測FeNO濃度。
1.4觀察指標:①比較各組外周血HMGB1、IL-17水平及FeNO濃度,并分析HMGB1、IL-17與FeNO相關性。②比較不同預后患者外周血HMGB1、IL-17水平及FeNO濃度,分析COPD合并Ⅱ型呼吸衰竭患者預后影響因素。③交互作用分析HMGB1、IL-17、FeNO交互作用對COPD合并Ⅱ型呼吸衰竭患者預后的影響。④分析入院時HMGB1、IL-17、FeNO對預后的預測價值。
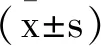
2 結 果
2.1各組外周血HMGB1、IL-17及FeNO比較:觀察組外周血HMGB1、IL-17及FeNO高于對照組、健康組(P<0.05),對照組外周血HMGB1、IL-17及FeNO高于健康組(P<0.05)。見表1。

表1 各組外周血HMGB1 IL-17及FeNO比較
2.2外周血HMGB1、IL-17與FeNO的相關性分析:相關系數分析可知,COPD合并Ⅱ型呼吸衰竭患者外周血HMGB1、IL-17與FeNO呈正相關(P<0.05)。見圖1。

圖1 外周血HMGB1、IL-17與FeNO的相關性
2.3不同預后患者臨床資料比較:不同預后患者性別、年齡、BMI、COPD病程、Ⅱ型呼吸衰竭病程、吸煙史、飲酒史、糖尿病、高血壓、TC、TG、HDL-C、LDL-C、pH值、PO2、PCO2及心率比較,差異無統計學意義(P>0.05),病死者急性加重次數≥2次比例、APACHEⅡ評分、外周血HMGB1、IL-17與FeNO均高于存活者(P<0.05)。見表2。
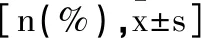
表2 不同預后患者臨床資料比較
2.4COPD合并Ⅱ型呼吸衰竭患者預后的Lasso-Logistic回歸分析:本研究納入100例COPD合并Ⅱ型呼吸衰竭患者(病死者26例,存活者74例),經Lasso回歸,22個因素精簡為5個較為重要的影響因素(急性加重次數≥2次、APACHEⅡ評分、外周血HMGB1、IL-17與FeNO),見圖2。以COPD合并Ⅱ型呼吸衰竭患者預后為因變量(存活者=0,病死者=1),將Lasso篩選出的5個影響因素:急性加重次數(<2次=1,≥2次=2)、APACHEⅡ評分(按實際值賦值)、HMGB1(按實際值賦值)、IL-17(按實際值賦值)、FeNO(按實際值賦值)作為自變量,多因素Logistic回歸分析顯示,急性加重次數≥2次比例、APACHEⅡ評分、外周血HMGB1、IL-17與FeNO均為COPD合并Ⅱ型呼吸衰竭患者預后的獨立危險因素(P<0.05)。見表3。

圖2 Lasso回歸模型篩選影響COPD合并Ⅱ型呼吸衰竭患者預后的相關因素

表3 COPD合并Ⅱ型呼吸衰竭患者預后影響因素的Logistic回歸分析
2.5FeNO與外周血HMGB1、IL-17交互作用對COPD合并Ⅱ型呼吸衰竭患者預后的影響:以FeNO>50.12ppb、HMGB1>7.31μg/L、IL-17>72.15ng/L為暴露,否則為非暴露,分析FeNO與外周血HMGB1、IL-17交互作用對COPD合并Ⅱ型呼吸衰竭患者預后的影響。以FeNO、HMGB1均無暴露為參比,結果顯示,當高FeNO、高HMGB1同時處于暴露狀態的病死者風險為9.429倍,聯合暴露增強了病死者風險;以FeNO、IL-17均無暴露為參比,結果顯示,當高FeNO、高IL-17同時處于暴露狀態的病死者風險為6.200倍,聯合暴露增強了病死者風險。見表4。

表4 FeNO與外周血HMGB1 IL-17交互作用對COPD合并Ⅱ型呼吸衰竭患者預后的影響
2.6外周血HMGB1、IL-17及FeNO對預后的預測價值:以病死者為陽性,存活者為陰性,繪制ROC曲線分析可知,外周血HMGB1、IL-17及FeNO預測預后的AUC分別為0.810(0.719~0.881)、0.800(0.708~0.873)、0.836(0.748~0.902),建立HMGB1、IL-17及FeNO聯合預測的Logistic模型,結果顯示,HMGB1、IL-17及FeNO聯合預測預后的AUC為0.938(0.871~0.976),進一步對各預測方案預測價值比較顯示,HMGB1、IL-17及FeNO聯合預測的AUC明顯較單獨指標高(P<0.05)。見圖3,表5。

圖3 HMGB1、IL-17及FeNO預測預后的ROC曲線

表5 HMGB1 IL-17及FeNO對COPD合并Ⅱ型呼吸衰竭患者預后的預測價值
3 討 論
COPD發病機制與內皮細胞功能失調、氣道炎性反應、氧化應激損傷有關,肺部感染、低氧血癥可引起肺小動脈痙攣,增加血流阻力,誘發肺部動脈血管重塑,進而引起Ⅱ型呼吸衰竭,HMGB1可經旁分泌、內分泌途徑,促進內皮細胞、單核細胞合成大量炎性因子,擴大炎性級聯反應,促使多器官組織損傷[7]。本研究結果顯示,觀察組外周血HMGB1水平高于對照組、健康組,且對照組高于健康組,提示HMGB1水平升高可能促進COPD合并Ⅱ型呼吸衰竭發生。HMGB1釋放至細胞外可激活炎性通路,促進炎性因子生成,加重體內炎性細胞浸潤,并以趨化因子形成,促進巨噬細胞遷移,引起呼吸道病理變化,損傷呼吸道上皮細胞,影響患者肺功能,并可引起氣道平滑肌增生、纖維化,致使呼吸功能減退,促進呼吸衰竭發生[8]。IL-17可刺激肥大細胞、單核細胞等生成炎性細胞因子,放大級聯反應,引起肺組織炎性反應,加重肺部損傷程度[9]。本研究結果顯示,觀察組外周血IL-17水平高于對照組、健康組,且對照組高于健康組,提示IL-17水平升高可能引起成纖維細胞分化、增殖障礙,進而促進Ⅱ型呼吸衰竭發生。由此推測IL-17水平升高可激活炎性細胞釋放炎性因子,造成呼吸道肺泡上皮損傷,引起肺部換氣功能障礙。FeNO屬于無創性評估氣道炎性的方法,可用于診斷肺部疾病,嗜酸性粒細胞性氣道炎癥與FeNO濃度密切相關,同時FeNO是由多種炎性細胞分泌產生,可參與呼吸道上皮細胞損傷過程,且與肺部感染嚴重程度有關[10]。本研究結果顯示,觀察組FeNO高于對照組、健康組,且對照組高于健康組,且HMGB1、IL-17與FeNO呈正相關,提示HMGB1、IL-17、FeNO可共同參與COPD合并Ⅱ型呼吸衰竭發生發展過程。其原因可能為HMGB1可促進炎性因子表達,放大炎性反應;IL-17可激活Th1細胞免疫應答,促進炎性因子生成,進而提高FeNO濃度。
Lasso回歸屬于一種變量篩選方法,其在原有損失函數基礎上增加懲罰回歸系數λ,隨著λ值增大,部分自變量回歸系數收縮至0,可提高模型的可解釋性,多因素Logistic回歸分析進一步篩選獨立預測變量建立模型,本研究結果顯示,急性加重次數≥2次比例、APACHEⅡ評分、HMGB1、IL-17與FeNO為預后的獨立危險因素。急性加重次數增加、APACHEⅡ評分升高可增加COPD患者預后不良發生風險[11]。交互作用是指一個因素不同水平之間反應量差異依賴于其他因素的水平變化,本研究的新發現在于FeNO、HMGB1高表達同時處于暴露狀態的COPD合并Ⅱ型呼吸衰竭患者病死風險為9.429倍,即FeNO、HMGB1同時高表達可增加預后不良發生風險;FeNO、IL-17高表達同時處于暴露狀態的COPD合并Ⅱ型呼吸衰竭患者病死風險為6.200倍,即FeNO、IL-17同時高表達可增加預后不良發生風險。其原因可能在于HMGB1、IL-17、FeNO高表達者體內炎性反應程度較高,氣道損傷程度較為嚴重,致使患者預后不良。本研究采用ROC分析發現HMGB1、IL-17、FeNO聯合預測預后的AUC高于單獨指標預測,證實聯合預測效能更佳。
綜上所述,COPD合并Ⅱ型呼吸衰竭患者外周血HMGB1、IL-17水平及FeNO濃度升高,聯合檢測其水平可提高對患者預后的預測效能。

