肉芽腫性小葉性乳腺炎病理診斷路徑
邵牧民,畢嘉欣
肉芽腫性小葉性乳腺炎(granulomatous lobular mastitis, GLM)并不少見,其病因及形態學復雜多樣,是乳腺炎癥性病變臨床病理診斷的難點之一。根據乳腺炎癥受累的范圍可將乳腺炎癥性病變分為兩大類:乳腺部位獨立發生的炎癥以及合并有全身系統性疾病的乳腺炎。獨立發生在乳腺部位的炎癥性病變常見有GLM、輸乳管鱗狀化生、乳腺導管擴張癥、脂肪壞死、妊娠和哺乳期乳腺炎、特殊感染性乳腺炎、隆乳相關病變等;全身系統性疾病相關的乳腺炎包括血管炎相關乳腺炎、糖尿病性乳腺炎、IgG4相關硬化性乳腺炎、狼瘡性乳腺炎、結節病等。
日常病理工作中,肉芽腫性乳腺炎(肉芽腫性小葉炎)很常見,但精準病理診斷不容易,甚至導致誤診。1972年,Kessler和Wolloch[1]首次報道“肉芽腫性乳腺炎(granulomatous mastitis)”,并對其特點進行簡單描述。數十年來,“肉芽腫性乳腺炎”的病理名稱不斷變更,包括GLM、特發性肉芽腫性炎(idiopathic granulomatous mastitis)、特發性肉芽腫性小葉性乳腺炎(idiopathic granulomatous lobular mastitis)、囊性中性粒細胞性乳腺炎(cystic neutrophilic granulomatous mastitis)等[2-5]。其中,“肉芽腫性小葉性乳腺炎”這個術語由于能更好反映病變形態學特點而被廣泛接受。越來越多的研究發現,囊性中性粒細胞性乳腺炎本質上是GLM發展過程中的一個形態學變化階段[6-7];我們在多種病因所致的肉芽腫性乳腺炎的病理觀察中,均發現存在“囊性中性粒細胞性乳腺炎”所描述的典型的囊性中性粒細胞結構。因此,本文將統一使用“GLM”這個診斷術語進行描述。
GLM是一種以乳腺小葉為中心的肉芽腫性病變。亞太地區GLM的發病率呈升高趨勢[8]。本單位單中心數據顯示,近5年來非哺乳期肉芽腫性乳腺炎約占良性乳腺疾病的19%。目前,由于對GLM發病機制缺乏統一認識,缺乏病理診斷標準和規范,給臨床規范診療帶來困惑。本文結合本單位研究結果,綜合分析GLM的主要致病因素,總結GLM的形態學特點和診斷路徑,以期為GLM的病理診斷及臨床規范化治療提供參考。
1 GLM臨床特征
GLM主要見于經產的育齡女性,很少見于孕婦和哺乳期婦女,極少見于男性。本研究團隊對700例GLM進行統計分析顯示,患者年齡20~53歲(中位年齡33歲),94.57%(662/700)患者有生育史及哺乳史,哺乳期、孕中期和已婚未育患者占極少數。部分患者有服用精神疾病類藥物或患有自身免疫性疾病,與文獻報道類似[9-10]。
GLM患者臨床表現呈較典型的炎癥改變[8]。發病早期,乳房可觸及腫塊,伴或不伴有疼痛,皮膚無明顯改變。腫塊可迅速增大,伴有紅腫熱痛等局部炎癥表現,但通常無全身感染癥狀。隨著疾病進展,可出現皮下膿腫,甚至皮膚破潰、流膿。部分患者可伴隨系統性病變,如結節性紅斑、類風濕關節炎、狼瘡性乳腺炎等。影像學方面,乳腺超聲檢查可見不規則低回聲腫塊伴有“管狀延伸”或多發性膿腫;乳房X光檢查表現為局灶性密度不對稱、邊緣模糊的不規則腫塊,有或無皮膚增厚和乳腺實質扭曲;乳腺MRI檢查發現不均勻強化腫塊、節段性非腫塊增強或局灶非腫塊性病變。有時GLM臨床表現類似乳腺癌,兩者難以鑒別。
2 GLM標本類型
病理科獲得的GLM標本包括細針穿刺細胞學涂片、粗針穿刺活檢組織、麥默通旋切標本以及乳腺腫塊切除標本。大體上,腫塊位于乳腺實質內,病變界限不明顯,多有結節狀結構,平均最大徑約6 cm。切面灰白、灰黃色,質軟,大多數大體標本可見多個大小不等的膿腔,呈黃色粟粒樣病灶(圖1)。化膿性標本可有膿性滲出物,可見大的膿腔或伴竇道形成。

圖1 GLM大體表現:A.患側乳房腫大,皮膚潮紅,伴破潰、滲液;B.腫物邊界不清,切面暗紅、灰白
3 GLM形態學特征
3.1 GLM組織學形態特征GLM是一種以終末小葉單位為中心的肉芽腫性炎,石蠟組織切片具有以下特點(圖2):(1)肉芽腫結構呈多結節狀分布,由上皮樣細胞及多核巨細胞組成的肉芽腫結構分布在乳腺小葉區域,破壞小葉結構,亦可形成大片肉芽腫性病灶;(2)大的肉芽腫結構中央常呈圓形脂滴空泡狀,空泡周圍中性粒細胞聚集;部分肉芽腫結構無脂質吸收空泡,而聚集大量中性粒細胞形成微膿腫;(3)肉芽腫內無干酪樣壞死,無Schauman小體或星狀小體;(4)炎癥背景重,可見顯著淋巴細胞、漿細胞及中性粒細胞浸潤,混雜少量嗜酸性粒細胞;(5)鄰近乳腺小葉內見淋巴細胞及漿細胞浸潤。

圖2 GLM組織學特征:A.低倍鏡下病變以小葉為中心,多結節狀分布;B.肉芽腫結構由上皮樣組織細胞和朗格罕多核巨細胞組成,散在大量慢性炎細胞;C.肉芽腫中央見大的脂滴空泡,空泡周圍大量中性粒細胞聚集;D.炎癥破壞導管結構,導管擴張、襯覆上皮脫落
3.2 GLM細胞學形態特征乳腺細針穿刺細胞學技術在臨床診斷中應用較為廣泛,具有安全、可靠、準確、快速、節省成本、幾乎無并發癥、無需麻醉等優點。GLM細胞學涂片有以下獨特形態學表現(圖3):(1)細胞量豐富,細胞類型多樣,以炎細胞和上皮樣組織細胞為主;(2)上皮樣組織細胞散在或呈巢團狀排列,形成肉芽腫結節;(3)可見大小不等的脂滴空泡;(4)炎細胞以淋巴細胞、中性粒細胞為主,可見朗格罕多核巨細胞。

圖3 GLM細胞學涂片:A.細胞量豐富,可見上皮樣細胞結節;B.中性粒細胞和淋巴細胞背景有朗格罕多核巨細胞 圖4 輸乳管鱗狀化生:A.患側乳頭凹陷;B.鏡下見乳頭內輸乳管末端鱗狀化生的區域充滿脫屑性角質栓
4 GLM的鑒別診斷
診斷GLM除了需具備以上形態學特征外,同時應排除具有相似臨床病理改變的其它肉芽腫性病變,日常工作中主要需與以下疾病鑒別。
4.1 乳腺癌有超過50%的GLM患者初診時被懷疑為乳腺癌。罕見情況下,GLM可能會伴有浸潤性癌,在診斷GLM前,必須排除這種情況,特別是絕經后女性。
4.2 輸乳管鱗狀化生輸乳管鱗狀化生又名Zuska病、乳暈下膿腫,主要由輸乳管(竇)內異常的角化成分導致的強烈炎癥反應。早期可導致乳頭凹陷、乳頭溢液,膿腫破潰后可形成乳竇部瘺管(圖4A)。鏡下可見乳頭部大導管擴張,輸乳管上皮發生鱗狀化生,腔內可見脫落的上皮及角化物,導致輸乳管破裂,角化物進入周圍組織引起繼發炎癥反應,形成以輸乳管為中心的乳暈下膿腫及異物巨細胞反應(圖4B)。
4.3 乳腺導管擴張癥乳腺導管擴張癥是以導管擴張為基礎改變的慢性炎癥,大體標本可見形成的擴張的管狀結構(圖5A)。疾病早期,導管擴張、內容物潴留,內容物多由嗜酸性、顆粒狀或無定形的蛋白液組成,混合有吞噬脂質的泡沫細胞和脫落的導管上皮細胞(圖5B)。繼發的炎癥反應集中在導管壁全層和導管周圍間質中,以淋巴細胞、漿細胞為主,漿細胞明顯者既往常被診斷為漿細胞乳腺炎(圖5C、D)。隨著病變的持續,導管壁破裂,內容物外溢,可引起更強烈的導管周圍反應,形成肉芽腫或出現中性粒細胞性肉芽腫結節,微膿腫常見。病變晚期,管壁纖維組織增生伴硬化。
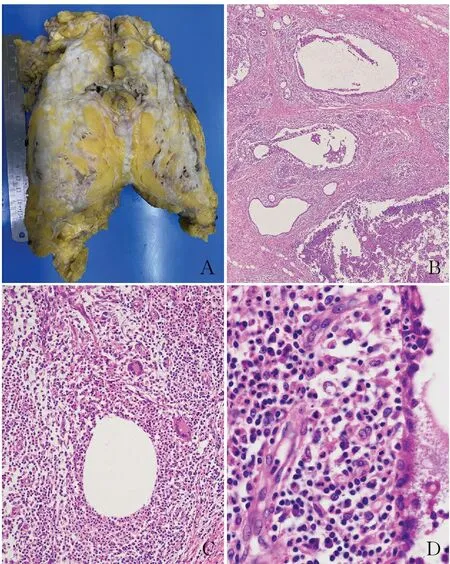
圖5 乳腺導管擴張癥:A.大體標本,乳腺導管呈橡皮管狀擴張;B.病變不同階段呈現程度不同的導管擴張;C.可以出現囊性中性粒細胞性肉芽腫改變;D.導管壁漿細胞和淋巴細胞浸潤明顯
4.4 脂肪壞死乳腺脂肪壞死可由外傷造成(不同于常見的撞傷因素,部分患者是由于駕乘安全帶擠壓所致),但手術或放療仍是常見原因。脂肪壞死的最初變化是脂肪細胞破裂,脂質溢出,伴有大量泡沫狀組織細胞浸潤。隨著病變進展,多核巨細胞和泡沫狀組織細胞呈結節狀聚集(圖6A),背景淋巴細胞和漿細胞浸潤,可有囊性變;壞死灶周圍可出現纖維化。脂肪壞死的細胞學涂片可見淡粉染的變性脂質成分或黃色脂滴顆粒(圖6B),容易識別。
4.5 隆乳相關肉芽腫病變假體破裂所致的硅膠滲出可引起脂肪壞死及硅膠肉芽腫。巨噬細胞內可見均質紅染、灰藍色的膠狀體或晶體。破裂假體周圍伴有纖維母細胞/肌纖維母細胞增生。炎癥反應往往集中在假體周圍間質,炎癥細胞包括淋巴細胞、漿細胞、組織細胞和異物巨細胞(圖7)。
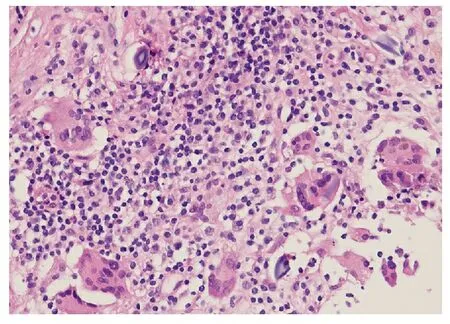
圖7 隆乳假體破裂致肉芽腫反應,可見多核巨細胞吞噬硅膠,背景慢性炎細胞
4.6 乳腺結核基于我們隨訪觀察和病原學研究結果,真正的乳腺結核少見,我們在65例宏基因組測序患者中僅發現1例結核。臨床表現與GLM較為相似,患者有肺結核病史。鏡下表現為典型結核性肉芽腫:中央為干酪樣壞死,類上皮細胞圍繞干酪樣壞死病灶,朗格罕細胞散在分布,周圍淋巴細胞反應明顯。結核病原學檢測陽性是可靠的診斷證據。
4.7 乳腺肉芽腫性血管炎韋格納肉芽腫(Wegener granulomatosis, WG)偶可見于乳腺,主要特點:(1)可以是原發累及乳腺(罕見),大多是受累于系統性病變(肺、腎);(2)出現壞死性血管炎;(3)主要呈伴有脂肪壞死的慢性反應性炎,肉芽腫不明顯(圖8)。

圖8 乳腺血管炎:A.動脈管壁炎細胞浸潤,內彈力膜斷裂,管腔縮窄;B.小血管淋巴細胞浸潤
5 GLM的發病機制
既往關于GLM的發病機制有三種假說[11-12]:(1)病原體感染;(2)性激素水平紊亂;(3)自身免疫系統功能失常。這些觀點均存在爭議,給病理診斷和臨床治療帶來了不確定性。本研究團隊采用宏基因組測序方法分析GLM的病原學情況,同時收集患者血清激素水平及相關免疫指標數據,對GLM的發病機制進行探討,發表了相關研究結果。
5.1 病原體感染最早提出肉芽腫性乳腺炎概念的學者認為這是一種特發性疾病,懷疑有感染性病因。直到2002年,新西蘭微生物學家和病理學家首次從肉芽腫性乳腺炎標本中成功分離出棒狀桿菌[13-14]。隨后一系列將GLM與棒狀桿菌關聯起來的研究結果被發表。棒狀桿菌是一種親脂、棒狀、生長緩慢的革蘭氏陽性菌,尤其適合在富含脂質的乳腺組織內生長[14]。有研究使用PCR和16sRNA測序對19例GLM患者進行微生物鑒定,結果發現所有標本中均存在棒狀桿菌,主要為克羅彭施泰特棒狀桿菌[15]。
為進一步證實克羅彭施泰特棒狀桿菌與GLM的關系,本課題組首次使用二代測序技術分別對具有典型GLM形態學的石蠟包埋組織和新鮮組織進行宏基因組測序分析,檢測炎癥樣本中可疑致病微生物,比對范圍包括基因組序列目前已知的3 446種細菌(其中包括104種分枝桿菌和45種支原體/衣原體)、1 515種DNA病毒、206種真菌、140種寄生蟲。石蠟包埋組織檢測結果發現,40例樣本中有39例樣本檢出病原體(39/40),其中包括細菌、真菌和結核分枝桿菌。檢出率最高的病原菌是銅綠假單胞菌(27/40),而克羅彭施泰特棒狀桿菌的檢出率僅7.5%(3/40)[16]。在25例新鮮手術樣本中,17例檢出病原體,其中克羅彭施泰特棒狀桿菌15例(60%),嗜油假單胞菌4例(16%),人類皰疹病毒4型、鮑曼不動桿菌、極端嗜熱菌各1例(4%);在病原體陽性樣本中,5例檢出1種以上病原體[17]。不同種類病原體的病例,形態學改變無明顯差異(圖9)。新鮮樣本中克羅彭施泰特棒狀桿菌的檢出率明顯高于石蠟組織樣本,且兩種標本類型的微生物構成譜明顯不同,推測可能與石蠟樣本制片過程導致的核酸受損和外源性污染有關,提示石蠟標本不適合行乳腺炎病原學檢測。上述研究結果提示,GLM存在較高的克羅彭施泰特棒狀桿菌檢出率,亦檢出文獻未報道的病原體。因此,在有條件情況下,建議盡量收集乳腺炎患者新鮮組織,通過二代測序檢測明確病原體類型,以指導臨床進行針對性治療。

ABC圖9 不同病原體的GLM具有類似的形態學特點:A.克羅彭施泰特棒狀桿菌;B.嗜油假單胞菌;C.人類皰疹病毒4型
5.2 性激素水平紊亂新鮮樣本宏基因檢測組分析中發現[17],5例檢出病原體同時伴有性激素水平增高,其中4例催乳素升高、1例雌激素升高;6例未檢出病原體的病例中亦有3例泌乳素升高(圖10)。在本單位病例庫中隨機統計100例GLM,其中21例伴有泌乳素水平升高,說明除了病原體感染因素外,泌乳素異常升高也與GLM的發生相關。

圖10 泌乳素升高病例,形態學與克羅彭施泰特棒狀桿菌陽性患者無明顯不同
5.3 自身免疫系統功能失常實驗室檢查除了發現泌乳素水平異常外,還發現一些自身免疫抗體和補體水平升高,如甲狀腺過氧化物酶抗體(TPOAb)、抗甲狀腺球蛋白抗體(TgAb)、C3、C4等。另外,在隨機抽檢的100例患者中,15例有下肢紅斑和(或)關節痛等臨床癥狀(圖11),4例有基礎性疾病,包括糖尿病(圖12)、狼瘡性腎病(圖13)。這些指標和臨床表現提示患者免疫系統功能紊亂可能與GLM發病有密切關系。
6 GLM免疫微環境
GLM的炎癥背景以淋巴細胞、漿細胞和中性粒細胞為主。有研究通過免疫組化方法評估GLM病變組織中巨噬細胞、自然殺傷細胞和IgG4的變化。結果發現,與正常乳腺組織相比,GLM樣本中CD68+/CD163+巨噬細胞、CD57+NK細胞和IgG4+漿細胞數量增多[18]。此外,Ucaryilmaza等[19]使用流式分選技術發現GLM患者外周血中效應T細胞群高于健康組,并且調節性T細胞亞群的Foxp3表達量低于健康組。在上述研究基礎上,我們使用不同的免疫組化標記在GLM石蠟樣本中分析炎細胞的組成,發現細胞類型包括淋巴細胞(CD20、CD3、CD4、CD8)、巨噬細胞(CD68、CD163)、朗格罕細胞(CD1α、Langerin)、NK細胞(CD57)、樹突狀細胞(CD21、CD23)、肥大細胞(CD117)以及IgG4+漿細胞,其中GLM浸潤的免疫細胞主要為CD4+T細胞和CD163+M2型巨噬細胞,其次是B細胞和肥大細胞(圖14)。這些結果提示,GLM的免疫微環境主要由CD4+T細胞介導,但具體機制仍需進一步深入研究。
7 GLM病理評估流程
GLM的病理診斷需結合臨床信息和實驗室檢查結果綜合評估,基于目前對該病的認識和研究結果,我們初步提出如下病因分析流程和病理診斷路徑(圖15)。

圖15 GLM病理評估流程
8 治療現狀
目前,對于GLM的臨床治療方面,已經有不同的共識或指南發布,由于對該病的病因、病原學及病理認識欠充分,這些治療方案尚存在一定局限性。對不同致病因素和發病機制的準確認識,是臨床制定精準治療方案的前提和基礎。
9 總結
基于目前的研究,對GLM病因、病原學及病理變化有了初步認識。克羅彭施泰特棒狀桿菌是GLM的主要病原體,嗜油假單胞菌、EB病毒、鮑曼不動桿菌和結核桿菌等病原體也可在GLM中檢出。此外,GLM與泌乳素升高和自身免疫功能異常明確相關。因此,對于臨床懷疑GLM的患者,首先需檢測患者泌乳素及其他自身免疫抗體血清學水平,若患者存在泌乳素升高,則可使用溴隱亭等降低患者泌乳素水平;若考慮進行病理檢查時,條件允許情況下建議在無菌操作下留取患者新鮮組織(避開皮膚破潰、化膿等區域),使用二代測序進行病原學檢查。若病原學測序結果陽性,則可選用對應抗生素治療,如使用親脂性抗生素(利福平)等治療克羅彭施泰特棒狀桿菌陽性患者。雖然導致GLM發生的條件因素可能不同,但病理組織學特點基本一致,而且與其它類型的肉芽腫性乳腺炎形態學存在交叉重疊,表現為脂質非壞死性肉芽腫、微膿腫形成、顯著淋巴細胞和漿細胞浸潤以及囊性中性粒細胞性結節改變等。同樣非特異性的形態學改變也在新型冠狀病毒感染患者的GLM中出現,我們發現2例新型冠狀病毒陽性的乳腺炎患者鏡下有GLM的常見形態學特點,同時還有較為廣泛的出血和典型纖維素樣血管炎。雖然尚不能確定新型冠狀病毒與乳腺炎的關系,但這種特殊改變值得關注。由于發生在乳腺的肉芽腫性炎性病變大部分都是GLM,在排除其它乳腺炎癥病變后,病理報告可直接使用“肉芽腫性小葉性乳腺炎”這一診斷。此外,細針穿刺細胞學可減少對患者的創傷,細胞學涂片在GLM診斷和鑒別診斷中具有一定實用價值。免疫微環境的炎癥細胞構成及功能在GLM發展中可能具有一定影響,值得深入研究。

