基于小膠質細胞活化探討不同部位電針對小鼠腦缺血急性期炎性反應的影響
莊麗華,柯 暉,陳 濤,張彥紅,徐 俊,韓永明
(湖北中醫藥大學,湖北 武漢 430065)
缺血性腦卒中是指各種原因所致的腦部血液循環障礙導致的腦組織缺血、缺氧性壞死,進而出現相應神經功能受損的疾病。腦缺血后小膠質細胞大量活化,介導炎性反應,從而引發一系列級聯反應,導致卒中后二次損傷,目前研究認為小膠質細胞活化介導的炎性反應是影響腦卒中進展及預后的主要因素之一[1-3]。電針是起源于中國古代的一種治療方法,可用于包括腦卒中等疾患在內的多種神經系統疾病的治療[4-6],可通過多種機制改善腦缺血損傷及其炎性反應[7-10]。百會穴、太陽穴是臨床治療缺血性腦卒中的重要頭部穴位,足三里穴、曲池穴是治療缺血性腦卒中的重要體部穴位。課題組前期實驗研究表明,聯合電針上述穴位能抑制小鼠腦缺血后小膠質細胞的活化,降低血清炎性因子水平[11]。本實驗觀察比較了電針不同穴位對小鼠腦缺血后小膠質細胞活化及炎性因子的影響,旨在為電針選穴治療缺血性腦卒中提供更多依據。
1 實驗材料與方法
1.1實驗動物 SPF級野生型健康成年雄性C57BL/6小鼠50只,體重20~25 g,購自維通利華實驗動物技術有限公司,許可證號:SCXK(京)2016-0006。飼養于湖北中醫藥大學動物實驗中心SPF級實驗室,飼養室溫度保持20~26 ℃,相對濕度40%~70%。所有實驗和程序均提前申請通過湖北中醫藥大學動物倫理委員會批準。
1.2主要儀器及試劑 小鼠MCAO線栓(1620-20-A4),北京西濃科技有限公司(beijing cinontech co.ltd);G6805-2型低頻電子脈沖治療儀,上海醫用電子儀器廠;規格為0.25 mm×25 mm的華佗牌針灸針,中國蘇州醫療用品廠有限公司;Magnetom skyra3.0T磁共振儀,德國西門子公司;3.0T8通道橫向放置老鼠線圈,上海辰光醫療科技股份有限公司;小鼠C反應蛋白(CRP)、腫瘤壞死因子-α(TNF-α)、白細胞介素-1β(IL-1β)酶聯免疫檢測試劑盒,賽默飛世爾科技公司;伊紅和蘇木素,美國Sigma公司;抗IBA1抗體,美國abcam公司。
1.3實驗方法 將小鼠按照體重分層隨機法分為假手術組、模型組、頭電針組、體電針組、頭體電針組,每組10只。術前所有小鼠嚴格禁食12 h,自由飲水,采用1%戊巴比妥鈉35~40 mg/kg腹腔注射麻醉小鼠,仰臥位固定,采用眼科剪剪開頸部正中皮膚1.0~1.5 cm,用眼科鑷頓性分離皮下組織及腺體,暴露頸動脈鞘,假手術組分離出頸總動脈、頸外動脈和頸內動脈,不插線栓。模型組和各電針組小鼠采用改良的Longa線栓法[12]建立右側大腦中動脈閉塞模型:分離右側頸總動脈及頸外動脈,結扎頸總動脈近心端及頸外動脈;將直徑(0.14±0.02)mm線栓放入27G注射器針頭(外徑0.4 mm、針長13 mm),將針頭從頸總動脈插入,從針頭尾部推入線栓,鑷子夾住頸總動脈及其內線栓,退出針頭后繼續將線栓插入頸內動脈,遇到阻力時停止,這時線栓頭端距離頸總動脈分叉約1 cm,大腦中動脈起始處剛好被堵住。減掉線栓多余部分并進行固定,消毒切口并縫合。術后單籠飼養,維持小鼠直腸溫度在(37.0±0.5)℃,記錄每只小鼠神經功能得分(Longa’s 5分法,0分:無明顯神經功能缺損癥狀;1分:垂直提尾時不能伸展對側前爪;2分:行走時向偏癱側轉圈;3分:行走時身體向偏癱側傾倒;4分:不能自發行走,意識喪失;5分:死亡)。實驗納入評分為1~3分小鼠,剔除0分、4分、5分小鼠。若有小鼠在觀察時間點前死亡或樣本(血清)未取出,則隨機補充同廠家相似體重的小鼠,以保證各組動物的樣本數量。小鼠完全蘇醒生命體征平穩后開始按組別行電針治療,參照《實驗動物常用穴位名稱與定位第3部分:小鼠》[13],頭電針組取百會穴(小鼠頭頂右側兩耳根連線與前后中線交點處)+患側太陽穴(小鼠外眼角與耳之間的凹陷即顳窩中),體電針組取患側足三里穴(后三里穴,小鼠膝關節外側腓骨小頭下3 mm處)+患側曲池穴(小鼠橈骨近端肘關節外側前方的凹陷處),頭體電針組取百會穴+患側太陽穴+患側曲池穴+患側足三里穴。操作方法:將小鼠俯臥位固定于特制固定器上,常規消毒,以毫針直刺各穴位,下針深度約3 mm,進針后連接低頻脈沖治療儀,選擇低頻疏密波,電針治療頻率為2/20 Hz,每3 s交替1次,每次刺激30 min,每12 h針刺1次,至造模后72 h,針刺強度以小鼠耳郭或針柄輕微顫動為度。模型組和假手術組每日在各電針組干預的同時行抓取刺激。
1.4觀察指標及方法
1.4.1神經功能評分 記錄各組小鼠完全蘇醒后及術后72 h的Longa’s 5分法神經功能評分。
1.4.2腦水腫總體積百分比 采用1%戊巴比妥鈉(35~40 mg/kg)腹腔注射麻醉小鼠后,俯臥位行磁共振掃描,在T2WI每個層面圖像上畫出高信號區域及整個層面的范圍,讀出水腫區域像素點數(S1-Sn)以及每個層面總像素點(S1總-Sn總),小鼠腦水腫總體積百分比=水腫體積/總體積=(S1+S2…+Sn)×T/[(S1總+S2總…+Sn總)×T],T為層厚(1 mm)。
1.4.3血清CRP、TNF-α及IL-1β水平 各組小鼠在術后72 h即刻摘眼球取血,靜置30 min后,以3 000 r/min(離心半徑10 cm)離心15~20 min,取上層血清,采用ELISA法測定血清CRP、IL-1β及TNF-α水平。
1.4.4腦組織病理形態 取血后立刻脫頸處死小鼠,取出完整腦組織,采用4%多聚甲醛固定24 h后進行HE染色和IBA1免疫組化染色。掃描全部玻片信息,在HE染色圖片上觀察神經元壞死及炎性細胞浸潤情況;在免疫組化染色圖上觀察小膠質細胞活化情況,并計算活化小膠質細胞百分比,計算方法:在病變側梗死中心取4個不重復的視野(400倍),統計活化的小膠質細胞數目和總小膠質細胞數目,將兩者比值作為該圖活化小膠質細胞數目百分比,每只小鼠4個視野百分比均值為該小鼠活化小膠質細胞數目百分比。
1.5統計學方法 采用SPSS 25.0軟件進行統計學分析。神經功能評分采用眾數進行描述,組間比較采用非參數檢驗(Kruskal-Wallis 檢驗)。水腫總體積百分比、活化小膠質細胞百分比、血清炎性因子水平數據若不符合正態分布,則采用非參數檢驗;若符合正態分布、方差齊性,則采用單因素方差分析,組間兩兩比較采用最小顯著性差異法(LSD法);若數據符合正態分布、方差不齊,則采用Dunnett’sT2檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1各組小鼠神經功能評分比較 假手術組小鼠均無明顯神經功能缺損癥狀,評分均為0分;各造模組小鼠在造模后和術后72 h均有不同程度的神經功能缺損,模型組、頭電針組、體電針組、頭體電針組小鼠術后神經功能評分眾數分別為3,3,3,2分,術后72 h神經功能評分分別為3,2,3,2分。
2.2各組小鼠腦水腫總體積百分比比較 假手術組小鼠T2WI圖像無明顯水腫信號改變,腦水腫總體積百分比為0;各造模組小鼠T2WI圖像右側腦組織出現不同范圍高信號區域,模型組、頭電針組、體電針組、頭體電針組的腦水腫總體積百分比分別為(29.441±3.907)%、(28.025±3.006)%、(29.149±3.228)%、(26.624±2.918)%。頭電針組、體電針組、頭體電針組腦水腫總體積百分比較模型組略降低,但各組間比較差異均無統計學意義(P均>0.05)。見圖1。
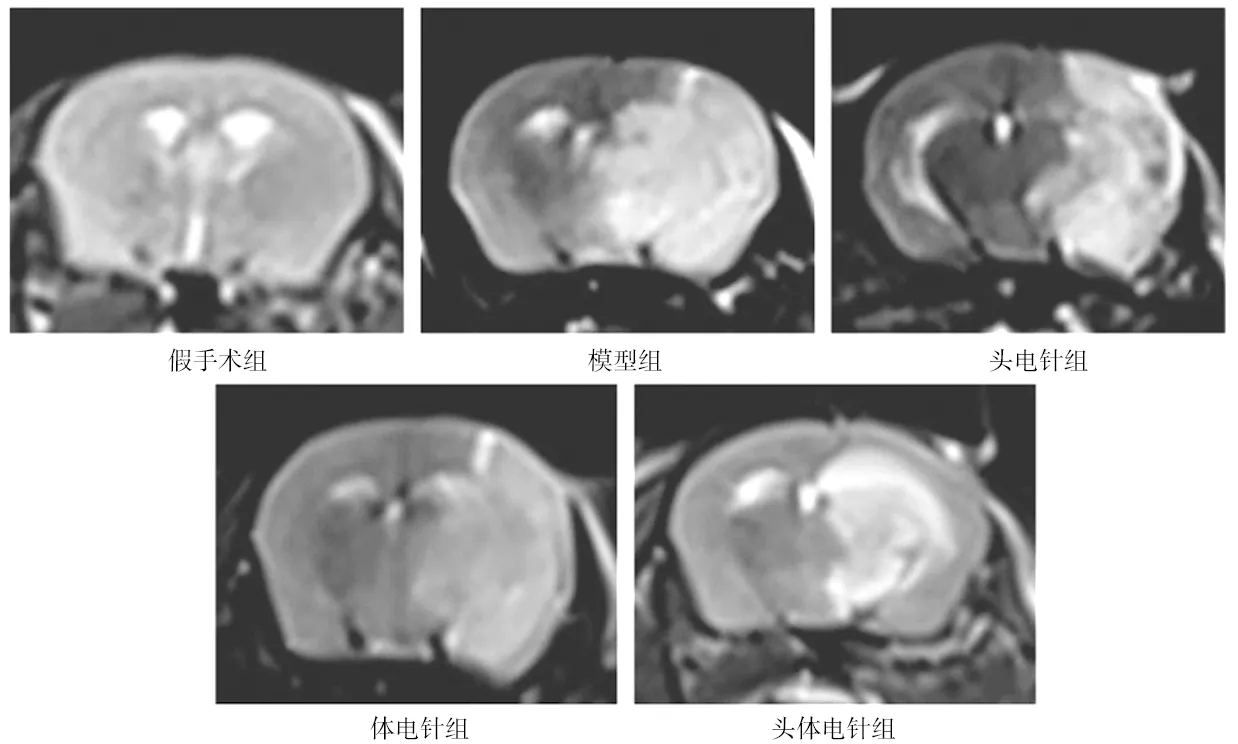
圖1 假手術組和腦缺血各組小鼠右側腦組織T2WI圖像
2.3各組小鼠血清hs-CRP、TNF-α和IL-1β水平比較 模型組血清hs-CRP、TNF-α、IL-1β水平均明顯高于假手術組(P均<0.05);頭體電針組血清hs-CRP、TNF-α、IL-1β水平均明顯低于模型組(P<0.05),且頭體電針組血清TNF-α水平均明顯低于頭電針組和體電針組(P均<0.05)。見表1。
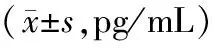
表1 假手術組和腦缺血各組小鼠血清hs-CRP、TNF-α和IL-1β水平比較
2.4各組小鼠腦組織HE染色形態 假手術組小鼠兩側腦組織結構清晰,細胞排列整齊,細胞間隙致密,未見明顯壞死,僅見少量炎性細胞浸潤。模型組小鼠右側腦組織可見片狀細胞壞死,細胞排列紊亂,皮質及海馬區神經元細胞數目減少,細胞間質水腫明顯,可見較多炎性細胞浸潤,部分小鼠左側腦組織可見輕度水腫。與模型組相比,頭電針組及體電針組神經元細胞壞死及間質水腫程度略有減輕,仍存在較大面積細胞排列紊亂及炎性細胞浸潤區域;頭體電針組小鼠腦組織神經元細胞壞死程度及間質水腫程度明顯減輕,少數區域可見細胞排列紊亂,呈局灶性炎性細胞浸潤。見圖2。
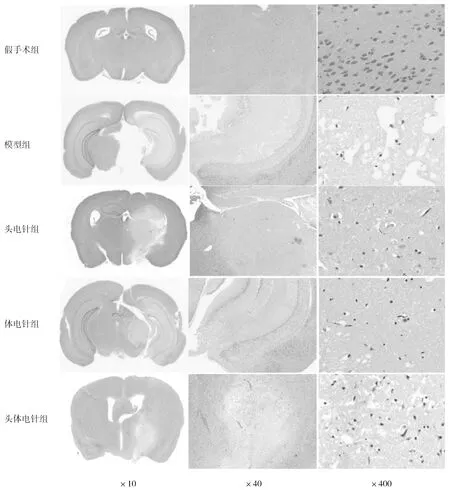
圖2 假手術組和腦缺血各組小鼠腦組織HE染色表現
2.5各組小鼠腦組織 IBA1免疫組化染色表現假手術組可見極少量活化的小膠質細胞和大量未活化的呈分支狀的小膠質細胞;模型組和各電針組可見大量活化的阿米巴樣且形態不一的小膠質細胞。假手術組、模型組、頭電針組、體電針組、頭體電針組小鼠活化小膠質細胞數目百分比分別為(13.05±3.94)%,(50.90±5.43)%,(46.35±6.57)%,(46.85±6.17)%,(43.60±3.98)%。頭體電針組活化小膠質細胞數目百分比明顯少于模型組(P<0.05),頭電針組和體電針組活化小膠質細胞數目百分比與模型組比較差異均無統計學意義(P均>0.05)。見圖3。
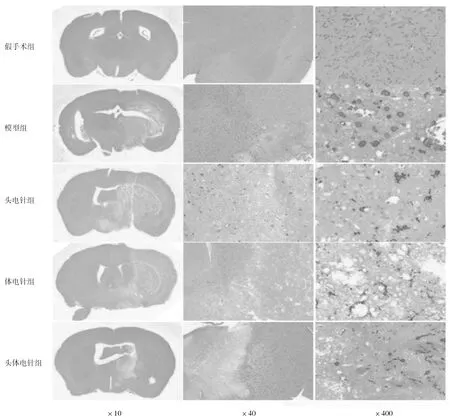
圖3 假手術組和腦缺血各組小鼠腦組織 IBA1免疫組化染色小膠質細胞分布情況
3 討 論
缺血性腦卒中是有許多因素共同參與的極為復雜的病理過程。在缺血性腦卒中患者神經損害過程中,缺血后炎性反應起著關鍵作用,其中腦組織缺血后的炎性反應是由級聯反應中的氧自由基和其他介質所致的致炎物質產生的結果,CRP、TNF-α、IL-1β等炎性因子大量釋放,參與中樞神經系統炎癥反應[14]。腦內小膠質細胞及血液來源的單核巨噬細胞在卒中后炎性反應中扮演著重要角色[15]。卒中發生后,腦內小膠質細胞迅速大量活化,活化的小膠質細胞通常被作為神經炎癥的標志[16]。
電針是治療腦卒中的常用方法,治療選穴中百會穴、太陽穴、足三里、曲池穴應用頻率較高。百會穴屬督脈,是陽氣匯集之所,可提神醒腦、回陽固脫、平肝熄風、凝神安心、調理中氣等,太陽穴可止痛醒腦、振奮精神、解除疲勞、明目;足三里是足陽明胃經的主要穴位之一,具有調節機體免疫力、調理脾胃、補中益氣、通經活絡、疏風化濕、扶正祛邪的作用;曲池穴屬于手陽明大腸經之合穴,有清熱解表、疏經通絡的作用。刺激以上穴位能達到止痛、提神醒腦、通經活絡的目的。
本實驗研究結果顯示,頭電針組、體電針組、頭體電針組小鼠神經功能缺損評分和腦水腫總體積百分比與模型組比較均無明顯差異,分析與本實驗中小鼠造模后腦梗死面積均較大、電針刺激觀察時間較短(本實驗僅做了術后72 h各指標檢測)、樣本量有限有關。病理學檢查發現,頭電針組及頭體電針組神經元細胞壞死、間質水腫、細胞排列紊亂、炎性細胞浸潤等病變程度較體電針組輕,且頭體電針組梗死周圍活化小膠質細胞數目百分比較模型組少,提示頭體電針能通過調節小膠質細胞活化,從而減輕腦缺血后腦組織水腫。頭體電針組血清hs-CRP、TNF-α、IL-1β水平均明顯低于模型組,且血清TNF-α水平明顯低于頭電針組和體電針組,說明頭體電針能明顯降低腦缺血后血清hs-CRP、TNF-α、IL-1β水平,尤其是降低TNF-α作用更明顯。
綜上所述,頭部與體部電針結合能通過抑制缺血性腦損傷后小膠質細胞的活化,減少血清炎性因子CRP、TNF-α、IL-1β的釋放,尤其是TNF-α的釋放,從而減輕炎癥反應損傷,保護腦組織及神經元,為臨床聯合應用頭體電針治療腦卒中及其并發癥提供了一定的理論依據。
利益沖突:所有作者均聲明不存在利益沖突。

