景寧木蘭TCP家族鑒定及遮陰脅迫表達模式分析
任明杰, 陸丹迎, 吳超, 朱森宇, 陳小珺, 鄔宇峰, 申亞梅, 馬晶晶
景寧木蘭TCP家族鑒定及遮陰脅迫表達模式分析
任明杰, 陸丹迎, 吳超, 朱森宇, 陳小珺, 鄔宇峰, 申亞梅, 馬晶晶*
(浙江農林大學風景園林與建筑學院,浙江省園林植物種質創新與利用重點實驗室,南方園林植物種質創新與利用國家林業和草原局重點實驗室,杭州 311300)
為明確TCP轉錄因子家族在景寧木蘭()遮陰脅迫中的作用,通過模擬自然生境對景寧木蘭3 a生嫁接苗進行遮陰處理,基于轉錄組分析TCP轉錄因子相關信息,利用轉錄組表達量和qRT-PCR分析遮陰脅迫下的表達模式。結果表明,從景寧木蘭轉錄組中篩選出12個基因,編碼蛋白長度為228~558個氨基酸,分子量為23.7~52.7 kDa,TCPs蛋白均為不穩定蛋白、親水性蛋白;TCPs均定位于細胞核,MsTCP20-a/b蛋白還定位于葉綠體。TCPs成員分為2大類,Class Ⅰ包含10個TCPs成員,Class Ⅱ包含2個TCPs成員。所有成員均含有TCP保守結構域,親緣關系較近的成員具有相似的保守基序;克隆得到啟動子序列,其序列含有大量光響應和激素響應元件。在遮陰處理后景寧木蘭基因存在差異表達,其中與在遮陰后顯著上升,、、、在遮陰后顯著下降。因此,景寧木蘭可能在響應遮陰脅迫過程中發揮重要功能。
TCP轉錄因子家族; 景寧木蘭; 遮陰; 基因表達
光照是植物生長發育所必須的外界環境因子,植物通過光合作用合成有機物滿足自身營養需求, 在森林群落中,上層常綠植物的冠層遮陰往往會減弱光強和改變光質進而影響下層植物的生長發育。遮陰會對不耐陰的植物造成一種重要的非生物脅迫,影響植物的營養生長[1]、花色[2]以及葉色[3–4]等性狀。木蘭科(Magnoliaceae)植物是一類古老的植物種群,由于全球氣候變化、亞熱帶常綠闊葉林的演替,多數木蘭科植物都面臨滅絕的危險。木蘭科瀕危物種生境多呈破碎化,多分布于陽光充足的林緣與溪溝邊,在林下生長勢弱或幼苗較少[5–8]。景寧木蘭()是木蘭科木蘭屬植物,其自然分布區狹窄,屬于浙江省極小種群瀕危物種。景寧木蘭屬偏陽性樹種[9],多生于針葉群落,在針闊葉群落中分布數量相對稀少,在常綠落葉群落中零星分布[10],群落中上層喬木的遮陰環境可能是削弱景寧木蘭生長勢,從而造成其瀕危的重要因素之一。
TCP是植物特有的一類轉錄因子家族,廣泛參與植物生長發育、激素信號傳遞和逆境脅迫等多個生物學過程。根據TCP結構域的不同,TCP家族可分為Class I (PCF或TCP-P)和Class II (TCP-C)兩大類,Class II類進一步分為CIN亞類和CYC/TB1亞類[11–12]。在Class I類基因當中,水稻()和參與DNA復制和控制細胞周期[13]。擬南芥()在調控花期中發揮作用[14],和影響擬南芥的節間長度和葉片形狀,同時介導赤霉素途徑促進種子萌發[15]。菊花()過表達能夠增加菊花中側根的數量和長度,并對側根中生長素的積累產生積極作用[16]。Class II類中,CIN亞類基因參與調控葉形態,、、、和受miR319的調控從而協調葉的發育[17];CYC/TB1亞類基因/在控制腋芽分枝發育中發揮作用[18],能夠結合油菜素內酯合成酶基因的啟動子,進而調控其表達[19]。迄今為止,已對擬南芥[20]、茶()[21]、棉花()[22]等多種植物的TCP轉錄因子開展研究,而在遮陰脅迫下的相關研究鮮有報道。本研究模擬景寧木蘭野外林下光照強度對其進行遮陰處理并進行轉錄組測序,通過分析差異表達基因,發現景寧木蘭在遮陰脅迫下呈現差異表達,推測景寧木蘭可能響應遮陰脅迫從而調控景寧木蘭的生長發育。因此本研究基于景寧木蘭遮陰轉錄組數據,對景寧木蘭TCPs轉錄因子家族開展鑒定分析,探究其生物信息學特性及遮陰環境下的表達模式,為深入了解景寧木蘭TCPs在遮陰下的調控網絡奠定基礎,最終為解釋景寧木蘭的瀕危機制提供理論依據。
1 材料和方法
1.1 材料
供試材料來自浙江省杭州市青山湖花園中心苗圃(30°25′ N,119°81′ E)培育的景寧木蘭3 a生嫁接苗。挑選長勢、性狀一致且無病害的嫁接苗作為材料,置于浙江省臨安區浙江農林大學(30°26′ N, 119°73′ E)人工氣候室進行培養,設置溫度為(25±2) ℃、相對濕度為40%~60%、光照強度為648mol/(m2·s)。為模擬景寧木蘭野外遮陰環境,采用3層黑色遮陽網及竹竿搭建遮陰處理裝置[25%全光照,162mol/(m2·s)],對照組幼苗不進行遮陰處理,其他條件保持不變。所有幼苗葉片間無重疊,每處理設置3個生物學重復。分別自處理的第0、5、15天采集景寧木蘭中層葉片。所有樣品取樣后立即用錫箔袋包好,并迅速置于液氮中速凍,隨后轉入–80 ℃冰箱保存,用于后續RNA提取及熒光定量qRT-PCR反應,并委托深圳華大基因股份有限公司進行轉錄組測序,轉錄組測序中每個樣本設置3個重復。
1.2 TCPs基因的篩選與理化性狀分析
景寧木蘭基因的鑒定基于轉錄組測序數據。在轉錄組注釋文件中的NR、NT、Swiss-Prot等3個數據庫中進行關鍵詞篩選,初步篩選到133個相關基因。用TBtools軟件批量提取轉錄組氨基酸序列文件中對應基因的氨基酸序列,不存在氨基酸序列的基因不進行后續分析。通過Pfam和SMART工具進一步分析結構域,剔除不含有TCP結構域的序列。通過DNAman進行對比,去除相同基因的冗余轉錄本,最終獲得12個景寧木蘭基因,并根據TCP擬南芥命名法及NCBI blast比對結果進行命名。利用ExPASy中的ProtParam在線工具(https://web.expasy.org/protparam/)預測景寧木蘭TCPs的氨基酸數量、等電點及分子量等理化性狀;利用在線網站Cell-PLoc 2.0 (http://www.csbio.sjtu.edu.cn/bio inf/Cell-PLoc-2/)預測亞細胞定位。
1.3 TCPs系統發育進化樹構建
利用MEGA 6.0將景寧木蘭、擬南芥、望春玉蘭()、水稻的TCPs氨基酸序列進行系統發育分析,采用鄰接法(neighbor-joining),1 000次bootstrap檢測,利用在線工具iTOL (https://itol.embl. de/)對系統發育進化樹進行優化。擬南芥、水稻的TCPs氨基酸序列均下載自PlantTFDB網站(http:// planttfdb.gao-lab.org/index.php),望春玉蘭TCPs氨基酸序列篩選自望春玉蘭基因組[23]。
1.4 TCPs氨基酸序列比對與保守結構域基序分析
利用Clustal Omega在線工具(https://www.ebi. ac.uk/Tools/msa/clustalo/)對12個景寧木蘭TCPs的氨基酸序列進行序列對比,利用jalview軟件對多序列比對圖譜進行優化;利用在線網站MEME (https://meme-suite.org/meme/tools/meme)對景寧木蘭TCPs蛋白進行保守基序預測分析,設置參數為:任意重復次數,最多基序數量為10;利用NCBI CDD工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析景寧木蘭TCPs蛋白保守結構域。
1.5 TCPs的啟動子克隆及順式作用元件預測
利用DNA提取試劑盒提取景寧木蘭基因組DNA;利用同屬物種望春玉蘭的基因組數據,從pfam數據庫中下載TCP轉錄因子的HMM (Hindden MarkovModel, 隱馬爾科夫模型)文件,利用hmmer 3.0軟件檢索望春玉蘭轉錄因子家族基因。調取望春玉蘭基因組內景寧木蘭同源基因上游2 000 bp的啟動子序列,根據望春玉蘭啟動子序列設計引物(表1),以景寧木蘭DNA為模版,利用高保真酶擴增景寧木蘭成員啟動子片段,連接載體并轉化大腸桿菌感受態,將陽性菌送往公司進行測序,獲得景寧木蘭啟動子序列。通過PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在線網站對景寧木蘭啟動子序列進行預測,利用TBtools進行可視化分析。

表1 景寧木蘭TCPs啟動子克隆引物
1.6 TCPs在遮陰脅迫下的表達分析
在轉錄組中獲得12個景寧木蘭基因的FPKM表達量數據,取平均值后利用TBtools軟件進行歸一化轉換,利用HeatMap工具繪制熱圖。根據轉錄組數據結果,選取在遮陰處理第5和15天時表達量趨勢一致的基因進行實時熒光定量實驗。采用植物RNA提取試劑盒提取樣品總RNA,利用反轉錄試劑盒進行第1鏈cDNA的合成。根據景寧木蘭轉錄組數據,利用Premier 5.0軟件設計特異性引物(表2),景寧木蘭基因作為內參基因[24–25],引物均交由生物公司進行合成。利用Light Cycler 480II (Roche)儀器進行目的基因熒光定量qRT-PCR表達分析。實時定量反應體系為10L,包括2L cDNA、5L BCG qPCR Master Mix、上、下游引物(10mol/L)各0.4L、ddH2O補足至10L, 設置3個重復。反應程序為:95 ℃預變性30 s,然后95 ℃變性5 s,58 ℃ 30 s,共40個循環。反應程序結束后,65 ℃~95 ℃每隔0.2 s作溶解曲線,采用2–ΔΔCT法計算目的基因的相對表達量。利用SigmaPlot 14進行繪圖,SPSS 24.0進行顯著性分析,采用獨立樣本檢驗進行比較,顯著性水平為0.05。

表2 熒光定量引物
2 結果和分析
2.1 TCPs的鑒定及理化性狀分析
基于景寧木蘭轉錄組數據庫,最終鑒定出12個基因。利用ExPASy對12個景寧木蘭TCPs蛋白進行氨基酸數量、等電點和分子量等理化性狀分析,結果表明TCPs成員物理性質存在較大差異。氨基酸數量最多是MsTCP19,包含558個氨基酸, 氨基酸數量最少是MsTCP11,包含228個氨基酸;等電點為6.24 (MsTCP11)~9.98 (MsTCP7-b); 分子量為23.7 (MsTCP11)~52.7 kDa (MsTCP8);12個TCPs蛋白均為不穩定蛋白、親水性蛋白。亞細胞定位預測結果表明,12個TCPs均定位于細胞核, 其中MsTCP20-aMsTCP20-b還定位于葉綠體(表3)。
2.2 TCPs系統進化分析
利用MEGA6.0軟件將景寧木蘭、擬南芥、水稻和望春玉蘭的TCPs氨基酸序列進行對比,采用鄰接法構建系統發育進化樹(圖1)。結果表明,景寧木蘭TCPs成員可被分為Class I和Class II 兩大類,其中Class I類包含10個TCPs成員,Class II類包含兩個TCPs成員,且Class II中的CYC/TB1亞家族無景寧木蘭TCP成員。此外,景寧木蘭TCP9含有兩個同源基因;TCP20含有兩個同源基因;TCP7含有兩個同源基因。
2.3 TCPs氨基酸序列對比
利用Clustal Omega工具將12個景寧木蘭TCPs氨基酸序列進行對比分析(圖2),結果表明12個TCPs均包含1個完整的TCP結構域,即高度保守且非典型的螺旋-環-螺旋(bHLH)結構域。在TCP結構域中共有13個高度保守的氨基酸,其中Basic區域含有8個,保守程度較高。Basic區域中,10個TCPs氨基酸序列出現4個氨基酸的缺失,屬于Class I類,MsTCP4與MsTCP2屬于Class II類。Class I類氨基酸序列與Class II類氨基酸序列在Helix I、Loop及Helix II區域差異較大,且Class I類氨基酸序列之間保守性較高。
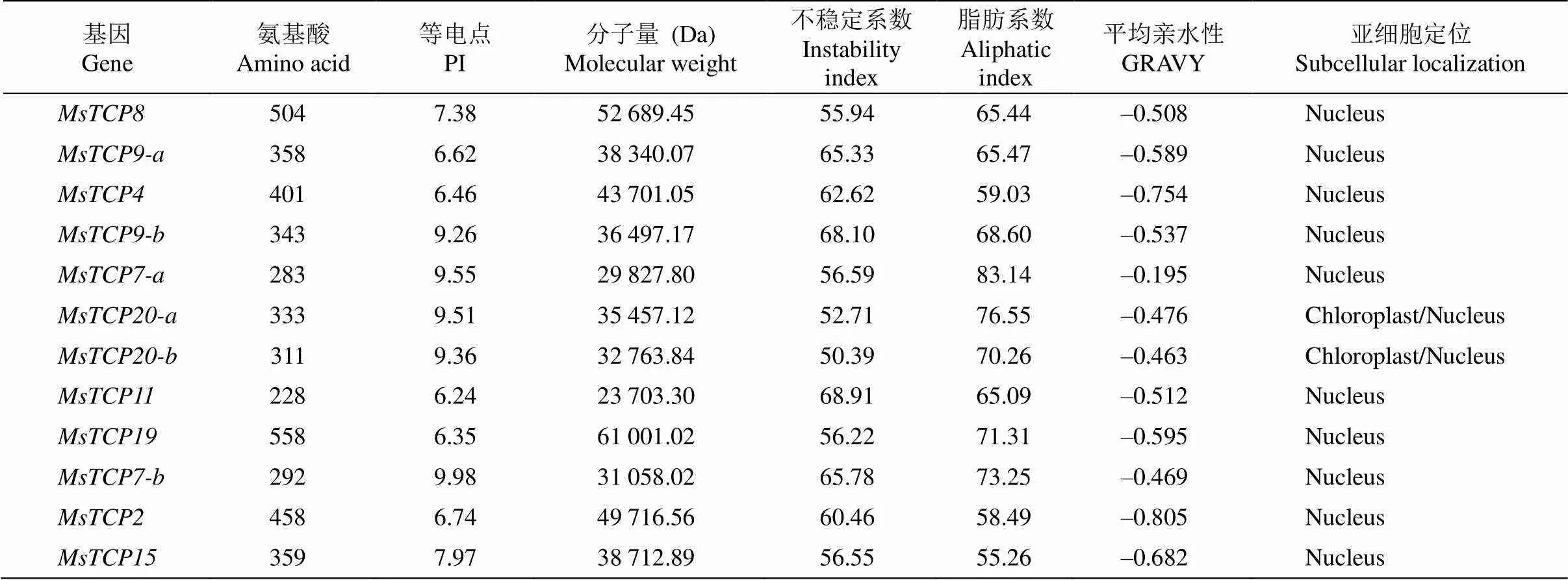
表3 景寧木蘭TCPs成員基本信息
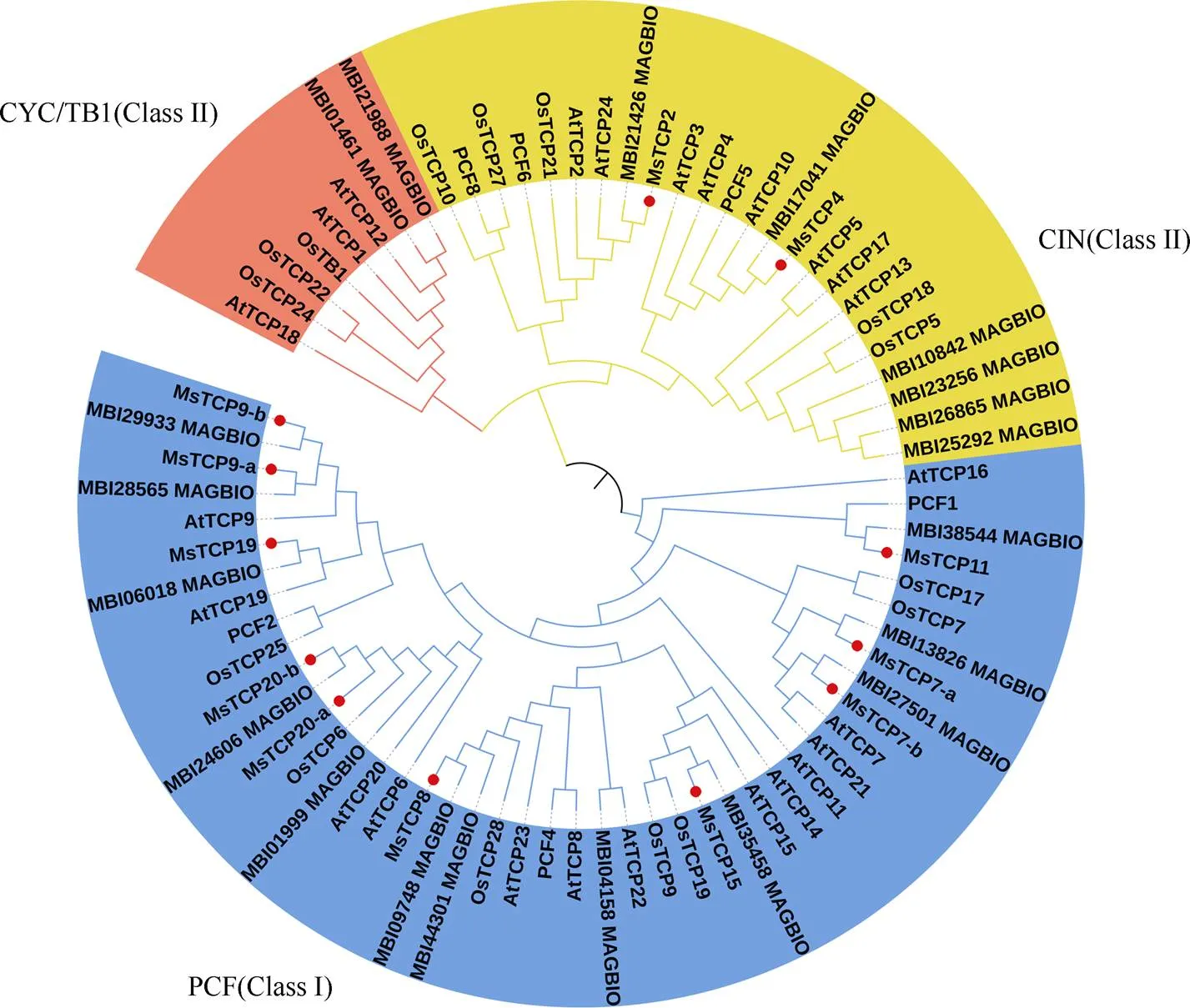
圖1 景寧木蘭(Ms)與擬南芥(At)、水稻(Os)和望春玉蘭(Mb) TCPs的系統進化分析
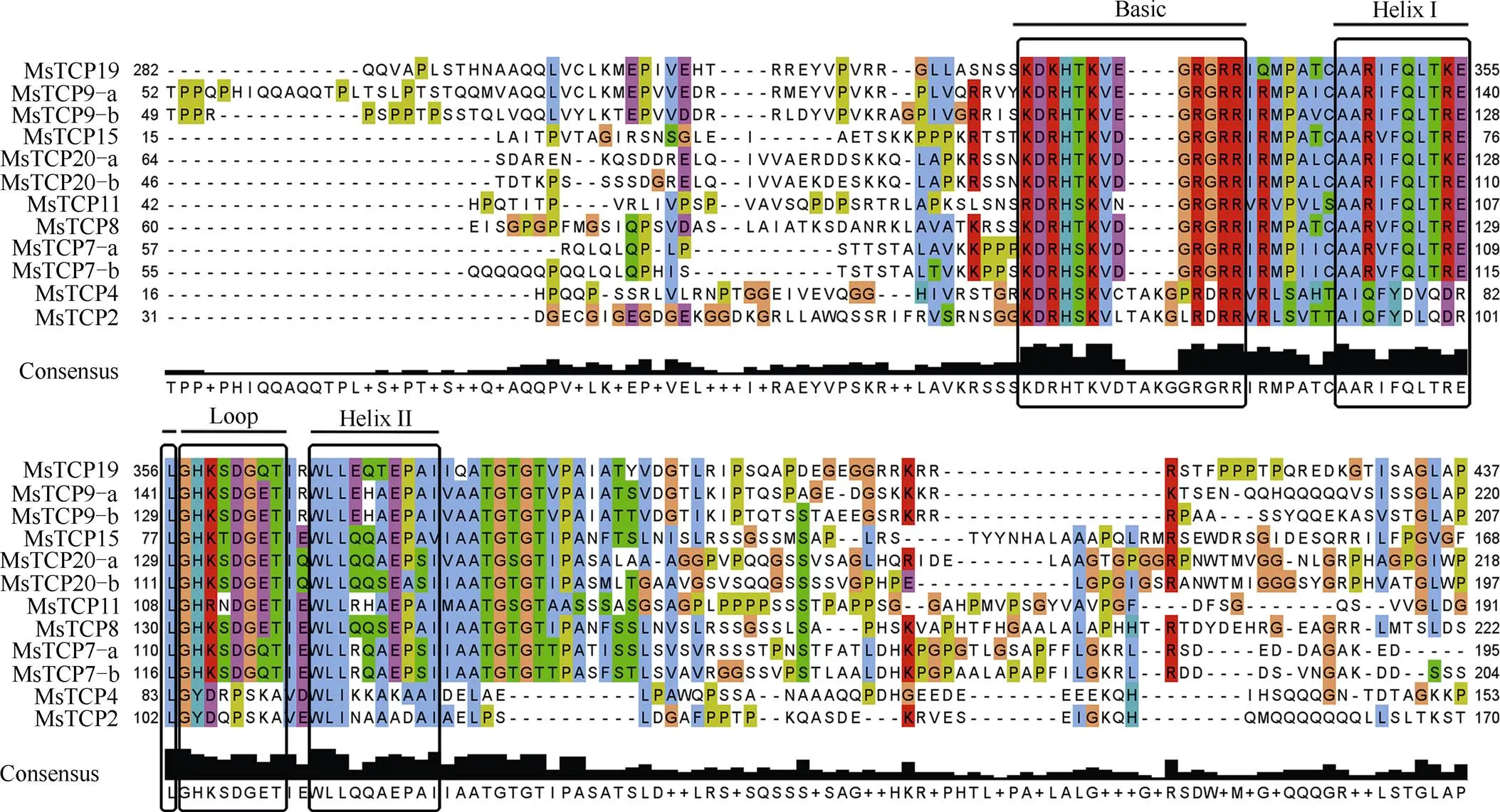
圖2 景寧木蘭TCPs的氨基酸序列對比
2.4 TCPs的基序及保守結構域分析
利用MEME在線工具對景寧木蘭TCPs蛋白進行保守基序分析,其中motif1為TCP結構域,存在于12個TCPs成員當中。景寧木蘭TCPs蛋白保守基序的組成具有一定差異性,不同TCP成員含有不同保守基序,但親緣關系較近的成員具有相似的保守基序,如MsTCP9-a與MsTCP9-b、MsTCP7-a與MsTCP7-b、MsTCP20-a與MsTCP20-b。利用NCBI CDD工具對景寧木蘭TCPs蛋白進行保守結構域分析,結果表明均含有TCP結構域,屬于TCP轉錄因子家族(圖3)。
2.5 TCPs啟動子克隆及順式作用元件預測
根據系統發育進化樹分析結果,以同屬植物望春玉蘭同源基因啟動子序列設計引物,利用景寧木蘭DNA作為模版,除未能在望春玉蘭中匹配到同源基因外,其余景寧木蘭基因均采用同源克隆的方法擴增到啟動子片段,對目的條帶進行回收(圖4),連接載體,挑選陽性菌送往公司進行測序,測序結果與望春玉蘭啟動子序列匹配度均達到95%以上。
利用PlantCARE對景寧木蘭啟動子進行順式作用元件預測,發現光響應元件數量最多,且存在于所有家族成員中,表明家族成員均可能受到外界光照的調控,弱光環境下將影響景寧木蘭家族的基因表達。生長素、脫落酸、茉莉酸、水楊酸、赤霉素5大類激素順式作用元件存在于基因啟動子中,說明激素對基因可能存在潛在的調控作用。此外,低溫響應元件(CCGAAA)、細胞周期調控元件(TCCAACGGT)、分生組織表達元件(GCCACT)、玉米蛋白代謝調節元件(GATGACATGG)、防御和脅迫響應元件(ATT- CTCTAAC)等存在于基因啟動子中,表明景寧木蘭基因可能在參與植物生長發育、響應生物及非生物脅迫中發揮重要作用(圖5)。

圖3 景寧木蘭TCPs保守結構域和基序

圖4 景寧木蘭TCPs啟動子的PCR擴增
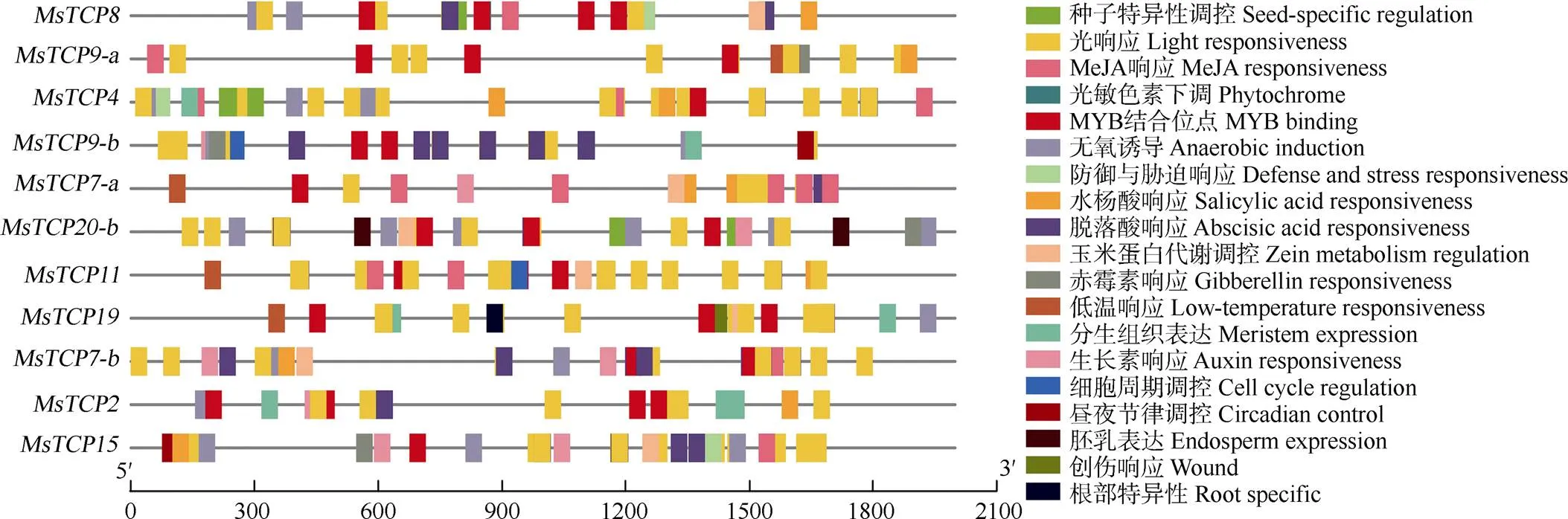
圖5 景寧木蘭TCPs啟動子順式作用元件預測
2.6 遮陰條件下TCPs表達分析
通過轉錄組測序技術獲得了在對照的第0 (CK D0)、5 (CK D5)、15天(CK D15)及遮陰第5 (ST D5)、15天(ST D15)的FPKM值,取平均值后運用TBtools工具繪制熱圖(圖6)。結果表明,在遮陰脅迫下12個成員均發生差異性變化,其中、的表達量在遮陰后第5、15天后均呈上升趨勢;、、、、的表達量在遮陰后第5、15天后均呈下降趨勢,其余成員的表達量變化不呈現規律性。
根據景寧木蘭轉錄組數據分析結果,對、、、、、、等7個基因進行實時熒光定量qRT-PCR檢測,結果表明,和的表達在遮陰后第5、15天均呈上升趨勢,而、、、則呈下降趨勢(圖7)。
雖然景寧木蘭熒光定量結果在遮陰后的變化與轉錄組不同,但遮陰后的變化趨勢與轉錄組總體一致,說明、、、、、能夠響應遮陰脅迫。
3 結論和討論
上層樹冠遮陰是影響下層植株生長發育的重要非生物脅迫,TCP是高等植物特有的一類轉錄因子家族,在植物生長發育及響應外界脅迫中發揮重要作用。景寧木蘭是浙江省極小瀕危物種,上層喬木的遮陰可能是導致其瀕危的重要因素之一。本研究通過分析景寧木蘭遮陰轉錄組數據,發現呈差異表達。為了探討景寧木蘭在遮陰脅迫下的功能,本研究首先基于轉錄組數據篩選得到12個景寧木蘭成員,這與擬南芥[20]、水稻[26]及望春玉蘭的成員數量存在差距,一方面可能由于景寧木蘭存在物種特異性,另一方面可能由于基因表達存在時空特異性,未能在葉片轉錄組數據庫中鑒定出。亞細胞定位預測表明,12個TCPs均符合其轉錄因子特性,定位于細胞核中,其中MsTCP20-aMsTCP20-a定位于葉綠體中,這與茶樹CsTCP21[27]、油菜()的BnTCP36[28]等定位在葉綠體的結果相一致,暗示其可能在葉綠體中發揮功能。
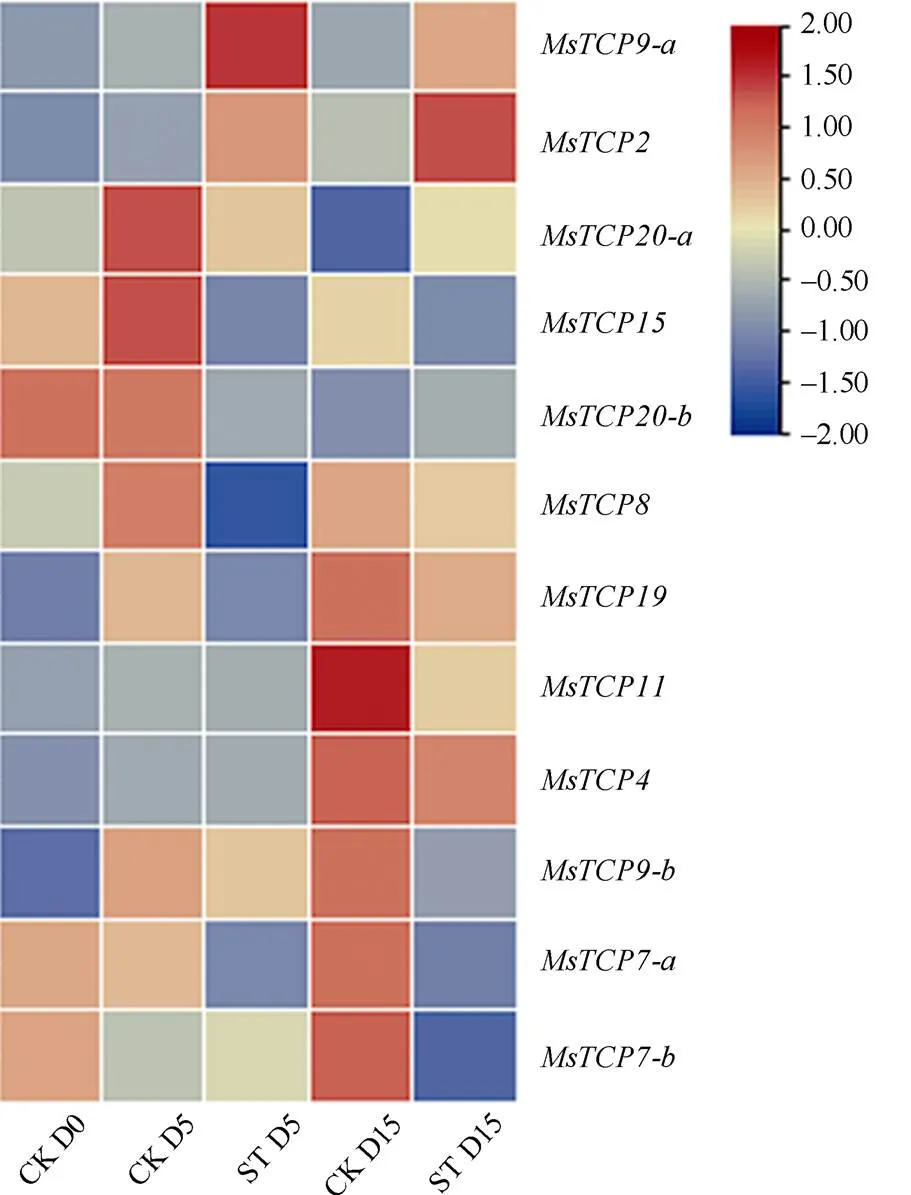
圖6 遮陰下景寧木蘭TCPs表達量熱圖。CK: 對照; ST: 遮陰; D0: 第0天; D5: 第5天; D15: 第15天。下同
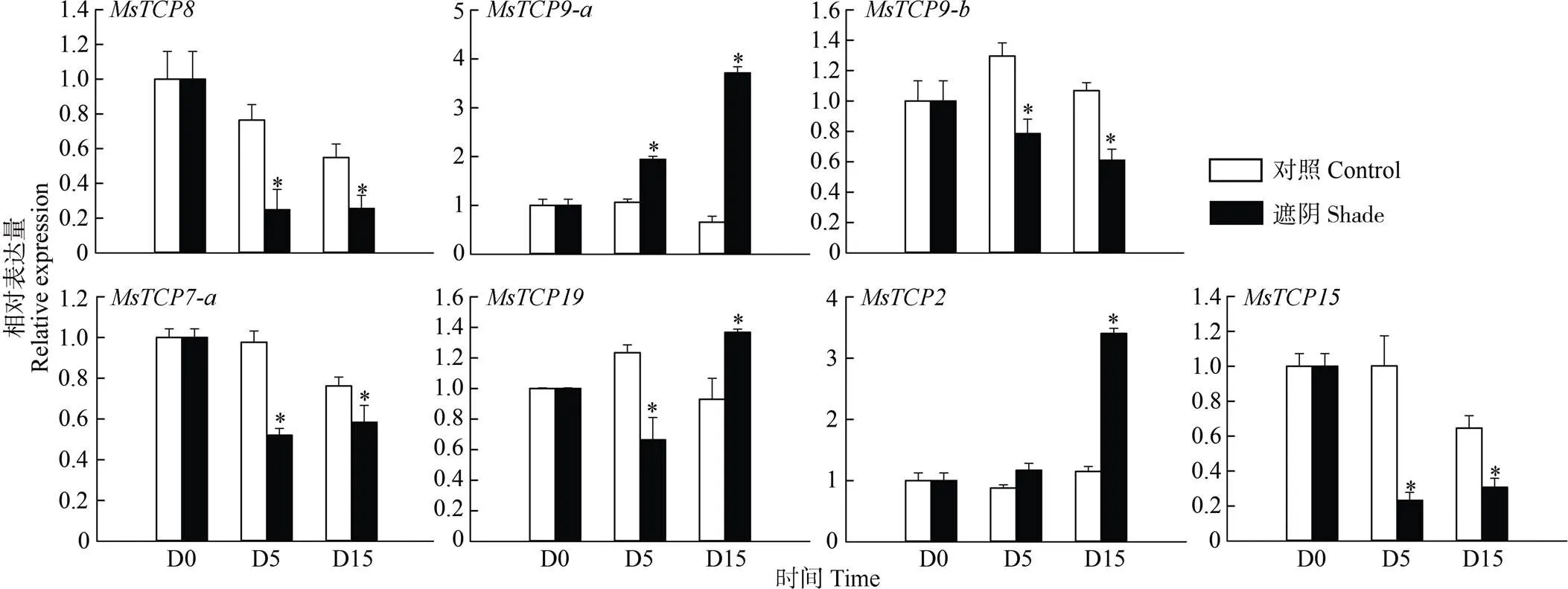
圖7 遮陰下景寧木蘭TCPs的qRT-PCR分析。*: P<0.05
在系統發育進化樹中,擬南芥TCPs成員被分為Class I和Class II兩大類,Class II進一步被分為CYC/TB1和CIN亞類,這與前人[20]研究結果一致。景寧木蘭TCPs成員在Class I類和CIN亞類中均有分布,但不存在CYC/TB1亞類,可能由于此類基因在葉中不發揮功能,CYC/TB1亞類基因主要控制植物花型的對稱性[29]。氨基酸序列分析表明所有景寧木蘭TCPs成員均含有TCP結構域,但不同類的TCPs成員其氨基酸序列和保守基序存在差異,說明其功能存在多樣性。基因啟動子是調控基因轉錄的重要元件[30]。本研究基于望春玉蘭基因組,通過同源克隆的方法獲得11個景寧木蘭啟動子序列,未能在望春玉蘭基因組匹配到同源基因,可能是物種間基因數量存在一定的差異性。通過分析景寧木蘭啟動子序列,發現啟動子含有大量光響應元件及脫落酸、茉莉酸等激素響應元件,這與桃()的啟動子作用元件分布類型相似[31],表明景寧木蘭可能響應遮陰環境所導致的光信號與激素信號變化。
基因的表達模式變化通常能夠反映其對非生物脅迫的應答能力。本研究結合轉錄組數據和qRT-PCR技術對景寧木蘭在遮陰脅迫后的表達量進行了分析,結果表明和表達顯著上升,、、、表達顯著下降。氣孔在響應脅迫中發揮重要作用,遮陰脅迫會加速植物氣孔的閉合[32–33]。基因在豇豆()調控氣孔大小中發揮作用[34],景寧木蘭與在遮陰脅迫下表達量呈差異性變化,推測與可能介導遮陰脅迫下景寧木蘭的氣孔開度。遮陰脅迫會促進植物莖的伸長生長,在矮牽牛()中,能夠介導矮牽牛莖的伸長生長[35],景寧木蘭表達量呈顯著性變化,推測其可能調控遮陰脅迫下景寧木蘭莖的伸長生長。遮陰脅迫會誘導植物體生長素含量上升從而產生庇蔭反應,然而過度遮陰會抑制植物體內生長素水平[36]。擬南芥在生長素信號傳導中起到重要作用[37],景寧木蘭基因在遮陰脅迫下顯著下調,推測其可能介導遮陰脅迫下景寧木蘭的生長素信號傳導過程。水楊酸在植物免疫和抗病反應中發揮重要作用,遮陰脅迫下植物水楊酸含量呈下降趨勢[38],擬南芥能夠調控水楊酸合成酶基因的表達[39]。遮陰脅迫下景寧木蘭下調,可能導致水楊酸合成受阻從而降低植物的抗性。景寧木蘭表達量呈下調趨勢,這與甘藍型油菜在溫度脅迫、損傷脅迫等非生物脅迫下的表達趨勢相一致[40]。
本研究基于景寧木蘭遮陰處理轉錄組數據,共鑒定得到12個景寧木蘭成員;其蛋白均為不穩定蛋白、親水性蛋白;12個TCPs均定位于細胞核,符合其轉錄因子特性,此外MsTCP20-a/b還定位于葉綠體;景寧木蘭TCPs成員可分為Class Ⅰ和Class Ⅱ 兩大類,Class Ⅰ包含10個TCPs成員,Class Ⅱ包含兩個TCPs成員,親緣關系較近的成員具有相似的保守基序;對景寧木蘭啟動子進行同源克隆后發現含有大量光響應和激素響應元件;景寧木蘭成員能夠響應遮陰脅迫,其中與表達量顯著上升,、、、表達量顯著下降。
[1] CHEN T T, ZHANG H J, ZENG R E, et al. Shade effects on peanut yield associate with physiological and expressional regulation on photosynthesis and sucrose metabolism [J]. Int J Mol Sci, 2020, 21(15): 5284. doi: 10.3390/ijms21155284.
[2] ZHAO D Q, HAO Z J, TAO J. Effects of shade on plant growth and flower quality in the herbaceous peony (Pall.) [J]. Plant Physiol Biochem, 2012, 61: 187–196. doi: 10.1016/j.plaphy.2012. 10.005.
[3] QIAN P X, LI X F, WU Y Y, et al. Influence of shading on growth and physiological characteristics of container seedlings of[J]. Jiangsu J Agric Sci, 2015, 31(3): 667–672. [錢萍仙, 李學孚, 吳月燕, 等. 遮陰對樟葉槭容器苗生長和生理特性的影響 [J]. 江蘇農業學報, 2015, 31(3): 667–672. doi: 10.3969/j.issn.1000-4440. 2015.03.032.]
[4] LI L, HUANG J Y, ZHANG S M, et al. Effect on different shade treatments of leaf color change of[J]. Mol Plant Breed, 2015, 13(5): 1135–1140. [李林, 黃潔瑜, 張水木, 等. 不同遮蔭處理對翠云草葉色變化的影響 [J]. 分子植物育種, 2015, 13(5): 1135–1140. doi: 10.13271/j.mpb.013.001135.]
[5] SETSUKO S, ISHIDA K, UENO S, et al. Population differentiation and gene flow within a metapopulation of a threatened tree,(Magnoliaceae) [J]. Am J Bot, 2007, 94(1): 128–136. doi: 10. 3732/ajb.94.1.128.
[6] JIANG G M, SUN G, ZHANG G F, et al. Intra and interspecific competition of endangered plant[J]. Chin J Ecol, 2010, 29(2): 201–206. [蔣國梅, 孫國, 張光富, 等. 瀕危植物寶華玉蘭種內與種間競爭 [J]. 生態學雜志, 2010, 29(2): 201–206. doi: 10. 13292/j.1000-4890.2010.0029.]
[7] YANG Y, JIA Z K, CHEN F J, et al. Optimal light regime for the rare speciesin northern China [J]. Plant Sci J, 2015, 33(3): 377–387. [楊楊, 賈忠奎, 陳發菊, 等. 珍稀樹種紅花玉蘭在華北地區的最適光環境 [J]. 植物科學學報, 2015, 33(3): 377–387. doi: 10.11913/PSJ.2095-0837.2015.30377.]
[8] YANG Q P, XIAO Z Y, HU X D, et al. Endangered mechanisms of: Exploring and prospect [J]. Guihaia, 2017, 37(5): 653–660. [楊清培, 肖智勇, 胡曉東, 等. 珍稀植物華木蓮的現代瀕危機制: 探析與展望 [J]. 廣西植物, 2017, 37(5): 653–660. doi: 10.11931/guihaia.gxzw201602006.]
[9] YU Q, WANG Q Y, LIU Z G, et al. Comparison of the light response models of photosynthesis in leaves ofunder different light intensity and moisture conditions [J]. Chin J Ecol, 2018, 37(3): 898–905. [俞芹, 王倩穎, 劉志高, 等. 光強與水分處理下景寧木蘭光合光響應模型擬合比較 [J]. 生態學雜志, 2018, 37(3): 898–905. doi: 10.13292/j.1000-4890.201803.017.]
[10] YU Z Z, CHEN X X, LU L, et al. Distribution and community structure of[J]. J Zhejiang For Sci Technol, 2015, 35(3): 47–52. [余澤智, 陳翔翔, 盧璐, 等. 玉景寧玉蘭種群分布與群落結構研究 [J]. 浙江林業科技, 2015, 35(3): 47–52. doi: 10.3969/j.issn. 1001-3776.2015.03.009.]
[11] MARTíN-TRILLO M, CUBAS P.genes: A family snapshot ten years later [J]. Trends Plant Sci, 2010, 15(1): 31–39. doi: 10.1016/j. tplants.2009.11.003.
[12] HOWARTH D G, DONOGHUE M J. Phylogenetic analysis of the “ECE” (CYC/TB1) clade reveals duplications predating the core eudicots [J]. Proc Natl Acad Sci USA, 2006, 103(24): 9101–9106. doi: 10.1073/pnas.0602827103.
[13] CUBAS P, LAUTER N, DOEBLEY J, et al. The TCP domain: A motif found in proteins regulating plant growth and development [J]. Plant J, 1999, 18(2): 215–222. doi: 10.1046/j.1365-313X.1999.00444.x.
[14] WANG X Y, XU X T, MO X W, et al. Overexpression ofdelaysflowering through a-dependent pathway [J]. BMC Plant Biol, 2019, 19(1): 534. doi: 10.1186/s12870- 019-2157-4.
[15] RESENTINI F, FELIPO-BENAVENT A, COLOMBO L, et al. TCP14 and TCP15 mediate the promotion of seed germination by gibberellins in[J]. Mol Plant, 2015, 8(3): 482–485. doi: 10. 1016/j.molp.2014.11.018.
[16] FAN H M, SUN C H, WEN Z L, et al. CmTCP20 plays a key role in nitrate and auxin signaling-regulated lateral root development in[J]. Plant Cell Physiol, 2019, 60(7): 1581–1594. doi: 10.1093/pcp/pcz061.
[17]BRESSO E G, CHOROSTECKI U, RODRIGUEZ R E, et al. Spatial control of gene expression by miR319-regulated TCP transcription factors in leaf development [J]. Plant Physiol, 2018, 176(2): 1694–1708. doi: 10.1104/pp.17.00823.
[18] AGUILAR-MARTI?NEZ J A, POZA-CARRIO?N C, CUBAS P.acts as an integrator of branching signals within axillary buds [J]. Plant Cell, 2007, 19(2): 458–472. doi: 10.1105/tpc. 106.048934.
[19] GUO Z X, FUJIOKA S, BLANCAFLOR E B, et al. TCP1 modulates brassinosteroid biosynthesis by regulating the expression of the key biosynthetic genein[J]. Plant Cell, 2010, 22(4): 1161–1173. doi: 10.1105/tpc.109.069203.
[20] YAO X, MA H, WANG J, et al. Genome-wide comparative analysis and expression pattern ofgene families inand[J]. J Integr Plant Biol, 2007, 49(6): 885–897. doi: 10. 1111/j.1744-7909.2007.00509.x.
[21] WEN B B, LUO Y, LIU D M, et al. Identification and expression profiling analysis offamily genes involved in growth and deve- lopment in[J]. Acta Hort Sin, 2019, 46(12): 2369– 2382. [溫貝貝, 羅勇, 劉冬敏, 等. 茶樹TCP轉錄因子的鑒定與表達分析 [J]. 園藝學報, 2019, 46(12): 2369–2382. doi: 10.16420/j.issn. 0513-353x.2019-0320.]
[22] MA J, WANG Q L, SUN R R, et al. Genome-wide identification and expression analysis of TCP transcription factors in[J]. Sci Rep, 2014, 4: 6645. doi: 10.1038/srep06645.
[23] DONG S S, LIU M, LIU Y, et al. The genome ofPamp. provides insights into the evolution of Magnoliales and biosyn- thesis of terpenoids [J]. Hort Res, 2021, 8: 38. doi: 10.1038/s41438- 021-00471-9.
[24] YU Q, SHEN Y M, WANG Q Y, et al. Light deficiency and water- logging affect chlorophyll metabolism and photosynthesis in[J]. Trees, 2019, 33(1): 11–22. doi: 10.1007/s00468-018- 1753-5.
[25] LU D Y, LIU B, REN M J, et al. Light deficiency inhibits growth by affecting photosynthesis efficiency as well as JA and ethylene signaling in endangered plant[J]. Plants, 2021, 10(11): 2261. doi: 10.3390/plants10112261.
[26] GUAN Z W, CAO X Y, ZHANG X W, et al. Genome-wide identi- fication and expression analysis of TCP gene family in rice (L.)[J]. Mol Plant Breed, 2022, 20(10): 3145–3156. [關紫微, 曹希雅, 張先文, 等. 水稻TCP家族的全基因組鑒定及表達水平分析 [J]. 分子植物育種, 2022, 20(10): 3145–3156. doi: 10.13271/j.mpb.020. 003145.]
[27] ZHOU Q Y, HAN Y H, ZHU Y, et al. Genome-wide identification, classification and expression analysis of TCP gene family in tea plant [J]. Acta Hort Sin, 2019, 46(10): 2021–2036. [周棋贏, 韓月華, 祝悅, 等. 茶樹TCP家族的全基因組鑒定及其表達分析 [J]. 園藝學報, 2019, 46(10): 2021–2036. doi: 10.16420/j.issn.0513-353x.2019-0389.]
[28] LIU M M. Genome-wide analysis ofgenes inL. and identification of candidates involved in regulating branching development [D]. Chongqing: Southwest University, 2020. [劉明明. 甘藍型油菜基因的全基因組分析及其中調控分枝發育基因的鑒定 [D]. 重慶: 西南大學, 2020.]
[29] SHI P B. Identification and function analvsis of TCP transcription factors in watermelon [D]. Hangzhou: Zhejiang University, 2016. [時丕彪. 西瓜TCP轉錄因子的鑒定及功能分析 [D]. 杭州: 浙江大學, 2016.]
[30] LIU H Y, GUO X T, LI Y, et al. Research progress of promoters in plant genetic engineering [J/OL]. Mol Plant Breed, (2022-03-11). [劉慧玉, 郭曉彤, 李悅, 等. 植物基因工程中啟動子的研究進展 [J]. 分子植物育種, [2022-03-11]. https://kns.cnki.net/kcms/detail/46.1068. S.20220309.1928.014.html.]
[31] HAN J H, LIU J F, LIU H M. Identification and characterization of TCP transcription factors in[J]. Mol Plant Breed, 2020, 18(16): 5261–5267. [韓繼紅, 劉金鳳, 劉慧敏. 桃TCP轉錄因子家族的鑒定與分析 [J]. 分子植物育種, 2020, 18(16): 5261–5267. doi: 10.13271/j.mpb.018.005261.]
[32] BAUER H, ACHE P, LAUTNER S, et al. The stomatal response to reduced relative humidity requires guard cell-autonomous ABA synthesis [J]. Curr Biol, 2013, 23(1): 53–57. doi: 10.1016/j.cub.2012. 11.022.
[33] GERARDIN T, DOUTHE C, FLEXAS J, et al. Shade and drought growth conditions strongly impact dynamic responses of stomata to variations in irradiance in[J]. Environ Exp Bot, 2018, 153: 188–197. doi: 10.1016/j.envexpbot.2018.05.019.
[34] MISHRA S, SAHU G, SHAW B P. Insight into the cellular and physiological regulatory modulations of Class‐I TCP9 to enhance drought and salinity stress tolerance in cowpea [J]. Physiol Plant, 2022, 174(1): e13542. doi: 10.1111/ppl.13542.
[35] WANG H P. Cloning, expression analysis and overexpression ofin[D]. Chongqing: Southwest University, 2013. [王會平. 矮牽牛基因的克隆、表達分析及超量表達研究 [D]. 重慶: 西南大學, 2013.]
[36] HAN S, CHEN S M, JIANG J F, et al. Hormone levels and gene expression analysis ofcultivar ‘puma sunny’ under low light intensity [J]. Sci Agric Sin, 2015, 48(2): 324–333. [韓霜, 陳素梅, 蔣甲福, 等. 弱光下菊花‘清露’的激素水平及相關基因表達 [J]. 中國農業科學, 2015, 48(2): 324–333. doi: 10.3864/j.issn.0578- 1752.2015.02.12.]
[37] FERRERO L V, GASTALDI V, ARIEL F D, et al. Class I TCP proteins TCP14 and TCP15 are required for elongation and gene expression responses to auxin [J]. Plant Mol Biol, 2021, 105(1/2): 147–159. doi: 10.1007/s11103-020-01075-y.
[38] XU Y. Study on the mechanical properties of soybean plant by canopy spectral composition and hormone regulation [D]. Harbin: Northeast Agricultural University, 2020. [徐瑤. 大豆植株力學特性受冠層光譜組成與激素調控的研究 [D]. 哈爾濱: 東北農業大學, 2020.]
[39] WANG X Y, GAO J, ZHU Z, et al. TCP transcription factors are critical for the coordinated regulation ofexpression in[J]. Plant J, 2015, 82(1): 151–162. doi: 10.1111/tpj.12803.
[40] LIU S S, JIANG X F, YUE C, et al. Cloning and expression aanalysis ofgene inL. [J]. Acta Bot Boreali-Occid Sin, 2018 38(7): 1187–1193. [劉雙雙, 蔣學飛, 岳出, 等. 甘藍型油菜基因的克隆和表達分析 [J]. 西北植物學報, 2018, 38(7): 1187–1193. doi: 10.7606/j.issn.1000-4025.2018.07.1187.]
Identification of TCP Family inand Expression Patterns of TCPs Under Shading Stress
REN Mingjie, LU Danying, WU Chao, ZHU Senyu, CHEN Xiaojun, WU Yufeng, SHEN Yamei, MA Jingjing*
(School of Landscape Architecture, Zhejiang Provincial Key Laboratory of Germplasm Innovation and Utilization for Garden Plants, Key Laboratory of National Forestry and Grassland Administration on Germplasm Innovation and Utilization for Southern Garden Plants, Zhejiang A&F University, Hangzhou 311300, China)
In order to investigate the role of TCP transcription factors family of 3-year-oldgrafted seedlings under simulated natural shading, the bioinformation of TCP transcription factors were analyzed based on transcriptome data, as well as their expression patterns under shading stress. The results showed that 12were identified from the transcriptome data of, encoding 228-558 amino acids with protein size of 23.7-52.7 kDa. All of 12 TCPs proteins were unstable and hydrophilic. The 12 TCPs located in cell nucleus, and MsTCP12-a/b also located in chloroplast. MsTCPs could be divided into two types, Class I contained 10 TCP members, and Class II with two TCP members. All members contained TCP conserved domains and the closely TCP members had similar conserved motifs. Meanwhile, thepromoter sequences ofwere cloned and analyzed, which contained a large number of light response elements and hormone response elements. Thewere differentially expressed under shading treatment.,were significantly up-regulated and,,,were significantly down-regulated. Therefore,might play an important role in response to shade stress.
TCP transcription factor family;; Shading; Gene expression
10.11926/jtsb.4663
2022-04-28
2022-06-15
浙江省“十四五”育種專項(2021C02071-3)資助
This work was supported by the Special Project for the 14th Five Breeding of Zhejiang (Grant No. 2021C02071-3).
任明杰(1997年生),男,碩士研究生,從事景寧木蘭瀕危機制研究。E-mail: 965531426@qq.com
. E-mail: jingjingma@zafu.edu.cn

