內源性Ghrelin對重癥急性胰腺炎大鼠的保護作用及機制*
王統華, 覃月秋, 黃美英, 易廷莊, 胡高裕
(右江民族醫學院附屬醫院 消化內科, 廣西 百色 533000)
急性胰腺炎(acute pancreatitis,AP)是一種常見的臨床疾病,起病急、進展快、進程中容易出現多種并發癥且死亡率高,重癥急性胰腺炎(severe acute pancreatitis,SAP)還可能引起除胰腺外全身系統炎癥反應,甚至可能導致器官衰竭,預后危險[1]。近年來,AP的死亡率也逐漸增多,各種炎癥介質、細胞因子以及激素等因素在SAP的發生發展中都有參與。Ghrelin是生長激素促分泌素受體 (growth hotmonese cretagogue receptor,GHS-R)的內源性配體,是最近發現的具有多種生物功能的含28個氨基酸的小分子腸道肽,當Ghrelin與其GHS-R結合后,具有刺激垂體前葉釋放生長激素,增加食欲,調節能量代謝平衡以及促進胃酸分泌等生物學功能,但其作用機理目前尚不清楚[2-4],有研究表明Ghrelin可能參與AP的發生發展過程[5-6]。 此外,血清淀粉酶、白細胞介素6(interleukin-6,IL-6)、腫瘤壞死因子(tumor necrosis factor-a,TNF-α)和核因子(nuclear factor κB,NF-κB)也可能參與在AP的病程中[7-8]。在本研究中,通過注射牛磺膽酸鈉復制AP動物模型,同時建立GHS-R拮抗組進行實驗驗證,觀察模型大鼠的血清蛋白、Ghrelin的表達水平以及其與反映AP嚴重程度的參數、炎癥因子和氧化應激的關系,并測量了IL-6和TNF-α的表達水平,報告如下。
1 材料與方法
1.1 材料
1.1.1實驗動物 選擇48只10~12周齡健康大鼠(SPF級),體質量200~235 g,由右江民族醫學院提供。
1.1.2試劑及儀器 5%的牛磺膽酸鈉(Simga公司),10%水合氯醛,Ghrelin(上海博宏生物科技有限公司);微量注射器、電泳槽、全自動酶標儀Multiskan MK3(美國伯樂生命醫學產品上海有限公司),RT-PCR儀(Bio-Rad公司),JEM-2100F掃描透射電子顯微鏡(日本電子株式會社),凝膠成像系統(英國基因技術有限公司)。
1.2 研究方法
1.2.1動物分組與造模 隨機將48只大鼠隨機分為對照組、模型組、治療組及拮抗組,每組12只。實驗前所有動物在同一環境、晝夜交替喂養7 d,術前常規禁食12 h,10%水合氯醛按照0.3 mL/100 g劑量腹腔注射麻醉。模型組大鼠選擇大鼠腹部沒有血管的區域對胰膽管進行穿刺,按逆行方向注射5%的牛磺膽酸鈉誘發大鼠SAP[9]。對照組大鼠處理方式與模型組一致,但不注射牛磺膽酸鈉。治療組大鼠:于制模后1 h給予腹腔注射Ghrelin。拮抗組:在制模前30 min給予腹腔注射生長激素釋放肽(Growth hormone releasing peptide,GHRP-6),制模后1 h再腹腔注射Ghrelin。如果過程中出現大鼠因胰腺炎程度過重而未能存活的情況,應重新選擇大鼠進行SAP造模補充。
1.2.2樣本提取 (1)各組大鼠均在麻醉后2 h心臟取血,留樣標注;(2)心臟取血后處死大鼠,收集胰腺組織,稱重并計算胰腺質量指數;部分組織經PBS洗滌后,用4%多聚甲醛固定,其余組織被儲存在液氮用于后續指標測量。
1.2.3血清淀粉酶、IL-6、TNF-α、NF-κB檢測 采用酶聯免疫吸附(Enzyme linked immunosorbent assay,ELISA)法測定各組大鼠血清淀粉酶、IL-6、TNF-α、NF-κB的表達水平。
1.2.4胰腺IL-6、TNF-α、NF-κB mRNA表達水平 采用實時定量熒光PCR法測定,從各組大鼠的胰腺組織中提取mRNA,逆轉錄獲得cDNA,采用SYBR Advantage Real-timePCR Premix 試劑盒進行熒光定量反應,檢測各組大鼠胰腺IL-6、TNF-α、NF-κB mRNA表達水平。
1.2.5胰腺組織病理檢查及病理評分 將上述經PBS洗滌后固定在4%多聚甲醛的胰腺組織取出切片、脫水、染色、沖洗封片之后,在光學顯微鏡下觀察胰腺組織病理學形態,并根據胰腺組織病理評分標準進行病理學評分。
1.3 統計學處理
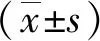
2 結果
2.1 胰腺質量指數
與對照組相比,模型組胰腺質量指數升高,差異具有統計學意義(P<0.05),表明大鼠AP時胰腺明顯腫大;與模型組相比,治療組胰腺質量指數減少,差異具有統計學意義(P<0.05),表明Ghrelin可以改善胰腺炎大鼠的胰腺腫大;與治療組相比,拮抗組胰腺質量指數升高,差異具有統計學意義(P<0.05),表明GSH-R拮抗可影響Ghrelin對胰腺炎大鼠的治療效果。見圖1。

注:(1)與對照組比較,P<0.05;(2)與模型組比較,P<0.05;(3)與治療組比較,P<0.05。
2.2 血清淀粉酶、IL-6、TNF-α及NF-κB表達
檢測結果(圖2)顯示,與對照組相比,模型組的大鼠血清淀粉酶、IL-6、TNF-α及NF-κB表達水平均有明顯升高(P<0.01);與模型組相比,治療組血清淀粉酶、IL-6、TNF-α及NF-κB表達水平明顯降低(P<0.01);與治療組相比,拮抗組血清淀粉酶、IL-6、TNF-α、NF-κB表達水平明顯升高(P<0.01)。
2.3 胰腺組織IL-6、TNF-α、NF-κB mRNA表達
4組胰腺組織IL-6、TNF-α、NF-κB mRNA的表達結果顯示(圖3),與對照組相比,模型組的IL-6、TNF-α、NF-κB mRNA的表達量有明顯升高(P<0.01);與模型組比較,治療組IL-6、TNF-α、NF-κB mRNA的表達量都明顯降低(P<0.01);與治療組比較,拮抗組IL-6、TNF-α、NF-κB mRNA的表達量有明顯升高(P<0.01)。

注:(1)與對照組比較,P<0.01;(2)與模型組比較,P<0.01;(3)與治療組比較,P<0.01。
2.4 胰腺組織病理變化及病理評分
由圖4可見,對照組大鼠的胰腺可見胰腺細胞結構正常,血管紋理清晰,無水腫壞死;模型組大鼠的胰腺間質浸潤,出現組織壞死及多處出血灶;治療組胰腺間質水腫,炎癥細胞浸潤,胰腺輕度炎癥;拮抗組胰腺組織出現出血灶,壞死水腫。評分見表1。
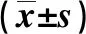
表1 各組大鼠胰腺組織病理評分結果

注:A:對照組;B:模型組;C:治療組;D拮抗組
3 討論
SAP是一種病情嚴重的急性炎癥性疾病,目前占所有胰腺炎病例的2%[10]。許多關于SAP的研究發現,體內的各種炎癥介質和細胞因子參與了SAP的發展,并且是一個持續的發展過程。目前已知的與胰腺炎有關的炎癥因子有血清淀粉酶、IL-6和TNF-α等[11]。有文獻報道,Ghrelin可以抑制炎癥反應期間的炎癥反應因子的釋放[12]。在一項關于AP的臨床研究中,Dembinski等[13]分別用雨蛙素及脂多糖誘導急性水腫性胰腺炎(AEP)和急性壞死性胰腺炎(ANP),發現在AP發病24 h后血清Ghrelin水平開始上升,ANP組的Ghrelin水平高于AEP組,提示Ghrelin可以作為判斷AP嚴重程度的標志物之一。
淀粉酶水平是診斷急性胰腺炎最常用的生化標志物[14],而IL-6和TNF-α是診斷和預后SAP的重要標志物。TNF-α與各種炎癥反應的發生密切相關[15]。當體內TNF-α水平升高時,可刺激炎癥細胞產生各種組織損傷因子,從而促使胰腺炎的發生,也成為診斷胰腺炎的重要標志物之一。本實驗證實了大鼠SAP模型的成功制備以及內源性Ghrelin對SAP治療的影響,表現為血清淀粉酶水平的明顯增加和TNF-α水平的變化。
IL-6是一種細胞因子,在全身性炎癥反應中起著關鍵作用,在AP進程中,體內IL-6水平明顯增高,而過多的IL-6存在會刺激機體產生大量的抗體,引起細胞有害毒效應,高水平IL-6可以和TNF-α協同作用,產生微循環血凝塊,損害身體,導致全身多器官損害反應[16-17]。因此,IL-6水平的升高與SAP的嚴重程度密切相關,IL-6已成為研究SAP疾病進展的一個重要標志物。本研究再次證實了SAP造模成功以及內源性Ghrelin在治療SAP方面的功效。
NF-κB是AP發展的一個重要標志物,是許多炎癥因子(如TNF-α)的啟動劑[18],抑制NF-κB可能有效地減緩SAP的進展。本研究表明,與對照組比較,模型組的NF-κB明顯升高,在治療組被Ghrelin抑制,其表達也有所下降;與治療組比,拮抗組NF-κB表達有增高,表明GSH-R抑制了Ghrelin因子的表達,導制其無法發揮抗炎作用。NF-κB的表達水平和內源性Ghrelin對SAP治療的影響,證實了SAP模型制備的成功以及Ghrelin在治療SAP方面的作用。
綜上所述,本研究采用5%牛磺膽酸鈉成功制備大鼠SAP模型,發現內源性Ghrelin對模型大鼠的胰腺功能有明顯的改善,在Ghrelin治療下,炎癥因子IL-6、TNF-α、NF-κB的表達水平明顯得到抑制,降低了炎癥因子mRNA的表達,從而降低炎癥對機體的損害,達到對大鼠胰腺的保護作用,為今后Ghrelin對SAP的治療奠定了實驗基礎和理論依據。

