Sdf1-Cxcr4信號在斑馬魚后側線系統發育中的作用?
周董華 , 王承昊, 范純新??
(1. 上海海洋大學 國家海洋生物科學國際聯合研究中心, 上海 201306; 2.上海海洋大學 水產種質資源發掘與利用教育部重點實驗室, 上海 201306)
側線系統為魚類和兩棲類所特有,由廣泛分布于體表的感覺器官神經丘構成。側線系統對于魚類水下生活極為重要,參與魚類的避敵、捕食、群游和洄游等行為[1]。成魚側線感受器的分布模式具有顯著的多樣性,為魚類適應不同的水流環境提供結構基礎[2-4]。但是,目前對于魚類側線系統分布模式形成的機制知之甚少。
斑馬魚(Daniorerio)作為模式生物,在其后側線系統發育研究中取得了許多進展,對于理解魚類側線發育調控機制和模式形成起到重要作用。斑馬魚后側線系統源自于耳后的后側線基板(Posterior lateral line placode)。受精后約20 h時,在側線基板上特化形成初級后側線原基(Prim-Ⅰ),并延水平肌隔向尾部遷移,于受精后約40 h抵達尾部。原基在遷移路徑上留下少量細胞形成神經丘前體(Proto-neuromast),進一步分化為神經丘,排布形成體側中線。在初級原基遷移過程中(受精后約36 h),后側線基板又形成次級原基,包括Prim-Ⅱ和Prim-D。Prim-Ⅱ沿水平肌隔遷移,Prim-D向背側遷移形成背線。從約受精后3周開始,位于體側中線和背線上的神經丘開始向腹側遷移,同時在原有神經丘間形成新的間生神經丘(Intercalary neuromast),在仔稚魚轉換期產生軀干上的4條線。在發育至受精后2個月左右,軀干上的部分神經丘開始向周圍遷移出部分細胞,由這些細胞增殖分化形成一些附屬神經丘,因其排列致密成串,稱為針腳神經丘(Stitches neuromast)[5]。綜上,斑馬魚的后側線系統發育存在多個細胞遷移過程。
Sdf1-Cxcr4信號在胚胎發育、免疫細胞動員和癌細胞轉移等多種細胞遷移過程中發揮重要作用。Sdf1又稱為Cxcl12,為趨化因子,其受體包括兩類G蛋白偶聯受體:Cxcr4和Cxcr7。當Cxcr4結合Sdf1時,通過G蛋白激活胞內多種信號通路引起遷移、增殖和炎癥相關基因的表達[6-7],當Cxcr7結合Sdf1時,不會激活典型的趨化反應,Cxcr7和Sdf1同時內化,抑制Sdf1-Cxcr4信號[8]。David等[9]和Valentin[10]發現初級側線原基的遷移受到Sdf1-Cxcr4信號的調控。
PLLs發育的第一步是Prim-Ⅰ沿著水平肌間隔遷移,該過程由Sdf1/Cxcr4信號的梯度濃度驅動[11]。Sdf1同Cxcr7的親和力幾乎是同Cxcr4的10倍[12]。Cxcr7可以降低Sdf1的胞外濃度,使Sdf1濃度保持在最佳水平,從而形成細胞遷移所需的趨化因子梯度[13]。斑馬魚的sdf1a在水平肌間隔的尾部表達,cxcr4b表達在遷移側線原基的引導區,cxcr7b表達于遷移側線原基的尾隨區。但是,斑馬魚后側線發育過程中其他的細胞遷移事件是否也受Sdf1-Cxcr4調控尚不清楚。有研究表明,過表達cxcr7b可以沉默斑馬魚后側線Prim-Ⅰ中后部的sdf1a信號活性,而敲除或敲降sdf1a或cxcr4b會抑制側線Prim-Ⅰ的遷移[14]。本研究中,通過構建熱激啟動子控制的過表達cxcr7b轉基因斑馬魚發現,在不同時間點過表達cxcr7b抑制了Sdf1-Cxcr4信號,檢測出過表達cxcr7b對Prim-Ⅰ和Prim-Ⅱ遷移、神經丘腹側遷移、間生神經丘形成和針腳神經丘形成的影響,為理解魚類側線系統發育調控機制奠定基礎。
1 材料與方法
1.1 材料
實驗用魚為AB品系野生型斑馬魚和ET(gata2:EGFP)189b(簡稱ET189b) 斑馬魚[15]養殖于上海海洋大學海洋生物系統和神經科學研究所。魚房環境溫度為26~28 ℃,光周期明∶暗=14 h∶10 h。按照成魚雌、雄比例1∶1進行交配產卵,獲得的胚胎用藍水(0.3 g/L紅海鹽和1 mg/L亞甲基藍)培養于28.5 ℃培養箱中。所有魚類的實驗均符合上海海洋大學動物倫理委員會的規定。質粒pTol2-hsp70l-Tnfrsfa-P2A-mCherry為實驗室前期構建,含Tol2轉座酶的質粒pCS2-TPase來自美國國立衛生研究院(NIH) Shawn Burgess實驗室。引物由安升達公司合成。
1.2 整體胚胎原位雜交
整體原位雜交實驗參考文獻[16]中的流程。野生型斑馬魚受精后32 h胚胎和受精后72 h仔魚經 4% 多聚甲醛(PFA) 于4 ℃過夜進行固定,第二天使用甲醇梯度脫水后保存于-20 ℃。保存過的樣品首先經過含吐溫20的磷酸緩沖液(PBST) 梯度復水,其次用 10%過氧化氫溶液脫色至胚胎黑色素消失,然后用不含反義探針的雜交液于70 ℃孵育樣品4 h,后加入含反義探針的雜交液于70 ℃孵育過夜。樣品依次經過漂洗、封閉、抗體孵育和漂洗等步驟,最后用NBT/BCIP stock solution (Roche)在室溫下顯色。顯色完成后,使用4% PFA 終止顯色反應,再用PBST 多次漂洗后置于 100%甘油中避光保存,最后用光學顯微鏡(Nikon)觀察并拍照。
1.3 質粒pTol2-hsp70l:cxcr7b-P2A-mCherry的構建
以受精后4 d 的野生型斑馬魚cDNA為模板,用引物Cxcr7b-ORF-F和Cxcr7b-ORF-R (見表1)擴增得到cxcr7b的開放閱讀框作為插入片段;以質粒pTol2-hsp70l-Tnfrsfa-P2A-mCherry為模板,用引物Cxcr7b-VEC-F和Cxcr7b-VEC-R (見表1)擴增得到載體骨架,并使插入片段和載體骨架兩末端具有一致的同源序列。根據ClonExpress ⅡOne Step Cloning Kit (Vazyme)說明書中的方法進行同源重組連接,將目的片段定向克隆至載體的同源位點,將新重組質粒轉化E.coliDH5α感受態細胞(Vazyme),然后提取質粒,送上海生工測序得到重組質粒pTol2-hsp70l:cxcr7b-P2A-mCherry(見圖1)。

圖1 質粒圖譜

表1 基因引物信息
1.4 Tol2轉座酶mRNA的體外轉錄
用限制性內切酶XbaⅠ(Thermo Fisher Scientific) 酶切質粒pCS2-TPase。以線性化的pCS2-TPase質粒DNA作為模板,采用SP6 mMessage mMachine kit (Ambion)試劑盒進行體外轉錄合成Tol2 轉座酶mRNA。轉錄出的Tol2 轉座酶mRNA由Quick-RNA MicroPrep Kit (ZYMO RESEARCH)純化回收。
1.5 建立Tg(hsp70l:cxcr7b-P2A-mCherry)轉基因魚
顯微注射前一天晚上將AB斑馬魚按照雌、雄比例1∶1放入孵化盒中,用隔板將雌雄分開。第二天早晨抽去隔板,斑馬魚產卵后收集魚卵,用于顯微注射。配制質粒pTol2-hsp70l:cxcr7b-P2A-mCherry和 Tol2轉座酶mRNA混合液(使每1 μL混合液里含有25 ng質粒和50 ng Tol2轉座酶 mRNA)。將混合液注射至1-細胞期胚胎的胞質,注射劑量為1.4 nL/枚。將經過注射的F0胚胎養至性成熟,并與AB進行雜交。選擇其后代胚胎熱激后具有紅色熒光的F0作為建立者(Founder),并將帶有紅色熒光的胚胎養至性成熟,以作為Tg(hsp70l:cxcr7b-P2A-mCherry)穩定遺傳的轉基因個體。
1.6 熱激過表達cxcr7b
將cxcr7b和ET189b轉基因斑馬魚進行交配,獲得的胚胎培養在藍水中。在受精后18 h篩選具有綠色熒光的胚胎,并將這些胚胎分為5組,每組約50顆受精卵,然后按照表2中的時段進行熱激(每間隔12 h,39 ℃熱激1 h,然后轉至28.5 ℃培養)。完成熱激后,在相應的時間點在熒光倒置顯微鏡 (Zeiss, Axio Observer)的GFP通道下,對后側線原基所處體節的位置、神經丘數量和神經丘距離水平肌節的距離進行拍照和測量。同時,在DsRed通道下根據紅色熒光確定每條魚是否帶有cxcr7b轉基因,帶有紅色熒光的作為實驗組,而不帶紅色熒光的作為對照組。

表2 實驗設計
1.7 數據統計分析
每個實驗的實驗組和對照組樣本量都大于10。使用蔡司公司的ZEN軟件分別對遷移距離和神經丘數量進行測量和計數,將所得的數據輸入至Graphpad prism 7軟件,以對每個實驗的實驗組和對照組數據使用t-檢驗來分析數據間差異性,其中p<0.05(用*表示)和p<0.000 1(用****表示)分別表示差異顯著和差異極顯著。顯示遷移距離的柱狀圖也是由Graphpad prism 7 軟件生成的。
2 結果
2.1 cxcr4b和sdf1a分別表達于遷移中的后側線原基和水平肌間隔
受精后32 h是斑馬魚后側線Prim-Ⅰ和PrimⅡ的遷移時間,受精后72 h是斑馬魚后側線Prim-D的遷移時間。本研究利用整體原位雜交技術,檢測了cxcr4b和sdf1a在受精后32 h胚胎和在受精后72 h仔魚中的表達定位。結果顯示:在受精后32 h,cxcr4b在整個Prim-Ⅰ中高表達,且在Prim-Ⅰ引導端的表達強于后隨端(見圖2A)。sdf1a主要表達在水平肌隔尾部,且沿著頭部向尾部方向逐漸提高(見圖2C)。在受精后72 h,cxcr4b的表達則集中在Prim-Ⅱ和Prim-D(見圖2B);sdf1a主要表達在水平肌隔的前端和軀干的背側(見圖2D)。由此可見,cxcr4b和sdf1a分別表達于遷移中的后側線原基和水平肌間隔。
2.2 過表達cxcr7b對Prim-Ⅰ遷移的影響
為了檢測Sdf1-Cxcr4信號在后側線Prim-Ⅰ遷移中的作用,本文作者構建了cxcr7b轉基因魚,通過熱激過表達cxcr7b,進而抑制Sdf1-Cxcr4信號。結果表明:熱激后的cxcr7b轉基因胚胎同野生型在外觀形態上沒有明顯的差異。在ET189b背景下,本文作者觀察到野生型的Prim-Ⅰ在32 h遷移至軀干第(9.750 0±0.217 6)個體節,在受精后48 h遷移至尾部末端。但在cxcr7b轉基因個體中Prim-Ⅰ在受精后32 h僅遷移至第(4.083 0±0.193 0)個體節,差異顯著(p<0.000 1) (見圖3A、C);在受精后48 h僅遷移至第(10.000 0±0.492 4)個體節,差異顯著(p<0.000 1) (見圖3B、D)。基于Prim-Ⅰ所處體節位置,定量分析顯示cxcr7b轉基因個體Prim-Ⅰ的遷移顯著慢于野生型Prim-Ⅰ的遷移。

(A:野生型和cxcr7b轉基因斑馬魚在受精后32 h Prim-Ⅰ所處位置。B:野生型和cxcr7b轉基因斑馬魚在受精后48 h Prim-Ⅱ所處位置。比例尺=100 μm。C:野生型和cxcr7b轉基因斑馬魚在受精后32 h Prim-Ⅰ所處體節數定量分析。D:野生型和cxcr7b轉基因斑馬魚在受精后48 h Prim-Ⅰ所處體節數定量分析。: p <0.000 1。WT: 野生斑馬魚。 Tran-cxcr7b: cxcr7b轉基因斑馬魚。A: The position of Prim-Ⅰ in wild-type and cxcr7b transgenic zebrafish at the 32 h post-fertilization. B: The position of Prim-Ⅱ in wild-type and cxcr7b zebrafish at 48 h post-fertilization. Scale bar=100 μm. C: The quantification analysis of the position of Prim-Ⅰ in wild-type and cxcr7b transgenic zebrafish at 32 h post-fertilization. D: The quantification analysis of the position of Prim-Ⅰ in wild-type and cxcr7b transgenic zebrafish at 48 h post-fertilization. : P <0.000 1. WT: Wild-type zebrafish. Tran-cxcr7b:cxcr7b transgenic zebrafish. )
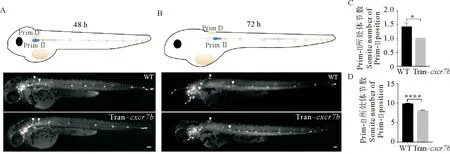
(A:野生型和cxcr7b轉基因斑馬魚在受精后48 h Prim-Ⅱ和Prim-D所處位置。B:野生型和cxcr7b轉基因斑馬魚在受精后72 h Prim-Ⅱ和Prim-D所處位置。比例尺=100 μm。C:野生型和cxcr7b轉基因斑馬魚在受精后48 h Prim-Ⅱ所處體節數定量分析。D:野生型和cxcr7b轉基因斑馬魚在受精后72 h Prim-Ⅱ所處體節數定量分析。: P <0.05; :P <0.000 1。WT: 野生斑馬魚。 Tran-cxcr7b: cxcr7b轉基因斑馬魚。 A: The position of Prim-Ⅱ and Prim D in wild-type and cxcr7b transgenic zebrafish at the 48 h post-fertilization. B: The position of Prim-Ⅱ and Prim D in wild-type and cxcr7b transgenic zebrafish at the 72 h post-fertilization. Scale bar = 100 μm. C: The quantification analysis of the position of Prim-Ⅱ in wild-type and cxcr7b tiansgenic zebrafish at 48 h post-fertilization. D: The quantification analysis of the position of Prim-Ⅱ in wild-type and cxcr7b transgenic zebrafish at 72 h post-fertilization. : P< 0.05; : P< 0.000 1. WT: Wild-type zebrafish. Tran-cxcr7b:cxcr7b transgenic zebrafish. )
2.3 過表達cxcr7b對Prim-Ⅱ遷移的影響
在Prim-Ⅰ遷移至尾部后,耳后的側線基板處形成新的原基(Prim-Ⅱ和Prim-D),它們分別向尾部和背部遷移。為了探究Sdf1-Cxcr4信號在Prim-Ⅱ和Prim-D遷移過程中的作用,本文作者從受精后45 h開始熱激,然后在受精后48和72 h對野生型和cxcr7b轉基因個體的Prim-Ⅱ和Prim-D的遷移位置進行觀察。對于野生型而言,在受精后48 h,Prim-Ⅱ和Prim-D剛剛開始從后側線基板處遷出,遷移至第(1.417 0±0.148 6)體節;在受精后72 h,Prim-Ⅱ大致到達第(9.786 0±0.238 6)體節,Prim-D已接近背中線。在受精后48 h,cxcr7b轉基因個體的Prim-Ⅱ和Prim-D遷移至第1體節,差異顯著(p=0.010 4) (見圖3A、C);在受精后72 h,cxcr7b轉基因個體的Prim-Ⅱ大約遷移至第(8.000 0±0.209 7)體節,差異顯著(p<0.000 1) (見圖3B、D)。Prim-D距離背側中線還存在一定的距離,它們的遷移速度均顯著慢于對照組。
2.4 過表達cxcr7b對體側中線神經丘腹側遷移和神經丘生成數量的影響
從受精后3 d開始,斑馬魚軀干中線的神經丘開始向腹側遷移。本文作者在斑馬魚受精后3 d對cxcr7b轉基因和野生型進行熱激,受精后6和10 d分別測量體側中線神經丘與水平肌隔的距離。結果顯示:在受精后6 d,野生型組與過表達cxcr7b組兩組體側中線神經丘的腹側遷移距離分別為(76.980 0±1.760 0)和(76.410 0±1.783 0) μm,兩者差異不顯著(p=0.822 3) (見圖5A、C);在受精后10 d,野生型組與過表達cxcr7b組體側中線神經丘的腹側遷移距離分別為(74.520 0± 1.958 0)和(71.970 0±3.044 0) μm,兩者差異不顯著(p=0.532 9) (見圖5B、E)。
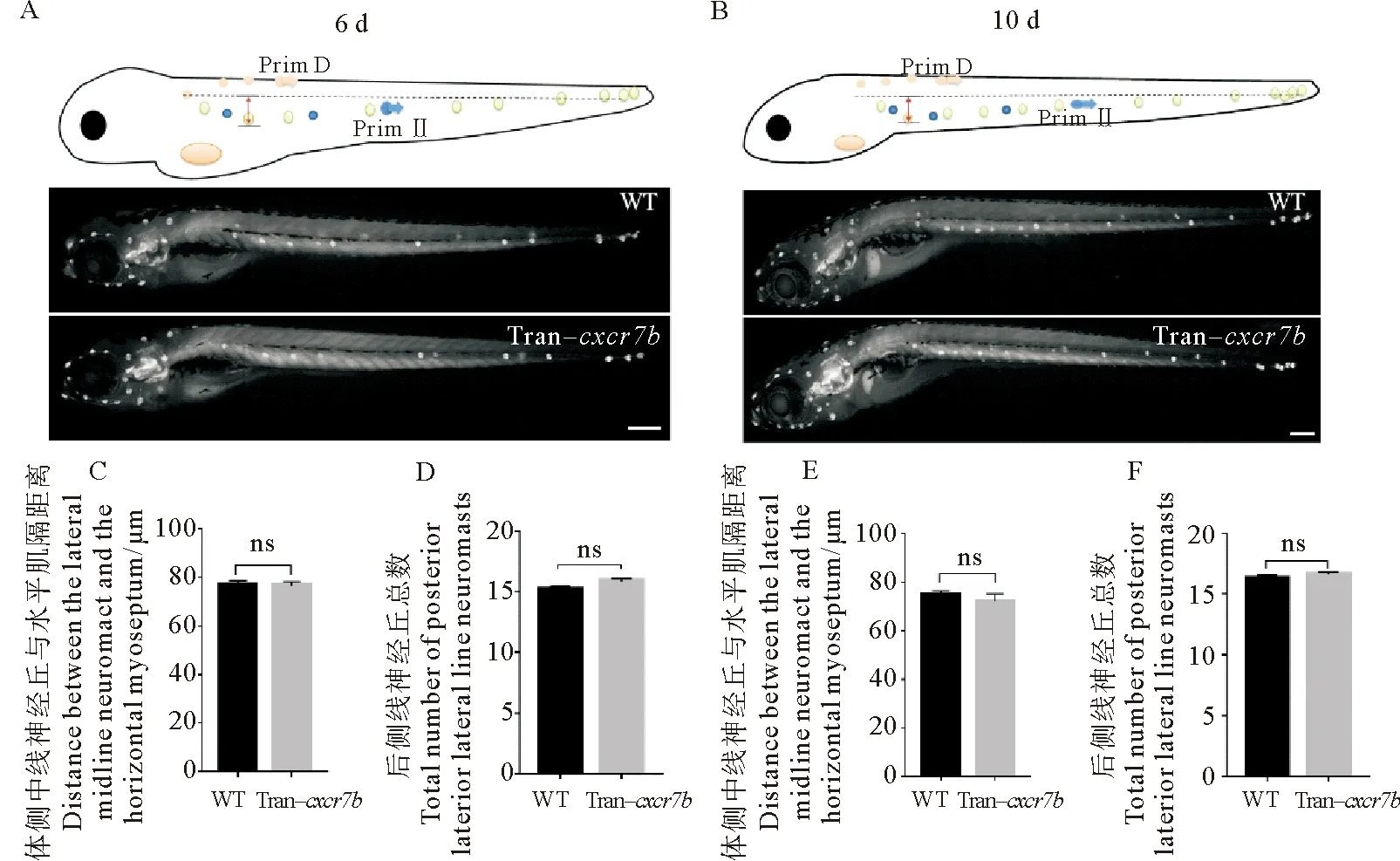
(A:野生型和cxcr7b轉基因斑馬魚在受精后6 d側線神經丘所處位置。B:野生型和cxcr7b轉基因斑馬魚在受精后10 d側線神經丘所處位置。比例尺=500 μm。C、E:表示野生型和cxcr7b轉基因斑馬魚在受精后6和10 d體側中線神經丘與水平肌隔的距離比較。D、F:分別表示野生型和cxcr7b轉基因斑馬魚在受精后6和10 d的側線神經丘總數比較。ns:無顯著性差異。WT: 野生斑馬魚。 Tran-cxcr7b: cxcr7b轉基因斑馬魚。A: The position of lateral line neuromast in wild-type and cxcr7b transgenic zebrafish at the 6 d post-fertilization. B: The position of lateral line neuromast in wild-type and cxcr7b transgenic zebrafish at the 10 d post-fertilization. Scale bar = 500 μm. C,E: The comparison of the distance between the lateral midline neuromast and the horizontal myoseptum in wild-type and cxcr7b transgenic zebrafish at 6 and 10 d post-fertilization. D, F: The comparison of the total number of lateral line neuromasts in wild-type and cxcr7b transgenic zebrafish at 6 and 10 d post-fertilization. ns: No significant difference. WT: Wild-type zebrafish. Tran-cxcr7b:cxcr7b transgenic zebrafish. )
另外,本文作者通過計數后側線單側的神經丘總數反映后側線神經丘的數量。結果顯示:在受精后6 d,野生型組與過表達cxcr7b組單側側線神經丘總數分別為(15.200 0±0.279 5)和(15.870 0±0.236 4)個,兩者差異不顯著(p=0.079 2) (見圖5A、D);在受精后10 d,野生型組與過表達cxcr7b組單側側線神經丘總數分別為(16.310 0±0.262 7)個和(16.630 0± 0.221 3)個,兩者差異不顯著(p=0.360 4) (見圖5B、 F)。綜上表明:過表達cxcr7b對體側中線神經丘腹側遷移和神經丘生成總數均沒有明顯的影響。
2.5 過表達cxcr7b對體側中線間生神經丘生成的影響
從受精后約15 d開始,原始神經丘間的丘間細胞增殖分化形成間生神經丘,間插在原始神經丘之間。在受精后15 d時對cxcr7b轉基因和野生型進行熱激,在受精后21 d時計數體側中線神經丘的總數。結果顯示:野生型組與過表達cxcr7b組的體側中線神經丘總數分別為(18.100 0±1.100 0)個和(16.300 0±1.012 0)個,差異不顯著(p=0.244 0) (見圖6A、B)。體側中線神經丘包含原始神經丘和間生神經丘。由于原始神經丘不受過表達cxcr7b的影響,本文作者推測間生神經丘也不受過表達cxcr7b的影響。
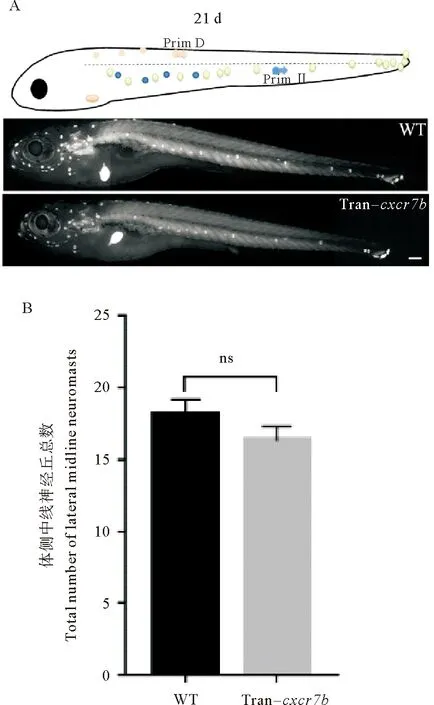
(A:野生型和cxcr7b轉基因斑馬魚在21 d post-fertilization側線神經丘所處位置。比例尺=500 μm。B:野生型和cxcr7b轉基因斑馬魚在受精后21 d體側中線神經丘總數比較。ns:無顯著性差異。WT: 野生斑馬魚。 Tran-cxcr7b: cxcr7b轉基因斑馬魚。A: The position of lateral line neuromast in wild-type and cxcr7b transgenic zebrafish at the 21 d post-fertilization. Scale bar = 500 μm. B:The comparison of the total number of lateral midline neuromasts between wild-type and cxcr7b transgenic zebrafish at the 21 d post-fertilization. ns: No significant difference. WT: Wild-type zebrafish. Tran-cxcr7b:cxcr7b transgenic zebrafish. )
2.6 過表達cxcr7b對針腳神經丘生成的影響
從受精后約1個月開始,后側線系統的神經丘套細胞開始向背、腹方向遷移,隨之增殖分化形成針腳神經丘。在受精后1個月時對cxcr7b轉基因個體和野生型個體均進行持續熱激,在受精后1.5個月時對胸鰭和腹鰭間的體側中線和腹側線針腳神經丘計數。結果顯示:在受精后1.5個月時,野生型組與過表達cxcr7b組后側線針腳神經丘分別為(4.817 0±0.224 9)和(5.029 0±0.215 7)個,兩者數量差異不顯著(p=0.504 2) (見圖7A、B)。結果表明:過表達cxcr7b對針腳神經丘的生成無明顯影響。
3 討論
本研究利用熱激啟動子控制的cxcr7b轉基因斑馬魚在側線發育的特定階段阻斷Sdf1-Cxcr4信號通路,研究了Sdf1-Cxcr4信號在斑馬魚后側線系統發育中的細胞遷移中的作用。斑馬魚的后側線發育中的Prim-Ⅰ、Prim-Ⅱ和Prim-D的遷移受到過表達cxcr7b的抑制,但中線神經丘向腹側的遷移、間生神經丘和針腳神經丘的形成均不受Sdf1-Cxcr4信號的影響。成體金槍魚和斑馬魚側線模式的差異同仔魚期中線神經丘的遷移方向有關[17]。這暗示發育階段的原基遷移和神經丘遷移均參與了魚類側線生成的最終模式。Sdf1-Cxcr4信號對后側線Prim-Ⅰ、Prim-Ⅱ和Prim-D遷移的調控,為理解魚類多樣的側線模式形成機制奠定了基礎。
注射反義嗎啡啉敲降cxcr4b或sdf1a可抑制斑馬魚側線原基的遷移[9]。但是1-細胞期的敲降無法展示發育后期的細胞遷移事件。研究表明:cxcr4b和cxcr7b分別表達在側線原基的引導區和后隨區,這也與原基尾端沉積神經丘相一致[5]。另外,cxcr7b可作為清道夫結合Cxcl12,抑制Sdf1-Cxcr4信號的活性[8]。根據文獻[10]報道,過表達cxcr7b可以抑制斑馬魚后側線Prim-Ⅰ遷移。本研究中建立的Tg(hsp70l:cxcr7b-P2A-mCherry)轉基因魚不僅實現了對Prim-Ⅰ遷移的抑制,也可以抑制同樣表達cxcr4b的Prim-Ⅱ和Prim-D的遷移,這表明過表達cxcr7b也可以在側線原基遷移中抑制Sdf1-Cxcr4信號。這提供了一個在斑馬魚發育過程中可控的抑制細胞遷移的工具。另外,在魚類的原始生殖細胞歸巢和白細胞尋找病灶過程中都有Sdf1-Cxcr4信號的參與[18-19]。因此,cxcr7b轉基因魚對于研究Sdf1-Cxcr4信號在以上過程中的作用具有重要意義。
后側線系統Prim-Ⅰ和Prim-Ⅱ受到Sdf1-Cxcr4信號的調控,體側中線神經丘向腹側、間生神經丘和針腳神經丘等遷移的過程雖然有細胞遷移發生,但它們沒有受到過表達cxcr7b的影響。可能是由于成熟神經丘中cxcr4b的表達相對更弱。本研究匯中確實發現cxcr4b僅在Prim-Ⅰ,Prim-Ⅱ和Prim-D上有較強的表達,而在成熟的神經丘中未檢測到明顯的表達。另外,也可能是由于成熟神經丘周圍組織沒有形成sdf1的濃度梯度。從受精后20 h開始過表達cxcr7b,盡管看到Prim-Ⅰ的遷移明顯慢于對照組,但仍然看到了Prim-Ⅰ的部分遷移。這暗示cxcr7b轉基因斑馬魚對Sdf1-Cxcr4信號的抑制并不徹底,丘間細胞和體側中線神經丘的遷移距離都比較短,其同野生型斑馬魚的差異并不顯著。

