玉米番茄紅素環化酶基因的克隆、表達及功能分析
王凡予,何偉偉*,李大婧,郭慶啟,*,羅 浩,陸義珠,包怡紅,張鐘元
(1.東北林業大學生命科學學院,黑龍江 哈爾濱 150040;2.江蘇省農業科學院農產品加工研究所,江蘇 南京 210014;3.江蘇大學食品與生物工程學院,江蘇 鎮江 212000)
玉米(Zea maysL.)是富含VA原的主要糧食作物[1]。除微量元素和膳食纖維外,黃色玉米籽粒還富含類胡蘿卜素,主要包括α-胡蘿卜素、β-胡蘿卜素、β-隱黃質、葉黃素和玉米黃素等。胡蘿卜素類參與光合代謝,以防止高等植物氧化應激引起的損害[2],還可作為抗氧化劑[3]和必需營養素[4],同時也是重要的VA原。其中α-胡蘿卜素在玉米光合組織捕獲光復合物時發揮功能,同時還可有效降低人類患心血管疾病和癌癥的風險[5];β-胡蘿卜素不僅是最穩定的天然色素,還可作為免疫調節因子增強機體免疫力,促進細胞凋亡[6]。除了上述常見的胡蘿卜素外,自然界中還存在其他結構的胡蘿卜素如δ-胡蘿卜素、ε-胡蘿卜素等,它們是合成α-胡蘿卜素和β-胡蘿卜素的中間物質,但其功能研究較少。由于類胡蘿卜素只能通過食物攝取[7],因此,目前諸多研究都關注于類胡蘿卜素的富集調控機制方面[8-9]。
番茄紅素β-環化酶(lycopeneβ-cyclase,LCYb)和ε-環化酶(lycopeneε-cyclase,LCYe)是調控類胡蘿卜素合成的關鍵酶[10]。α-胡蘿卜素源于番茄紅素兩端的非對稱環化,而β-胡蘿卜素是由番茄紅素分子兩端分別對稱環化β-紫羅蘭酮環而形成[11]。LCYb和LCYe催化番茄紅素的特性已在擬南芥[12]、小麥[13]、芹菜[14]、柑橘[15]、花椰菜[16]等植物中得到研究,但在每種植物中番茄紅素環化酶催化番茄紅素所生成的胡蘿卜素種類和含量卻并不相同,最常見的是含有ε-和β-環的α-胡蘿卜素及雙β-環的β-胡蘿卜素,而具有雙ε-環的胡蘿卜素卻很少存在。Cunningham等[17]發現萵苣LCYe能催化全反式番茄紅素的兩個末端形成有兩個ε-環的ε-胡蘿卜素,而擬南芥更傾向合成δ-胡蘿卜素。由此可見,植物中胡蘿卜素的種類和積累與番茄紅素環化酶的表達模式和功能特性具有一定的關系,Bai Ling等[18]研究發現在玉米不同組織中類胡蘿卜素的積累模式不同,同時將玉米LCYe基因引入大腸桿菌中發現,在沒有LCYb存在的情況下,玉米LCYe可催化番茄紅素生成δ-和ε-胡蘿卜素。而自然界植物體內往往同時存在番茄紅素LCYb和LCYe,兩者共同催化番茄紅素的機制需進一步探究。
本研究擬通過體外獲得玉米番茄紅素環化酶(ZmLCYb和ZmLCYe)全長,通過生物信息學分析,預測其化學性質;利用大腸桿菌表達系統對番茄紅素環化酶進行異源表達并純化蛋白;通過“顏色互補”及產物分析測定探究ZmLCYb和ZmLCYe的催化特性。旨在揭示LCYb和LCYe催化番茄紅素生成胡蘿卜素的功能特性,為開展玉米類胡蘿卜素分子調控機制研究奠定基礎。
1 材料與方法
1.1 材料與試劑
LB(Luria-Bertani)培養基:胰蛋白胨10 g/L, 酵母提取物5 g/L,氯化鈉10 g/L。
多糖多酚植物總RNA提取試劑盒 北京天根生化科技有限公司;PrimeScript RT Master Mix試劑盒、DL 2000 DNA Marker、限制性內切酶NotI、BamH I、NdeI、BglII 寶日醫生物技術(北京)有限公司;異丙基-β-D-硫代半乳糖苷(isopropyl-β-Dthiogalactopyranoside,IPTG)、5×蛋白上樣緩沖液、卡那霉素、Seamless Cloning master mix、SanPrep柱式質粒DNA小量抽提試劑盒、GST 4 FF 柱純化回收試劑盒生工生物工程(上海)股份有限公司。
1.2 儀器與設備
JY88-II超聲波細胞粉碎機 新芝生物科技股份(寧波)有限公司;LBI-150生化培養箱 龍躍儀器設備(上海)有限公司;5424R臺式高速離心機 德國Eppendorf公司;BS224S電子分析天平 賽多利斯科學儀器(北京)有限公司;1260 Infinity II高效液相色譜儀美國Agilent公司。
1.3 方法
1.3.1 發芽玉米總RNA提取
取新鮮黃色玉米籽粒(‘蘇玉29’)置于液氮中并在研缽中研磨成粉末,參照試劑盒說明書提取黃色玉米的總RNA,瓊脂糖凝膠電泳檢測其完整性,以RNA為模板進行反轉錄,得到cDNA。
1.3.2 重組質粒的構建
LCYb和LCYe基因克隆:根據NCBI檢索結果,獲得LCYb序列(基因登錄號NP_001169155.1)和LCYe序列(基因登錄號NP_001146840.1),并利用Primer Premier 6.0軟件設計特異引物E-P1/E-P2、B-P3/B-P4、B-P5/B-P6、E-P7/E-P8、EB-P9/EB-P10、EB-P11/EB-P12(表1)。反應條件為:94 ℃預變性1 min;94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸120 s,共循環30 次;72 ℃延伸10 min,以cDNA為模板進行擴增并回收目的基因片段。

表1 LCYe和LCYb基因的擴增引物序列Table 1 Primer sequences used for amplification of LCYe and LCYb genes
線性化載體:質粒pET-28a(+)和pGEX-4T-1分別用BamH I和NotI進行雙酶切,pCDFDuet-1質粒用NdeI和BglII(LCYb插入位點)、BamH I和NotI(LCYe插入位點)進行酶切,酶切片段經純化回收。
重組質粒的構建:參照無縫克隆試劑盒說明書,將目的基因片段與線性化載體進行連接,連接產物轉化至大腸桿菌DH5α感受態細胞中,涂布在相應抗性平板,篩選轉化子并通過質粒雙酶切鑒定及測序驗證,將測序正確的重組質粒命名為pET-B、pET-E、pCDF-BE、pGEX-B和pGEX-E(表2)。
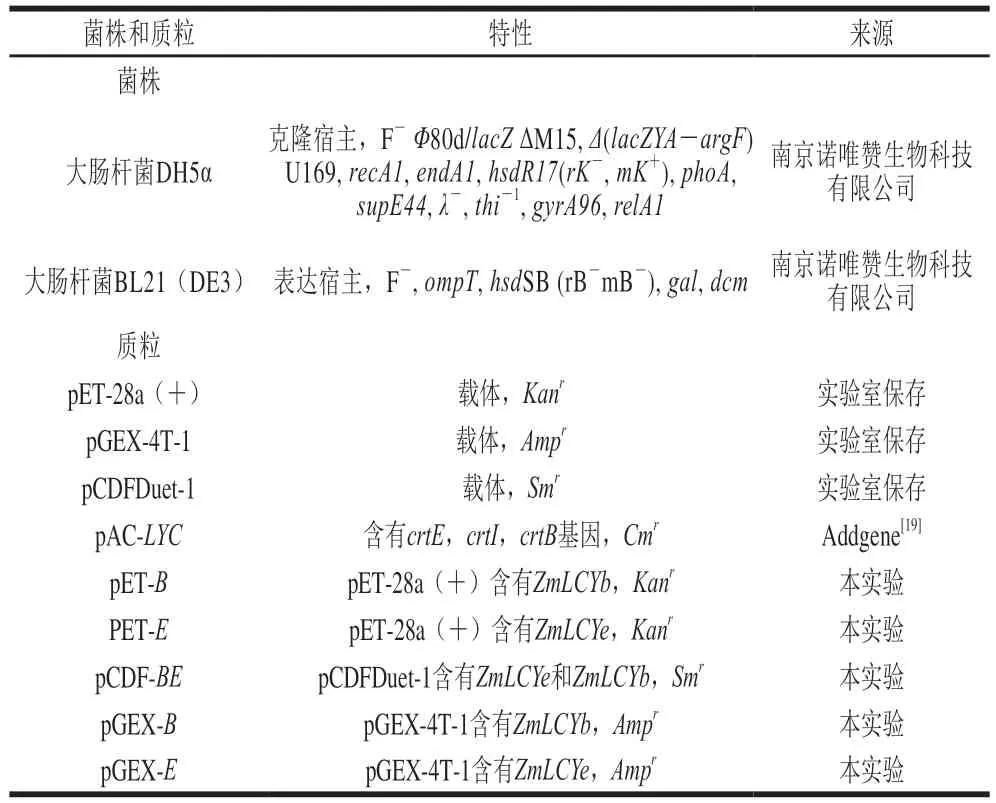
表2 菌株和質粒Table 2 Strains and plasmids used in this study
1.3.3 生物信息學分析
蛋白質的理化性質預測利用ExPASy(https://web.expasy.org)的ProtParam和ProtScale工具,蛋白質的跨膜區分析采用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/),蛋白質結構三維建模使用SWISSS MODEL(http://swissmodel.expasy.org/)工具,氨基酸序列的同源性比對利用BLAST程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi),系統發育樹構建采用MEGA 6.0的鄰接法。
粉彩花鳥瓷繪畫中粉彩清雅的釉色與瓷器瑩潤的玻璃白的結合與國畫中花鳥作品的線條和清雅的色彩有著異曲同工之妙。
1.3.4 重組蛋白的表達和純化
1.3.4.1 重組融合蛋白的誘導表達
將pGEX-B和pGEX-E重組質粒分別轉化至BL21(D E 3)感受態中,涂布在L B 固體培養基上(含Amp 50 μg/mL)。37 ℃過夜培養后挑取單菌落接種到5 mL LB液體培養基(含Amp 50 μg/mL)中,37 ℃、200 r/min過夜培養后,在100 mL LB培養基中以1∶100(V/V)的比例擴大培養,相同條件下再培養至OD600nm約為0.6~0.8時,向菌液中加入IPTG(終濃度1 mmol/L)進行誘導表達,誘導4 h后將培養液在4 ℃、8 000 r/min離心收集菌體,緩沖液重懸菌體后超聲破碎,離心取上清液,得到ZmLCYe和ZmLCYb的蛋白粗酶液。
1.3.4.2 基于谷胱甘肽巰基轉移酶(glutathioneS-transferase,GST)標簽親和層析純化
經0.22 μm濾膜過濾粗酶液后,以0.5 mL/min的流速加入預平衡好的GST4 FF柱。加入Tris-HCl(50 mmol/L,pH 8.0,含10 mmol/L還原型谷胱甘肽)以1 mL/min進行洗脫,收集洗脫液,用12%分離膠進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)鑒定。
1.3.4.3 SDS-PAGE分析
將純化后的ZmLCYe和ZmLCYb蛋白液加入5×蛋白上樣緩沖液(1∶4,V/V),100 ℃煮沸10 min,12 000 r/min離心5 min后,分別收集上清液,檢測上清液中重組蛋白。
1.3.5ZmLCYb和ZmLCYe在大腸桿菌中的顏色互補實驗
將pAC-LYC質粒與pET-B、pET-E和pCDF-BE質粒分別共轉化至大腸桿菌BL21(DE3)中,挑取固體培養基上的陽性單菌落,在30 ℃同樣條件下過夜培養,至OD600nm為0.6~0.8。然后加入終濃度1.0 mmol/L IPTG誘導表達48 h,離心收集菌體,進行顏色比對。
1.3.6 大腸桿菌中類胡蘿卜素的提取與測定
將收集的菌體加入85%丙酮溶液萃取,懸浮吹打至菌體無色,加入正己烷,吸取上清液,氮氣吹干后,用甲醇復溶,有機濾膜(0.45 μm)過濾后進高效液相色譜儀分析檢測[20]。
類胡蘿卜素檢測參考Liang Minghua等[21]的方法。通過甲醇、水和甲基叔丁基醚(tert-butyl mehyl ether,MTBE)三元梯度洗脫,檢測儀器型號為Agilent G7117A二極管陣列檢測器。色譜條件為:柱溫25 ℃,YMC Carotenoid C30色譜柱(4.6 mm×250 mm,5 μm),流動相分為A相(97%甲醇)(含0.05 mol/L乙酸銨和0.1% BHT)和B相(100% MTBE)(含0.1% BHT),流速為1 mL/min,分析物的檢測采用二極管陣列檢測器(200~700 nm)進行,進樣體積10 μL。梯度洗脫條件:0~10 min,100%~90% A、0%~10% B;1 0 ~2 0 m i n,9 0%~6 0% A、1 0%~4 0% B;2 0 ~2 5 m i n,6 0%~5 0% A、4 0%~5 0% B;2 5 ~2 9 m i n,5 0%~1 0% A、5 0%~9 0% B;29~29.5 min,10% A、90% B;29.5~40 min,10%~90% A、90%~10% B。一次洗脫,得到一個特征峰色譜圖,在對應的最大吸收波長處都有類胡蘿卜素峰。番茄紅素、β-胡蘿卜素通過標準品進行鑒定,α-胡蘿卜素、γ-胡蘿卜素、ε-胡蘿卜素、δ-胡蘿卜素等類胡蘿卜素的定性通過樣品保留時間與特征光譜值進行鑒定[22-23]。
1.4 數據分析與統計
所有實驗均重復3 次。使用Excel 2021、Origin 2021進行數據處理與分析,制作相關圖表。
2 結果與分析
2.1 ZmLCYb和ZmLCYe的克隆及重組質粒的構建
瓊脂糖凝膠電泳結果顯示,獲得兩條特異性條帶(圖1)。經測序分別得到全長LCYb1 470 bp和LCYe1 611 bp的序列,與GenBank數據庫中LCYb基因和LCYe基因序列一致,結合雙酶切均有兩條目的條帶的結果,表明已成功構建重組質粒pET-B、pET-E、pCDF-BE、pGEX-B和pGEX-E。
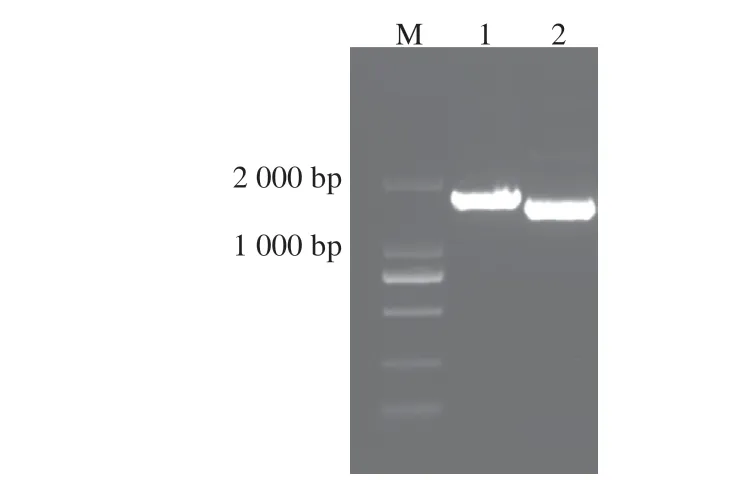
圖1 ZmLCYe和ZmLCYb基因的PCR擴增電泳結果Fig.1 Electrophoresis patterns of PCR amplified ZmLCYe and ZmLCYb genes
2.2 ZmLCYb和ZmLCYe生物信息學分析
利用ExPASy的ProtParam工具推測LCYb和LCYe理化性質結果如下:ZmLCYb和ZmLCYe氨基酸序列分別包含490 個氨基酸和537 個氨基酸殘基,蛋白分子質量約為53.3 kDa和59.7 kDa,親水最大值分別為3.314和3.378,疏水最大值分別為2.678和3.044,表明ZmLCYb和ZmLCYe蛋白都為親水性蛋白。ZmLCYb和ZmLCYe等電點分別為6.87和6.25,呈中性,預測蛋白的不穩定系數分別為45.18%和41.44%,表明ZmLCYb蛋白和ZmLCYe蛋白都為不穩定性蛋白。
首先利用NCBI BLAST對LCYb和LCYe的氨基酸序列進行同源比對,然后利用MEGA 7.0鄰接法構建ZmLCYb和ZmLCYe與其他綠色植物、綠藻及微生物來源的番茄紅素環化酶同源蛋白系統進化樹(圖2A和圖3A)。結果表明,玉米與高等植物在同一分支,發現玉米LCYb與高粱LCYb和小麥LCYb的氨基酸序列相似性分別為95.75%和83.94%,玉米LCYe與高粱LCYe和小米LCYe的氨基酸序列相似性分別為95.53%和91.48%,推測玉米番茄紅素環化酶的功能可能與高粱中的功能相似。跨膜區預測發現LCYb蛋白未跨膜,LCYe蛋白至少存在兩處跨膜區域(圖2B和圖3B)。利用SWISS-MODEL對玉米番茄紅素環化酶進行同源建模(圖2C和圖3C),對所得蛋白質三級結構建模結果進行Verify3D評價,超過80%的氨基酸序列符合評分標準,表明這個三級建模的結果可以信任。
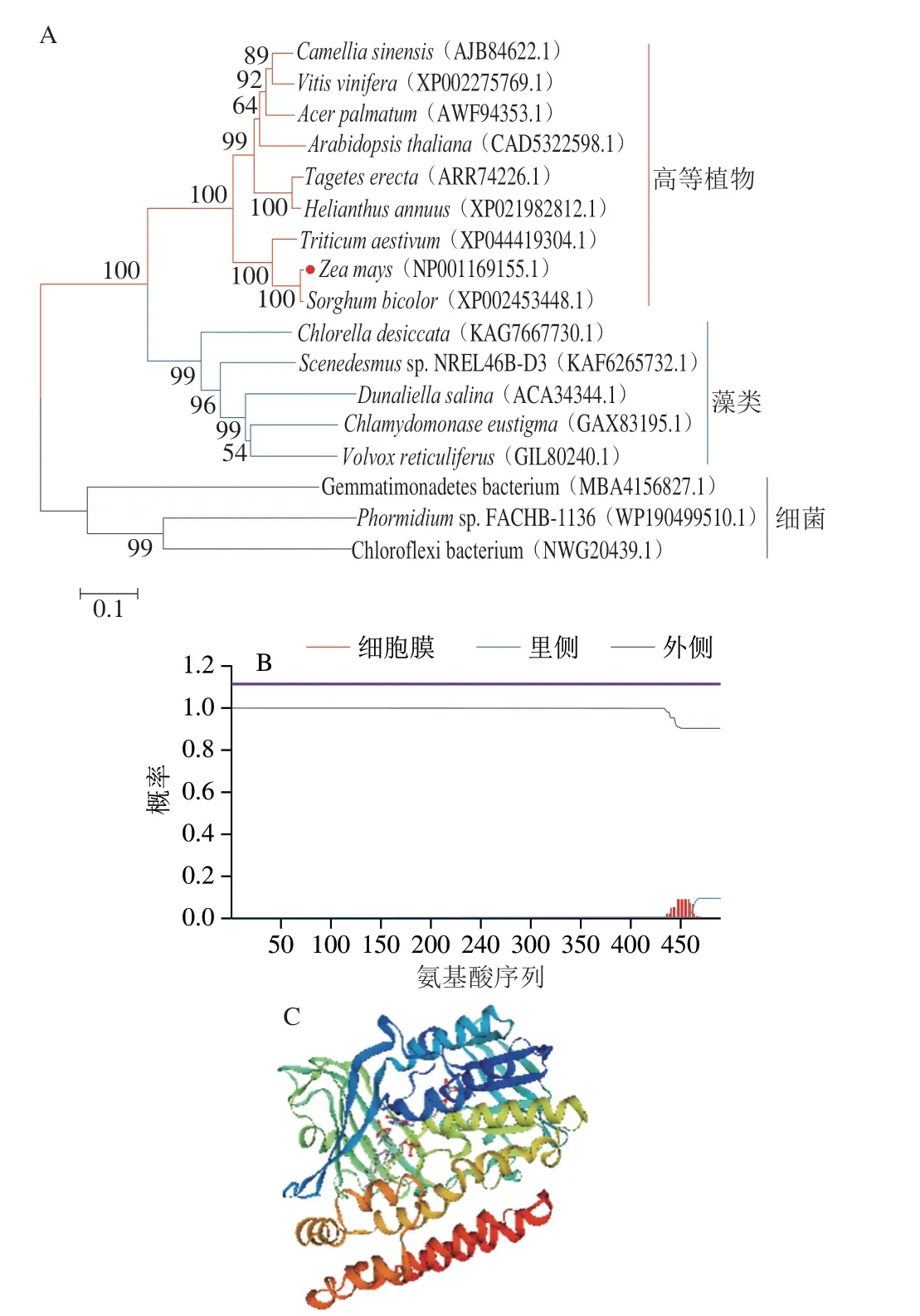
圖2 ZmLCYb進化樹(A)、跨膜區預測(B)和三級結構預測(C)Fig.2 ZmLCYb evolutionary tree (A), predicted transmembrane region (B) and predicted tertiary structure (C)
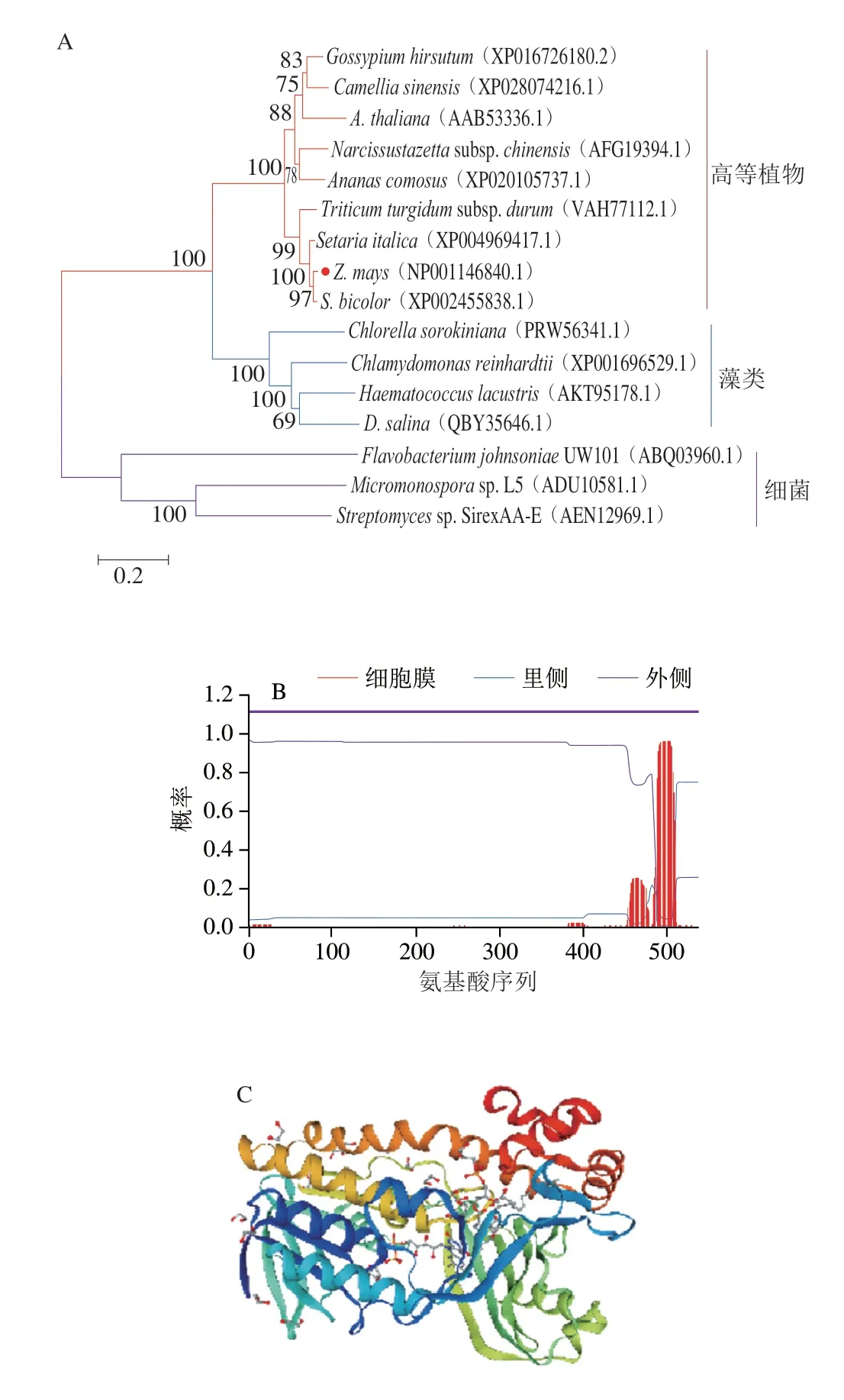
圖3 ZmLCYe進化樹(A)、跨膜區預測(B)和三級結構預測(C)Fig.3 ZmLCYe evolutionary tree (A), predicted transmembrane region (B) and predicted tertiary structure (C)
2.3 ZmLCYe和ZmLCYb的原核表達
重組大腸桿菌BL21/pGEX-B和BL21/pGEX-E,經誘導表達后在SDS-PAGE中73 kDa和79 kDa左右處可見兩條比較明顯的蛋白條帶(圖4)。由于GST標簽本身由220 個氨基酸組成,大小約26 kDa,因此電泳圖中較粗的兩條帶與預期的GST-LCYe(約79 kDa)和GSTLCYb(約73 kDa)蛋白大小一致。綜上,通過與GST標簽的融合,ZmLCYb和ZmLCYe成功在大腸桿菌中表達并純化。
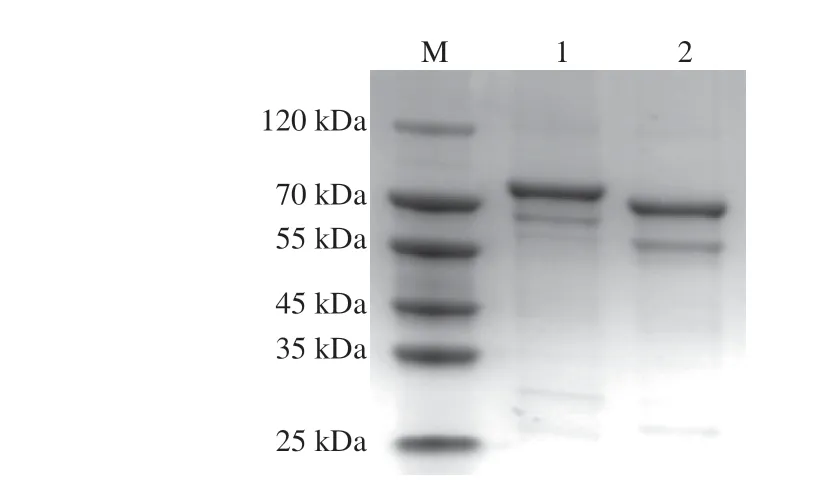
圖4 GST-LCYe和GST-LCYb蛋白純化Fig.4 SDS-PAGE patterns of purified GST-LCYe and GST-LCYb proteins
2.4 玉米番茄紅素環化酶的顏色互補鑒定及功能分析
質粒pAC-LYC攜帶crtE、crtB和crtI基因,可使含有pAC-LYC質粒的重組大腸桿菌BL21(DE3)菌體呈現紅色,在此基礎上引入ZmLCYb和ZmLCYe外源基因后,由于番茄紅素會轉化生成不同種類的胡蘿卜素,從而導致菌體顏色發生變化,呈現黃色或橙黃色[24]。因此,pET-B、pET-E和pCDF-BE分別轉化至重組大腸桿菌BL21(DE3)/pAC-LYC中,通過觀察菌體的顏色變化驗證ZmLCYb和ZmLCYe的功能(圖5A)。作為空白對照組BL21(DE3)/pAC-LYC的菌體呈現出番茄紅素特有的紅色。與空白對照相比,pET-B與pAC-LYC共轉化的菌體呈現黃色,而pET-E與pAC-LYC共轉化的菌體呈現橘黃色,此外,pCDF-BE與pAC-LYC共轉化的菌體顏色也發生變化。說明LCYb和LCYe基因成功在大腸桿菌中表達并存在一定活性,將番茄紅素催化生成不同種類的胡蘿卜素。

圖5 ZmLCYb和ZmLCYe的功能鑒定Fig.5 Functional identification of ZmLCYb and ZmLCYe
高效液相色譜結果表明,當ZmLCYb與pAC-LYC共表達時,產物主要是β-胡蘿卜素,但發現了少量的α-胡蘿卜素存在(圖5B)。說明ZmLCYb除了具有LCYb活性外,還具有少量LCYe活性。當ZmLCYe與pAC-LYC在大腸桿菌共表達時,產物中主要是單環的δ-胡蘿卜素,高效液相色譜并未檢測到ε-胡蘿卜素。當pCDF-BE與pAC-LYC共轉化大腸桿菌中時,主要產物是α-胡蘿卜素、β-胡蘿卜素和δ-胡蘿卜素,還有少量的γ-胡蘿卜素和ε-胡蘿卜素。說明番茄紅素第一步環化得到的單環δ-胡蘿卜素和γ-胡蘿卜素并不易在體內存在,而是生成更多的α-胡蘿卜素和β-胡蘿卜素。此外還檢測到極少量的ε-胡蘿卜素,表明兩端都形成ε-環的ε-胡蘿卜素不易發生。在玉米番茄紅素LCYb和LCYe同時存在的情況下,α-胡蘿卜素/β-胡蘿卜素比例更高。
3 討 論
黃色玉米籽粒是類胡蘿卜素的良好來源,并且其中部分胡蘿卜素可在人體中轉變為具有生理活性的VA。Liang Minghua等[25]已經對藻類細菌和植物體內類胡蘿卜素的合成與代謝途徑進行總結。PSY1是類胡蘿卜素生物合成的關鍵限速酶,在玉米胚乳中過表達可使胚乳總類胡蘿卜素含量增加50 倍[26]。Li Qunrui等[27]在玉米中分離出2 個類胡蘿卜素異構酶(carotenoid isomerase,CRTISO)基因和2 個β-胡蘿卜素羥化酶(β-carotene hydroxylase,BCH)基因,并發現玉米BCH1基因可以使β-胡蘿卜素生成β-隱黃質和玉米黃質,而BCH2基因只轉化成β-隱黃質;在玉米CRTISO 1存在的情況下,可形成全反式番茄紅素異構體。α-胡蘿卜素和β-胡蘿卜素都是重要的VA的前體物質,研究表明玉米LCYb和LCYe基因表達的相對強弱決定了α-胡蘿卜素/β-胡蘿卜素的含量比例[28],因此研究番茄紅素環化酶功能對深入解析番茄紅素環化機制具有重要作用。
本實驗以黃色玉米為模板克隆了玉米番茄紅素環化酶ZmLCYe和ZmLCYb基因,通過多序列比對構建進化樹分析了藻類番茄紅素環化酶(crtL)、番茄紅素環化酶(crtY)以及植物番茄紅素酶(LCY)的同源性。結果表明,不同物種間雖然氨基酸序列的保守模式各不相同,但crtY、crtL和LCY基因通常被認為具有共同的系統起源(細菌crtY),且藻類crtL和植物LCY在結構上具有一定的相似性。序列比對發現玉米與高粱在高等植物中有較為接近的親緣關系。這些單子葉植物之間的氨基酸是高度保守的,都具有共同特征“FLYAMP”序列和FAD/NAD(P)結合區[29],它們所擁有的LCYe基因和LCYb基因可能是由共同的基因進化而來,且在進化過程中沒有改變,推測該保守區域為番茄紅素環化酶的功能區,只能使番茄紅素的一端環化[30]。
類胡蘿卜素生物合成酶大多位于細胞質膜上,存在體外表達不穩定且蛋白表達量少的問題[11]。番茄紅素環化酶在大腸桿菌中異源表達時,通常會形成跨膜螺旋結構域的疏水區,使LCYe和LCYb蛋白形成以包涵體形式存在的不溶性聚集體[31]。預實驗中使用組氨酸標簽構建融合表達蛋白發現純化后蛋白電泳條帶較淺,推測純化得到的蛋白較少。因此,本研究將目的蛋白與高可溶性GST標簽融合,結果發現在電泳膠上約79 kDa和73 kDa處有明顯清晰條帶,證明GST-LCYe和GST-LCYb蛋白表達并純化成功,但是含有少量雜帶,可能是由于雜蛋白與還原型谷胱甘肽相發生特異性結合。
番茄紅素的環化在植物中分成兩個分支,其中一個分支番茄紅素被催化生成α-胡蘿卜素,另一分支則生成β-胡蘿卜素。盡管LCYb和LCYe已在多種植物中得到表征,但關于玉米LCYb與LCYe在類胡蘿卜素生物合成中的功能信息較少,且目前研究主要集中在單獨番茄紅素環化酶功能。本研究發現玉米ZmLCYb具有β-環活性,可以分別催化番茄紅素、γ-胡蘿卜素和δ-胡蘿卜素生成γ-胡蘿卜素、β-胡蘿卜素和α-胡蘿卜素。但是重組大腸桿菌BL21(DE3)/pAC-LYC+pET-B產物中還檢測到少量的α-胡蘿卜素,因此,ZmLCYb同時也具有微弱番茄紅素LCYe活性,推測其可以催化γ-胡蘿卜素或番茄紅素的一端形成了ε-環。研究發現,桂花的OfLCYb具有β-環單環酶的功能,可以將番茄紅素全部轉化為β-胡蘿卜素,產物中未檢測到單環γ-胡蘿卜素存在[32]。此外,盡管藻類與植物在基因序列存在相似,但是在單細胞紅藻中發現BfLCYb能夠將番茄紅素的一端或兩端環化為β-環,但不具有ε-環活性[20]。
在植物中LCYe通常不接受單環胡蘿卜素作為底物,而是在番茄紅素的一端催化形成單個ε-環[33]。本研究發現ZmLCYe能夠在大腸桿菌系統中具有雙ε-環活性,催化δ-胡蘿卜素形成雙環的ε-胡蘿卜素,與前期研究發現的玉米LCYe能催化番茄紅素的兩個末端形成ε-紫羅蘭酮環而生成ε-胡蘿卜素的結果一致[28]。此外,Bai Ling等[18]在LCYb基因突變失活的玉米中發現δ-胡蘿卜素和ε-胡蘿卜素為主要的胡蘿卜素,推測玉米LCYe具有單環和雙環ε-環活性。同樣地,地錢LCYe能夠催化番茄紅素生成單環的δ-胡蘿卜素,隨后繼續催化形成兩ε-環的ε-胡蘿卜素[34]。本研究通過體外克隆玉米番茄紅素環化酶基因ZmLCYe和ZmLCYb,并借助于大腸桿菌表達系統探究了玉米番茄紅素環化酶的催化特性,進一步解析了玉米中番茄紅素環化酶催化番茄紅素生成胡蘿卜素的機制。
4 結 論
本實驗克隆了玉米LCYe和LCYb基因,發現其與高粱編碼LCYb和LCYe基因相似性分別達95.75%和95.53%。通過體外構建原核表達質粒,成功在大腸桿菌表達并純化了玉米LCYe和LCYb蛋白。玉米LCYb和LCYe在大腸桿菌中表現出一定的活性,可以催化番茄紅素生成不同顏色的胡蘿卜素。ZmLCYb具有β-環催化活性,可以以番茄紅素、γ-胡蘿卜素和δ-胡蘿卜素作為底物,分別催化生成γ-胡蘿卜素、β-胡蘿卜素和α-胡蘿卜素。同時ZmLCYb也具有微弱ε-環的活性,能夠催化番茄紅素和γ-胡蘿卜素,分別生成δ-胡蘿卜素和α-胡蘿卜素。ZmLCYe具有ε-環活性,能夠催化番茄紅素的兩端形成雙ε-環產生ε-胡蘿卜素。本研究不僅為深入解析玉米類胡蘿卜素合成調控機制奠定基礎,同時為玉米番茄紅素環化酶的應用提供了理論參考。

