金絲桃苷對小鼠酒精性脂肪肝炎的保護作用
侯惠靜,吳子健
(1.天津市職業大學 生物與環境工程學院,天津 300410;2.天津商業大學 生物技術與食品科學學院,天津 300134)
酒精性肝病(alcoholic liver disease,ALD)是慢性肝損傷的主要病因之一,該病的發展經歷了多個進行性階段,包括酒精性脂肪肝、酒精性脂肪性肝炎、酒精性肝炎、肝纖維化、肝硬化。近期關于全球疾病負擔的研究指出,酒精相關肝病是前30 個死亡原因之一,ALD 已成為廣受關注的公共衛生問題[1]。目前,ALD 缺乏有效治療手段,藥物治療和手術治療均存在較大的副作用[2]。
金絲桃苷(hyperin,Hyp),又名槲皮素-3-O-β-D-吡喃半乳糖苷,是一種天然黃酮醇苷類化合物,廣泛存在于金絲桃科、葵科、桔梗科、杜鵑花科、唇形科、小檗科、薔薇科等植物的果實及全草中[3],具有抗腫瘤[4]、免疫調節[5]、保護神經系統[6]、減輕肝臟損傷[7-8]等藥理作用。近期研究表明,金絲桃苷抑制人乳腺癌細胞系(nuclear factor-kappa B,NF-κB)信號通路活化,增強Bax-caspase-3 通路活化,從而誘導腫瘤細胞凋亡,發揮抗腫瘤活性[4]。金絲桃苷能夠降低單胺氧化酶水平,增強重組與合成蛋白(nuclear factor erythroid 2-related factor 2,Nrf2)表達,減輕四氯化碳(CCl4)誘導的肝臟纖維化及氧化損傷[9]。此外,金絲桃苷通過增強葡糖醛酸轉移酶和磺基轉移酶活性,降低肝毒性,減輕對乙酰氨基酚誘導的急性肝衰竭[7]。盡管這些研究揭示了金絲桃苷功能的多樣性,但目前金絲桃苷在酒精性脂肪肝病中作用的研究尚少見。
短期酒精性肝炎模型(Gao-Binge 模型)是目前普遍使用的ALD 動物模型,建模后小鼠肝組織出現脂質沉積和炎性細胞浸潤,肝細胞表現出腫脹、胞漿內脂肪性小泡等病理現象,該模型能較好地模擬人類酒精性脂肪肝病[10]。實驗擬采用Gao-Binge 模型誘導小鼠酒精性脂肪肝炎,通過檢測血清轉氨酶水平、肝臟脂肪積累、氧化損傷以及炎癥水平,探究不同劑量的金絲桃苷對小鼠酒精性脂肪肝炎的改善作用,以期為金絲桃苷在功能性食品與藥品中的應用提供理論依據,為酒精相關肝病防治保健品的開發提供新策略。
1 材料與方法
1.1 材料與試劑
C57BL/6J 小鼠[體質量18~24 g,雄性,動物許可證號SCXK(京)2016-0006]:北京維通利華實驗動物技術有限公司;金絲桃苷(純度95%):美國Sigma 公司;谷丙轉氨酶(alanine transaminase,ALT)、谷草轉氨酶(aspartate transaminase,AST)、乳酸脫氫酶(lactate dehydrogenase,LDH)、甘油三酯(triglyceride,TG)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)檢測試劑盒:南京建成生物工程研究所;RNA 提取試劑(生物試劑)、反轉錄試劑盒:美國Thermo Fisher Scientific 公司;動物飼料(Lieber-DeCarli液體飼料):美國Dyets 公司;麥芽糖糊精、乙醇(均為分析純):國藥集團化學試劑有限公司。
1.2 儀器與設備
Legend Micro17 離心機:美國Thermo Fisher Scientific 公司;SCIENTZ-48 組織破碎儀:寧波新芝生物科技有限公司;Digital Sight DS-U3 光學顯微鏡:日本尼康公司;
MyCycler 基因擴增(polymerase chain reaction,PCR)儀:美國Bio-Rad 公司;LightCycler 480 實時定量PCR儀:瑞士羅氏公司。
1.3 方法
1.3.1 動物飼養及模型建立
實驗小鼠給予恒溫恒濕的無特定病原體動物(specific pathogen free,SPF) 級飼養環境,12 h 光/暗循環。動物實驗經過中國醫學科學院放射醫學研究所實驗動物倫理委員會的批準(IRM-DWLL-2022016)。將50 只實驗小鼠隨機分為5 組,分別為空白組、模型組、金絲桃苷低、中、高劑量(12.5、25.0、50.0 mg/kg)組,每組10 只小鼠。小鼠使用麥芽糖糊精液體飼料喂養5 d,使小鼠適應液體飲食,第6 天模型組及金絲桃苷處理組的小鼠飼料更換為5%酒精液體飼料,空白組給予同等熱量的麥芽糖糊精液體飼料,繼續喂養10 d 后,在早上7:00~9:00 以5 g/kg 劑量進行酒精(30%,體積分數) 或麥芽糖糊精灌胃,9 h 后收集血清和肝組織樣本。5%酒精液體飼料喂養期間,金絲桃苷處理組的小鼠每日8:00~9:00 灌胃,并給予相應的金絲桃苷,空白組和模型組給予同等體積生理鹽水。
1.3.2 血清指標的測定
自小鼠眼眶后靜脈叢取血,靜置30 min,4 ℃、1 500 r/min 離心15 min 收集血清,參照檢測試劑盒說明書進行血清ALT、AST、LDH 活力和TG 含量測定。
1.3.3 肝臟指標的測定
取0.2 g 肝組織置于冰上,按照SOD、MDA、TG 檢測試劑盒說明書測定肝組織TG 和MDA 含量,以及SOD 活性。
1.3.4 肝臟病理學及免疫組化觀察
取新鮮肝臟切成小塊,用10%福爾馬林固定肝組織,經石蠟包埋、切片后,進行常規蘇木精-伊紅染色(hematoxylin and eosin staining,H&E)和淋巴細胞抗原6 復合體(lymphocyte antigen 6G,Ly6G)免疫組織化學染色,并在光學顯微鏡下觀察。
1.3.5 肝臟油紅染色
取新鮮肝臟組織塊放入液氮冷凍,用冰凍切片包埋劑(optimal cutting temperature comp,OCT)包埋,組織冰凍切片后,進行油紅染色,并在光學顯微鏡下觀察。
1.3.6 目的基因mRNA 相對表達量
按照RNA 提取試劑使用說明書提取肝組織總RNA,使用反轉錄試劑盒將總RNA 逆轉錄為cDNA,利用實時定量PCR 儀檢測系統擴增肝組織cDNA。將Gapdh 作為內參基因,評估目的基因的相對表達水平。
1.4 統計分析
使用GraphPad Prism 7 進行統計學分析,結果表示為平均值±標準差。兩組之間差異顯著性使用標準雙尾非配對t 檢驗,認為P<0.05 具有統計學意義。
2 結果與分析
2.1 金絲桃苷對小鼠肝臟指數的影響
金絲桃苷對小鼠肝臟指數的影響見圖1。
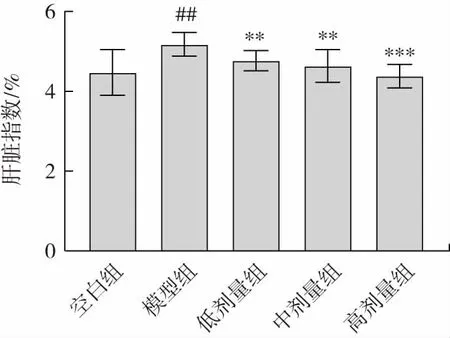
圖1 金絲桃苷對小鼠肝臟指數的影響Fig.1 Effect of hyperin on liver index in mice
由圖1 可知,模型組小鼠肝臟指數極顯著高于空白組(P<0.01),說明酒精液體飼料會導致小鼠肝臟出現脂質沉積、腫脹現象,建模成功;與模型組相比,金絲桃苷低、中、高劑量組均能顯著降低小鼠肝臟指數(低、中劑量組P<0.01,高劑量組P<0.001),說明金絲桃苷能夠有效改善酒精飲食導致的小鼠肝臟腫大。
2.2 金絲桃苷對酒精飲食誘導的肝臟損傷小鼠血清生化指標的影響
ALT、AST 和LDH 是評價肝臟受損情況的重要生化指標,正常生理狀態下,血清中ALT、AST 和LDH 活力較低,當肝臟受損時,血清中ALT、AST 和LDH 活力升高[11]。金絲桃苷對小鼠血清生化指標的影響見圖2。

圖2 金絲桃苷對小鼠血清生化指標的影響Fig.2 Effect of hyperin on serum biochemical indexes in mice
如圖2 所示,與空白組相比,模型組小鼠血清中ALT、AST 和LDH 活力高度顯著升高(P<0.001),說明酒精飲食導致小鼠肝臟受損。而金絲桃苷中、高劑量組能夠顯著降低小鼠血清ALT 和LDH 活力(高劑量組P<0.001),說明一定劑量的金絲桃苷對酒精飲食誘導的肝臟損傷具有改善作用。
對小鼠肝組織進行H&E 染色,結果如圖3 所示。
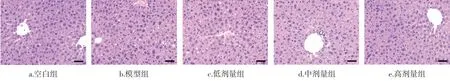
圖3 小鼠肝組織的病理切(標尺:50 μm)Fig.3 Histological examination of liver tissue sections of mice(scale bar: 50 μm)
由圖3 可知,模型組小鼠肝組織出現脂質沉積,肝細胞表現出腫脹、胞漿內脂肪性小泡等病理現象,匯管區出現水樣性病變。與模型組相比,金絲桃苷處理組能夠減輕肝組織脂肪沉積,減少胞漿內脂肪性小泡,保持肝細胞結構完整。由此可見,在酒精飲食誘導的脂肪肝病模型中,金絲桃苷具有一定的保肝護肝效用。
2.3 金絲桃苷對酒精飲食誘導小鼠的肝臟脂肪變性的影響
為進一步探究金絲桃苷對酒精飲食誘導小鼠的肝臟脂肪變性的影響,實驗檢測血清及肝組織甘油三酯含量,結果如圖4 所示。

圖4 金絲桃苷對小鼠血清及肝組織甘油三酯含量的影響Fig.4 Effect of hyperin on content of TG in serum and liver tissue in mice
由圖4 可知,與空白組相比,模型組小鼠血清及肝組織甘油三酯含量高度顯著升高(P<0.001),這主要是由于酒精飲食喂養導致小鼠肝細胞脂肪代謝紊亂,脂質在肝細胞中堆積產生[12]。金絲桃苷處理組能夠顯著降低小鼠肝組織的甘油三酯含量(低劑量組P<0.05,中、高劑量組P<0.001),血清甘油三酯含量也明顯降低(中劑量組P<0.05,高劑量組P<0.001)。
進一步對小鼠肝組織進行油紅染色,結果見圖5。
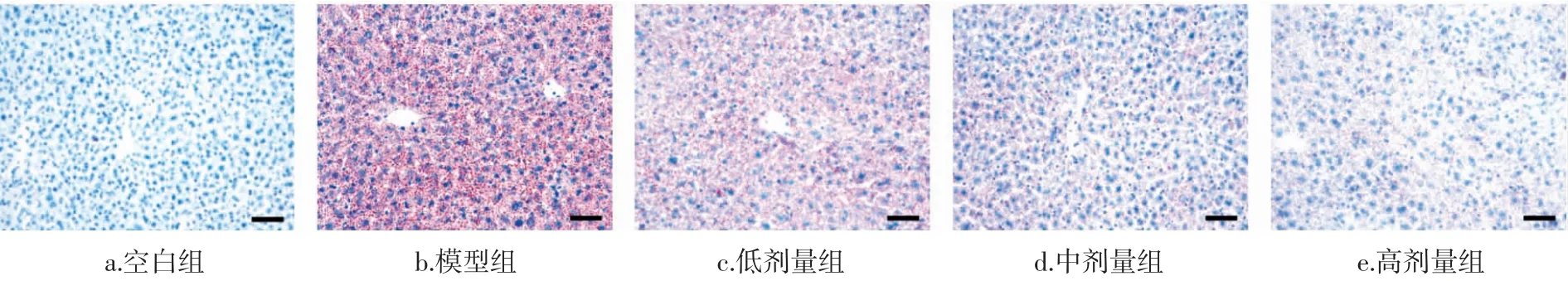
圖5 小鼠肝組織的油紅染色(標尺:50 μm)Fig.5 Oil red staining of liver tissue sections(scale bar: 50 μm)
由圖5 可知,小鼠經過酒精液體飼料喂養后,肝組織油紅染色著色區域明顯大于對照飲食組,而金絲桃苷低、中、高劑量組小鼠肝組織的油紅染色著色區域明顯減少。以上結果說明,金絲桃苷能夠減輕酒精飲食導致的肝臟脂肪變性。
2.4 金絲桃苷對酒精飲食誘導小鼠的肝臟脂質過氧化的影響
肝臟是酒精代謝的主要場所,乙醇中間代謝產物的肝毒性是ALD 發病的重要推動因素[13]。金絲桃苷對肝臟SOD 活性和MDA 含量的影響見圖6。

圖6 金絲桃苷對肝臟SOD 活性和MDA 含量的影響Fig.6 Effect of hyperin on hepatic SOD activity and MDA livel in mice
由圖6 所示,模型組小鼠肝臟SOD 活性極顯著低于空白組(P<0.01),MDA 含量高度顯著高于空白組(P<0.001),這是由于酒精代謝過程中會產生大量活性氧,抑制肝細胞的抗氧化能力,降低SOD 水平,脂質過氧化損傷造成MDA 含量升高[14]。與模型組相比,金絲桃苷干預組能夠明顯提升SOD 活性(高劑量組P<0.001),高度顯著降低酒精中間代謝產物MDA 的含量(低、中、高劑量組P<0.001),這說明金絲桃苷能夠有效減輕酒精飲食誘發的肝臟脂質過氧化損傷。
2.5 金絲桃苷對酒精飲食誘導小鼠的肝臟炎癥反應的影響
ALD 的發病機制十分復雜,多種因素可能參與ALD 的發生發展,除了酒精代謝產物的肝毒性以外,免疫細胞介導的炎性損傷也是主要促進因素之一[15]。為了明確金絲桃苷對酒精飲食誘導小鼠的肝臟炎癥反應的影響,實驗檢測了肝組織炎性細胞因子mRNA相對表達量的變化,結果如圖7 所示。

圖7 金絲桃苷對TNF-α 和IL-6 mRNA 相對表達量的影響Fig.7 Effect of hyperin on relative mRNA expression of TNF-α and IL-6 in mice
由圖7 可知,小鼠經過酒精液體飼料喂養后,模型組小鼠與空白組相比,肝組織IL-6 和TNF-α 的mRNA水平高度顯著升高(P<0.001),金絲桃苷處理組能夠顯著抑制酒精誘導的肝臟IL-6 表達(中劑量組P<0.01,高劑量組P<0.001),顯著降低TNF-α 的mRNA 水平(低劑量組P<0.05,中、高劑量組P<0.001)。
在酒精性脂肪肝病中,肝臟中性粒細胞浸潤和中性粒細胞趨化因子表達上調是酒精性肝炎的重要特征之一[16]。因此,對小鼠肝組織進行Ly6G(中性粒細胞特異性標志物)免疫組化染色,結果見圖8。

圖8 小鼠肝組織的Ly6G 免疫組化染色(標尺:50 μm)Fig.8 Ly6G immunohistochemistry staining of liver tissue sections of mice(scale bar: 50 μm)
由圖8 可知,模型組小鼠肝臟切片Ly6G 陽性染色細胞明顯增加,說明酒精飲食小鼠的肝組織中出現中性粒細胞浸潤增多的現象。小鼠經過金絲桃苷干預后,肝臟切片中Ly6G 陽性染色細胞減少,意味著中性粒細胞浸潤明顯減少。進一步,通過實時定量PCR 技術檢測中性粒細胞趨化因子mRNA 相對表達量的變化,結果如圖9 所示。

圖9 金絲桃苷對CXCL1 和CXCL2 mRNA 相對表達量的影響Fig.9 Effect of hyperin on relative mRNA expression of CXCL1 and CXCL2 in mice
由圖9 可知,與空白組相比,模型組小鼠肝組織中CXCL1、CXCL2 的mRNA 相對表達量高度顯著升高,而金絲桃苷能夠降低酒精飲食小鼠肝臟中性粒細胞趨化因子的表達水平(中劑量組P<0.01,高劑量組P<0.001)。以上結果說明金絲桃苷能夠有效減輕小鼠酒精飲食誘發的肝臟炎癥反應和中性粒細胞浸潤。
在ALD 病程中,肝臟氧化損傷觸發的獲得性免疫反應和酒精誘導的固有免疫細胞活化會引起肝臟炎癥反應發生,巨噬細胞、中性粒細胞等多種免疫細胞參與其中。乙醇的中間代謝產物如乙醛和丙二醛被抗原呈遞細胞識別,激活T 細胞介導的細胞免疫反應,產生TNF-α 促炎細胞因子[17]。酒精損傷腸道屏障,使小腸通透性增強,LPS 通過門靜脈系統入肝激活巨噬細胞,產生TNF-α、IL-6 等促炎因子,進而募集中性粒細胞等炎性細胞入肝臟[18-19]。中性粒細胞通過釋放組織溶解酶、產生活性氧(robot operating system,ROS)損傷肝細胞,利用Ly6G 中和抗體清除中性粒細胞可以顯著降低血清轉氨酶水平[20],阻斷CXCL1 明顯抑制小鼠肝臟中性細胞浸潤,減輕脂肪肝炎[21]。由此可見,抑制肝組織促炎細胞因子及中性粒細胞趨化因子表達,減少肝臟中性粒細胞浸潤能夠有效減輕酒精飲食導致的脂肪肝炎。一些研究表明,金絲桃苷能夠抑制AKT/GSK3β 信號通路活化,降低TNF-α 和IL-6 等炎性因子分泌,減輕博來霉素誘導的小鼠肺纖維化[22]。此外,金絲桃苷誘導巨噬細胞Nr4A1 表達上調,促進巨噬細胞從促炎M1 表型向抑炎M2 表型極化,從而降低高脂飲食誘發的肝臟脂積累及炎癥反應[23]。這與本文研究結果一致,即金絲桃苷能夠減輕肝臟炎性因子和趨化因子表達,減少中性粒細胞浸潤,改善酒精飲食誘導的脂肪肝炎。
3 結論
本文研究了金絲桃苷對酒精飲食誘發的小鼠脂肪性肝炎的改善作用。結果表明,一定劑量的金絲桃苷能夠減輕Gao-Binge 模型誘導的小鼠酒精性肝損傷,降低血清轉氨酶水平,減輕肝臟脂積累和脂質過氧化損傷,抑制炎性細胞因子及趨化因子表達,減少肝臟中性粒細胞浸潤,改善小鼠酒精性脂肪肝炎,但其具體的作用機制有待進一步探究。本研究豐富了金絲桃苷功能的多樣性,為金絲桃苷在保肝護肝保健品的開發提供理論和實驗依據。

