丹酚酸B 對去卵巢骨質疏松小鼠的生物學變化及機制
岑美婷
廣州市第一人民醫院(廣東廣州 510180)
骨質疏松癥是骨病中最常見的一種,表現為骨礦質密度低,骨微結構退化,從而引起骨脆性骨折[1]。目前,骨質疏松癥的治療藥物主要為包括雙磷酸鹽、降鈣素和選擇性雌激素受體調節劑在內的骨吸收抑制劑[2]。雖然這些藥物對骨量起到有效的穩定作用,卻不會使骨形成增加。
間充質干細胞(mesenchymal stem cells,MSCs)是一種很容易從骨髓等組織中分離出來的是非造血細胞[3]。MSCs具有多種能力分化成其他細胞類型,包括骨細胞、脂肪細胞、軟骨細胞、肌細胞和神經元[4]。近年來,在促進骨折、節段性骨缺損等愈合方面,一直在使用MSCs,而且成績喜人。研究者已經發現將 MSCs 引導至骨骼可以促進骨形成并增加骨量[5]。在骨質疏松癥患者中,研究顯示MSCs成骨分化潛力降低,因此,尋找有效的方法來促進MSCs成骨分化顯得刻不容緩。
中藥丹參的主要生物活性成分丹酚酸B(salvianolic acid B,SalB)被廣泛應用于心血管疾病的治療[6]。研究顯示,SalB具有保護神經的功能,同時也能緩解肝臟纖維化[7-8]。最近的研究表明SalB可以預防骨質疏松癥的發展[9]。丹參聯合MSCs治療股骨頭缺血性壞死可能通過增加股骨頭中血管內皮生長因子和骨形態發生蛋白-2的表達促進血運重建,促進骨化和血運重建[10]。丹參能在缺血條件下增強MSCs的存活,可通過促進MSCs的存活來增強對腦缺血性中風的治療效果[11]。在本研究中,探討了丹酚酸B對去卵巢骨質疏松小鼠的影響以及對小鼠MSCs成骨分化的影響。
1 材料與方法
1.1 材料
1.1.1 實驗動物 從廣東省醫學實驗動物中心購進8周齡18只體質量20~25 g的無特定病原體(specefic pathogen free,SPF)級雌性C57小鼠,許可證號SYXK(粵)2022~0002。飼養條件:溫度24 ℃,相對濕度45%。每天照明12 h的光照,標準飼料,自由飲水、攝食。每周更換消毒過的墊料、籠具1次。
1.1.2 藥物 SalB是由四川省維克奇生物科技有限公司采購的。使用生理鹽水將其完全溶解后,腹腔注射進小鼠體內。
1.2 實驗方法
1.2.1 動物分組及干預方法 將18只小鼠分為3組:假手術組、骨質疏松組、SalB治療組,各6只。雙側卵巢摘除術后連續3天進行抗感染治療。術后4周,每2天注射1次,持續12周的SalB 2.5 mg/kg腹腔內注射SalB治療組,另2組按同樣計量的生理鹽水腹腔注射,療程相同。
1.2.2 建立骨質疏松模型 手術前8小時對小鼠實施例行禁食,手術前4小時對小鼠實施禁食。把剪刀、鑷子、縫合線、持針器、消毒紗布、酒精棉球、碘伏等一系列的手術器械都消毒好,然后晾干,待用。對小鼠進行常規麻醉后,先用酒精棉球浸濕后背部的毛發,再用刮毛刀清除手術視野周圍的毛發,讓手術視野完全暴露出來,再以雙側卵巢摘除術復制絕經后骨質疏松癥模型。假手術組把卵巢周圍的一些脂肪組織經過同樣的切口切除。在無菌的情況下進行手術,并嚴格遵循了實驗動物的倫理學原則。
1.2.3 骨密度檢測 給藥結束后,將所有小鼠在麻醉狀態下處死,并取出它們的右側股骨,測定它們的骨密度。利用Skyscan1172微型CT掃描系統對小鼠的右側股骨進行了骨密度的檢查。
1.2.4 qRT-PCR 沖出骨髓MSCs后加入TRIzol裂解液,并按說明書操作提取總RNA。反轉錄得到cDNA后,PCR反應依照SYBR Primix EX Taq TMII試劑盒中所提供的操作說明來進行。采用2-△Ct方法,以Gapdh為內參,計算mRNA的相對表達量。
1.2.5 WB實驗 骨組織經液氮研磨勻漿后提取蛋白質進行WB實驗。使用BCA試劑盒測定蛋白濃度。接下來進行SDS-PAGE電泳、轉膜、封閉與雜交等一系列操作。最后進行化學發光與顯影,將膠片進行掃描或拍照,利用凝膠圖像處理系統對目標帶的分子量和凈光密度值進行分析。
1.3 主要觀察指標
1)小鼠右后股骨的骨密度;
2)小鼠骨髓MSCs的Runx2 和 Osterix水平;
3)骨組織核因子-κB 配體受體激活劑(receptor activator of nuclear factor-κB ligand,RANKL)和骨保護素(osteoprotegerin,OPG)蛋白水平。
1.4 統計學分析
所有結果均采用SPSS 26.0統計軟件處理分析,并對3組間的樣本均數進行單因素方差分析(One-way ANOVA),以(±s)表示,P<0.05差異有統計學意義。
2 結果
2.1 小鼠右后股骨的骨密度
Skyscan1172微型CT掃描系統掃描小鼠右側股骨測定骨密度, 骨質疏松組骨密度為(0.481±0.017)mg/cm3,低于假手術組骨密度(0.571±0.012)mg/cm3(P=0.001 5)。而SalB治療組骨密度為(0.534±0.008)mg/cm3,高于骨質疏松組(P=0.007 3),見圖1。
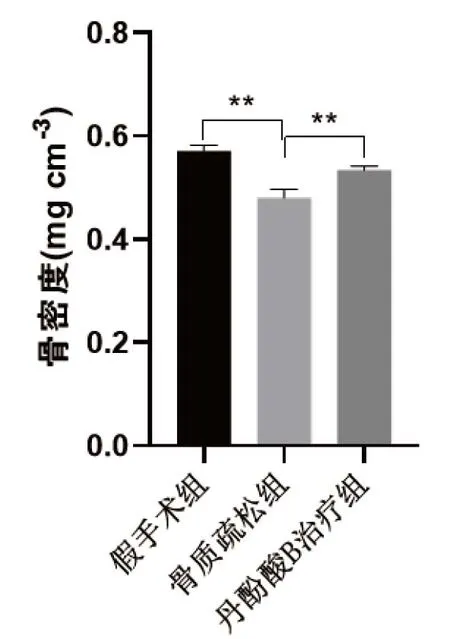
圖1 各組小鼠股骨骨密度比較
2.2 小鼠骨髓MSCs的Runx2和Osterix水平
經RT-qPCR檢測發現,各組Runx2 和 Osterix水平均表現為:假手術組>SalB治療組>骨質疏松組。見圖2。(在Runx2 mRNA中,假手術組vs骨質疏松組,P=0.002 7;骨質疏松組vsSalB組,P=0.013 2<0.05。在Osterix mRNA中,假手術組vs骨質疏松組,P=0.001 3<0.05;骨質疏松組vsSalB組,P=0.002 7。)
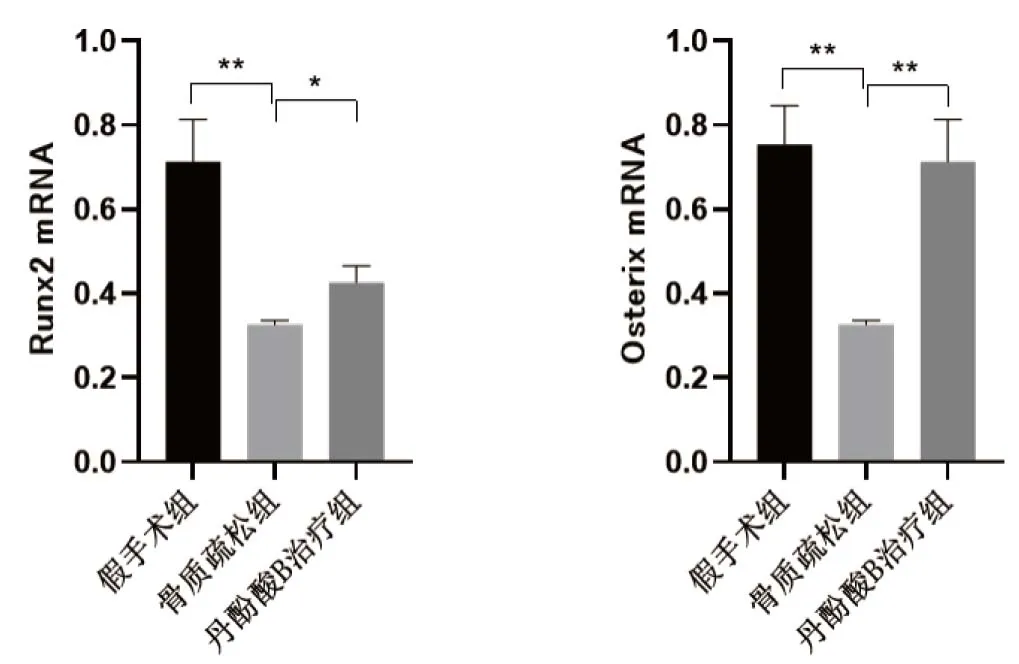
圖2 各組Runx2 和Osterix 水平比較
2.3 骨組織OPG和RANKL蛋白水平
經WB實驗發現,骨組織OPG和RANKL蛋白水平均表現為:骨質疏松組<SalB治療組<假手術組。見圖3。
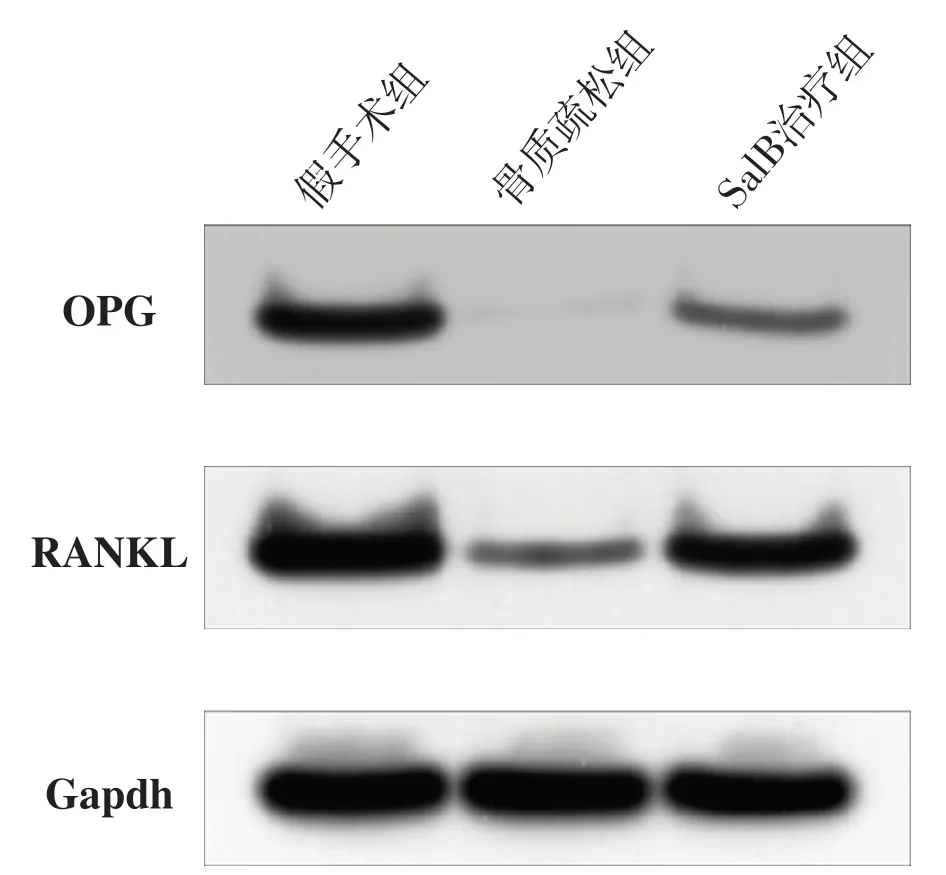
圖3 各組OPG 和RANKL 蛋白水平
3 討 論
年齡的增長會導致骨髓中的MSCs數量下降,進而導致骨質破壞。骨質疏松是一種發病率不斷上升的慢性病,處于更年期的婦女更容易發生骨質疏松[12-13]。更年期是老化的一種自然構成,其中包括卵巢的生殖功能下降[14]。可采用手術切除卵巢,也可以采用醫源性切除的方法,如化學治療和放射治療等。因此,該研究利用小鼠的卵巢摘除后,來探討更年期后的骨質疏松問題。已知,卵巢切除術后會引起骨質疏松癥,骨密度、生物力學強度、骨質量和骨小梁微結構明顯下降,上述變化與雌激素缺乏有關[15]。這種方法的優勢是可重復,可獲得較高的成功率。有研究顯示,在小鼠去卵巢后,骨小梁的數量顯著降低,骨質稀疏。與此同時,與正常小鼠相比,破骨細胞的數量要多。此外,與正常小鼠相比,它的破骨功能也變得更加活躍[16-17]。
骨骼是一種緊密的結締組織,包括大約 80%的皮質骨和約 20% 的小梁骨[18]。骨骼會經過不斷地重塑,通過重新吸收舊骨,并在同一位置形成相同數量的新骨[19-20]。骨礦物質密度已被看作是骨強度的替代指標,也是骨質量的重要因素。骨質疏松癥是因為骨量減少,骨微結構退化,它會提高骨脆性,還會提高髖骨和脊椎骨折的易感性,所以與骨折風險提高相關[21]。
根據報道,Runx2與Osterix是前成骨細胞的成骨細胞分化和成熟的關鍵基因[22-23]。由于骨的形成依賴于成骨細胞的分化,Runx2和Osterix的表達被認為是骨骼發育的成骨轉錄因子[24]。Runt相關的轉錄因子稱為Runx因子,其蛋白質在基因啟動子調控復合物的形成過程中,位于整合細胞信號的亞核區內。在骨骼發育的胚胎發生過程中,Runx2是人類Runt相關轉錄因子家族的一員。它被公認具有致癌的特性,許多研究顯示Runx2功能的紊亂會引起不同腫瘤的進展和侵襲[25]。長期以來,Osterix(Osx)是調控成骨細胞分化及骨礦化的關鍵轉錄因子。有研究顯示,Osx不僅在膜內成骨過程中發揮著關鍵的作用,同時也可以在軟骨的最終分化過程中對軟骨內成骨產生影響[26]。
骨重塑是由成骨細胞和破骨細胞交互作用調控的[27]。近年來,由于核因子-κB 受體激活劑(receptor activator of nuclear factor-κB,RANK)、RANKL和OPG對骨重建的影響,人們對它們的認識越來越多[28]。RANK 是腫瘤壞死因子家族中的一員,主要表達于破骨細胞或其前體。RANK與其配體RANKL相互作用并通過控制破骨細胞的分化、增殖和總體存活,從而調控骨吸收[29]。據報道,SalB可以增強OPG的表達,從而增加了 MSCs的成骨分化[30]。同時,SalB通過調節 RANKL/RANK/OPG信號通路來改善潑尼松所導致的類風濕性關節炎大鼠的骨質減少癥并改善骨質量[9]。本實驗的結果顯示,與骨質疏松組相比,SalB 治療后OPG及RANKL蛋白的表達均增加。
丹參屬于中草藥,其藥理功效豐富。SalB是丹參中含量最高、活性最高的親水性組分之一。前期研究發現,SalB 具有抗氧化、抗炎和抗纖維化作用,還可抑制細胞凋亡[31]。同時,SalB可通過激活ERK通路,增強人體內充質干細胞的成骨能力[32]。此外,SalB可經Wnt/β-Catenin通路,增強人牙周膜細胞的成骨分化[33]。本實驗發現,SalB處理后,小鼠的骨密度明顯高于骨質疏松組,而Runx2和Osterix mRNA的表達也明顯高于比骨質疏松組。
綜上所述,丹參對小鼠的骨質疏松具有一定的影響,但還需要更多的實驗來驗證本研究的結論。

