TREM-1與CIRP在胃癌組織中的表達及其對胃癌預后的評估價值
蔡喜中,茍 康,李丹陽
陜西省咸陽市中心醫院普外二科,陜西咸陽 712000
胃癌是一種全球常見、高發的消化道惡性腫瘤,據統計每年全球新增病例超過100萬例,而我國是胃癌發病的重災區[1]。近年來,隨著診療技術不斷革新,我國胃癌的早期診斷率明顯提高,但部分中晚期患者預后仍不盡人意[2]。因此,尋找一種可準確評估胃癌患者預后的生物學標志物至關重要。髓樣細胞觸發受體-1(TREM-1)是免疫球蛋白超家族成員,被認為是炎癥疾病的重要標志物,對急性胰腺炎、膿毒癥等疾病具有一定的預后評估價值[3-4]。近年來有研究發現,TREM-1與腫瘤相關性炎癥反應有關[5]。冷誘導RNA結合蛋白(CIRP)又稱為異源核糖核蛋白A18,可參與機體的氧化應激反應、細胞增殖、腫瘤進展等過程。有研究發現,CIRP表達上調與肝癌、乳腺癌等惡性腫瘤的預后不良有關[6-7],但是目前涉及到TREM-1、CIRP與胃癌的研究尚少。因此,本研究主要探討TREM-1與CIRP在胃癌組織中的表達及其對胃癌患者預后的評估價值。
1 資料與方法
1.1一般資料 選取2016年9月至2019年9月本院收治的108例胃癌患者作為研究對象,男63例,女45例;年齡18~75歲,平均(59.73±5.46)歲。收集胃癌患者的癌組織標本作為胃癌組(癌病變區域的中心,0.5 g),對應的癌旁組織標本作為癌旁組(距腫瘤邊緣>3 cm)。納入標準:(1)經病理組織活檢確診為胃癌;(2)年齡≥18歲。排除標準:(1)術前有放化療史者;(2)既往有胃部手術史者;(3)肺、心、肝等組織器官功能異常者;(4)認知異常或精神異常者;(5)合并其他腫瘤者;(6)依從性差及拒絕參與本研究者。所有患者及家屬均知情同意并簽署知情同意書。本研究經本院醫學倫理委員會審核批準。
1.2方法
1.2.1主要試劑與儀器 兔抗人TREM-1多克隆抗體(上海科敏生物科技有限公司),兔抗人CIRP多克隆抗體、羊抗兔二抗IgG(艾美捷科技有限公司),免疫組織化學試劑盒、DAB顯色盒(上海尚寶生物科技有限公司),顯微鏡(上海永科光學儀器有限公司)。
1.2.2TREM-1、CIRP檢測 采用免疫組織化學法檢測胃癌組織及癌旁組織中TREM-1、CIRP表達情況,操作流程如下:對胃癌組織及癌旁組織標本進行常規固定(4%多聚甲醛)、石蠟包埋、切片(4 μm)、脫蠟(二甲苯)、脫水(不同梯度的乙醇)處理后,在高壓、高溫環境內加入檸檬酸鈉溶液進行抗原修復,恢復正常溫度后,加入磷酸鹽緩沖液(PBS)沖洗3次(每次5 min),隨后加入5%山羊血清抗體進行封閉,滴加兔抗人TREM-1多克隆抗體(稀釋比例為1∶500)、兔抗人CIRP多克隆抗體(稀釋比例為1∶150),4 ℃冰箱內孵育過夜,加入PBS沖洗3次,加入羊抗兔二抗IgG(稀釋比例為1∶1 000),37 ℃環境內孵育30 min,PBS沖洗3次,采用DAB染色試劑盒進行顯色,隨后進行蘇木精復染、乙醇脫水、二甲苯透明及中性樹膠封片,顯微鏡下觀察結果。結果判定[8]:顯微鏡下觀察到細胞質內出現棕黃色或棕褐色顆粒為陽性細胞。陽性細胞染色強度分別為無顏色(計0分)、淺黃色或黃色(計1分)、棕黃色(計2分)、棕褐色(計3分);陽性細胞百分比評分分別為<5%(計0分)、5%~25%(計1分)、>25%~50%(計2分)、>50%~75%(計3分),>75%(計4分)。染色指數(SI)=陽性細胞染色強度×陽性細胞百分比。根據SI得分情況分為陽性表達(SI>3分)和陰性表達(SI≤3)。
1.2.3預后 采用電話、門診復查等方式對出院胃癌患者進行連續3年隨訪,記錄患者的生存狀況,隨訪截止時間為2022年9月。第1年每2個月隨訪1次,第2、3年每4個月隨訪1次,隨訪終止為患者死亡或隨訪截止。

2 結 果
2.1兩組TREM-1、CIRP表達情況比較 胃癌組TREM-1、CIRP陽性表達率均高于癌旁組,差異均有統計學意義(P<0.05)。見表1、圖1、圖2。

注:A為胃癌組;B為癌旁組。

注:A為胃癌組;B為癌旁組。

表1 兩組TREM-1、CIRP表達情況比較[n(%)]
2.2不同臨床病理特征的胃癌患者TREM-1、CIRP表達情況比較 不同性別、年齡、腫瘤位置、Lauren分型、浸潤深度的胃癌患者TREM-1、CIRP表達情況比較,差異均無統計學意義(P>0.05);低分化、腫瘤最大徑>5 cm、臨床分期為Ⅲ~Ⅳ期、有淋巴結轉移的胃癌患者TREM-1、CIRP陽性表達率均高于中/高分化、腫瘤最大徑≤5 cm、臨床分期為Ⅰ~Ⅱ期、無淋巴結轉移的胃癌患者,差異均有統計學意義(P<0.05)。見表2。

表2 不同臨床病理特征的胃癌患者TREM-1、CIRP表達情況比較[n(%)]
2.3不同臨床病理特征的胃癌患者3年生存情況比較 108例胃癌患者連續隨訪3年后,共有56例患者存活,存活率為51.85%。低分化、臨床分期為Ⅲ~Ⅳ期、有淋巴結轉移、TREM-1陽性表達、CIRP陽性表達胃癌患者3年生存率均低于中/高分化、臨床分期為Ⅰ~Ⅱ期、無淋巴結轉移、TREM-1陰性表達、CIRP陰性表達的胃癌患者,差異均有統計學意義(P<0.05)。見表3。
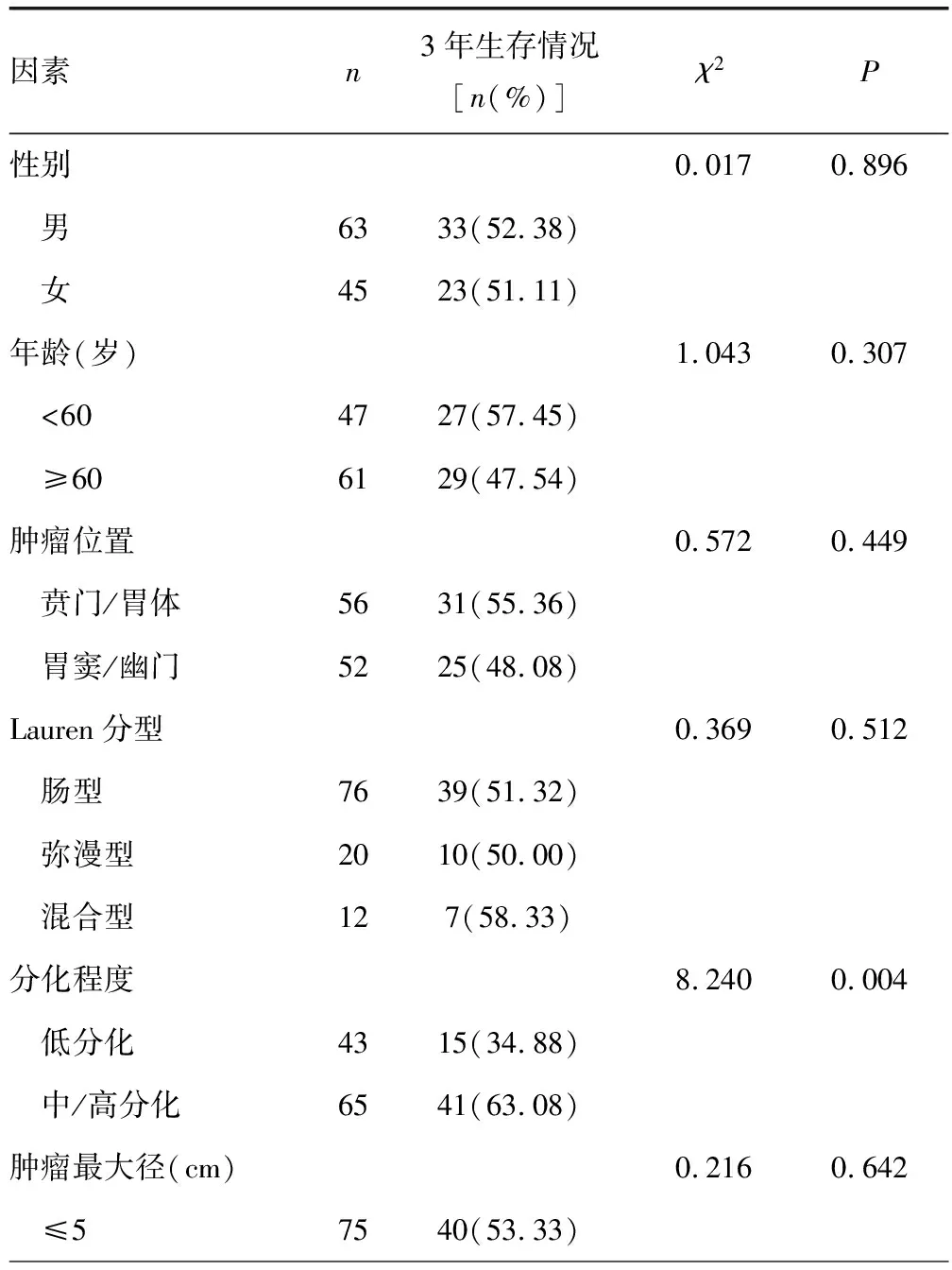
表3 不同臨床病理特征的胃癌患者3年生存情況比較
2.4胃癌患者預后的多因素Cox回歸分析 賦值:臨床分期(Ⅰ~Ⅱ期=0、Ⅲ~Ⅳ期=1)、淋巴結轉移(無=0、有=1)、TREM-1(陰性=0、陽性=1)、CIRP(陰性=0、陽性=1)。將胃癌患者的預后作為因變量,將表3中差異有統計學意義的指標作為自變量進行多因素Cox回歸分析,結果顯示,臨床分期為Ⅲ~Ⅳ期、有淋巴結轉移、TREM-1陽性表達、CIRP陽性表達是胃癌患者生存的危險因素(P<0.05)。見表4。

表4 胃癌患者預后的多因素Cox回歸分析
3 討 論
胃癌是威脅我國居民健康的常見惡性腫瘤之一,其發病率和病死率分別位于惡性腫瘤的第2、3位[9]。早期胃癌無特異性臨床癥狀,容易與慢性胃部疾病癥狀混淆,故多數患者確診時病情較為嚴重,已處于中晚期,治療效果很難達到預期目標,導致預后生存期較短[10]。因此,早期評估胃癌患者預后情況可為臨床治療提供指導。
TREM-1屬于免疫球蛋白超家族成員,其基因位于染色體6p21-1,廣泛表達于單核細胞、巨噬細胞等表面,作為炎癥反應激發的相關受體,可使細胞外信號調節激酶(ERK)、磷脂酰肌醇-3激酶等磷酸化,激活相關信號傳導通路,促使白細胞介素-2、腫瘤壞死因子-α等促炎因子水平上調,同時可與Toll樣受體發揮協同作用,誘發炎癥級聯反應[11-12]。潘薇等[13]探討了直腸癌組織的TREM-1表達情況,發現TREM-1在直腸癌組織中呈高表達,且與預后密切相關。李皖云等[14]研究發現,TREM-1可參與癌細胞的增殖、侵襲及凋亡等過程,與肝癌的發生和發展有關。有研究發現,TREM-1可作為評估肺癌手術效果及預后的標志物,為臨床提供新的治療靶點[15]。本研究結果顯示,胃癌組TREM-1陽性表達率高于癌旁組,差異有統計學意義(P<0.05);不同分化程度、腫瘤最大徑、臨床分期、淋巴結轉移患者的TREM-1表達情況比較,差異均有統計學意義(P<0.05)。提示TREM-1在胃癌患者中呈高表達,且與病情進展有關。究其原因,TREM-1是重要的炎癥反應激發受體,能夠募集單核細胞、巨噬細胞,促使腫瘤微環境中炎癥因子水平上調,加速腫瘤細胞的增殖、分化、侵襲過程,并且可抑制腫瘤細胞凋亡,進而參與胃癌的發生和發展。本研究結果顯示,TREM-1陽性表達患者3年生存率低于TREM-1陰性表達患者,差異有統計學意義(P<0.05)。提示TREM-1高表達與胃癌患者的預后不良有關,可作為評估胃癌預后的標志物。
CIRP是冷休克蛋白家族成員之一,最初被發現于小鼠睪丸組織,在人體肝、胃、肺等多個組織器官中表達,可與Toll樣受體4結合后激活核轉錄因子-κB(NF-κB)信號通路,增加炎癥介質釋放[16]。張琳梅等[17]研究發現,CIRP在口腔鱗狀細胞癌組織中呈高表達,且與較差的生存率有關。楊柳等[18]研究發現,腎癌組織中CIRP表達下調,可促進腎癌細胞的增殖與遷移。LIAO等[19]研究發現,CIRP可通過CTNNB1激活Wnt/β-catenin信號,促進非小細胞肺癌的進展。由此可知,CIRP具有抑癌和促癌作用,可參與腫瘤的發生和發展。本研究結果顯示,胃癌組CIRP陽性表達率高于癌旁組,差異有統計學意義(P<0.05);CIRP陽性表達與分化程度、腫瘤最大徑、臨床分期、淋巴結轉移有關(P<0.05)。提示CIRP高表達與胃癌的發生和發展有關。究其原因,CIRP作為內源性促炎癥介質,其過表達可使機體炎癥因子水平上調,并通過Toll樣受體介導的信號通路,活化NF-κB,進而促進腫瘤新生血管形成,抑制腫瘤細胞凋亡;同時CIRP可通過調控ERK、p38信號通路,促進細胞上皮間質轉化,調節腫瘤細胞的增殖與侵襲能力[20]。因此,CIRP高表達與胃癌進展有關,下調CIRP表達可抑制胃癌細胞的增殖、分化、侵襲等過程。本研究結果顯示,CIRP陽性表達患者3年生存率低于CIRP陰性表達患者,差異有統計學意義(P<0.05)。由此提示CIRP高表達與胃癌患者的預后不良有關。本研究結果顯示,臨床分期為Ⅲ~Ⅳ期、有淋巴結轉移、TREM-1陽性表達、CIRP陽性表達是胃癌患者生存的危險因素(P<0.05)。由此提示TREM-1、CIRP過表達可增加胃癌死亡的風險,監測其表達情況可預測其預后。
綜上所述,TREM-1、CIRP在胃癌患者中均呈高表達,且與臨床病理特征及預后密切相關,可作為胃癌預后評估的生物學標志物,有望為胃癌提供新的治療靶點。

