大學生創新創業訓練計劃的生物科學專業實驗教學改革探索
高 帆, 馮 佳, 謝樹蓮
(山西大學a.生物學國家級實驗教學示范中心;b.教務處;c.生命科學學院,太原 030006)
0 引言
大學生創新創業訓練計劃(簡稱“大創計劃”)是教育部“兩個工程”的重要建設內容,計劃自2012 年起在國內高校全面實施,本著“興趣驅動、自主實踐、重在過程”的原則,旨在驅動高校人才培養模式改革,強化當代大學生創新創業能力訓練,提高大學生的創新精神、創業素養和創新創業能力,從而全面提高人才培養質量[1]。
生命科學是以實驗和實踐為基礎的學科,生物科學專業作為該學科人才培養的重要專業,強調理論與實踐相結合[2](山西大學國家級一流本科專業建設點)。實驗教學始終貫穿國內高校生物科學本科教育的全過程。實驗教學質量的好壞直接關系生物科學專業學生人才培養質量的高低。實驗教學改革是提高本科生專業素養、實踐技能、設計分析與能力,進而提升人才培養質量的重要手段[3]。將大創計劃融入實驗教學課程,是實現計劃反哺教學,推動本科高校實驗教學改革發展的有效途徑之一。
現依托2012 ~2022 年間立項的國家級、省級大學生創新創業訓練計劃中涉及實驗技術與方法創新的10 個項目,將其與學校生物科學專業開設的5 門專業基礎實驗課和5 門專業實驗課(包括:植物學、動物學、動物生理、生物化學、遺傳學、微生物學、細胞生物學、分子生物學、基因工程、生物醫學等實驗)有機融合,通過教學實踐與效果反饋,探索該教學改革方式在本科實驗教學運行中的可行性與必要性。
1 生物科學專業大創計劃實施現狀
我校自2007 年實施國家大學生創新性實驗計劃項目(2012 年更名為國家級大學生創新創業訓練計劃)[4],歷經15 載,學校已形成國家級、省級、校級大學生創新創業計劃項目管理體系。2021 年,為了進一步完善本科實踐教學管理,學校修訂了“山西大學大學生創新創業訓練計劃管理辦法”(山大教字[2020]22 號),從項目管理、經費分配、成果認定等方面進行了制度完善。生物科學專業15 年來共立項大創計劃615 項,按項目級別分:國家級15 項,省級30 項,校級602項;按項目類型分,創新訓練項目582 項,創業訓練項目18 項,創業實踐項目2 項(見圖1);入選教育部“國創計劃”年會2 項,結題驗收通過率平均95.8%。現從大創計劃中遴選已用于本科實驗課程教學改革與實踐的項目進行介紹。
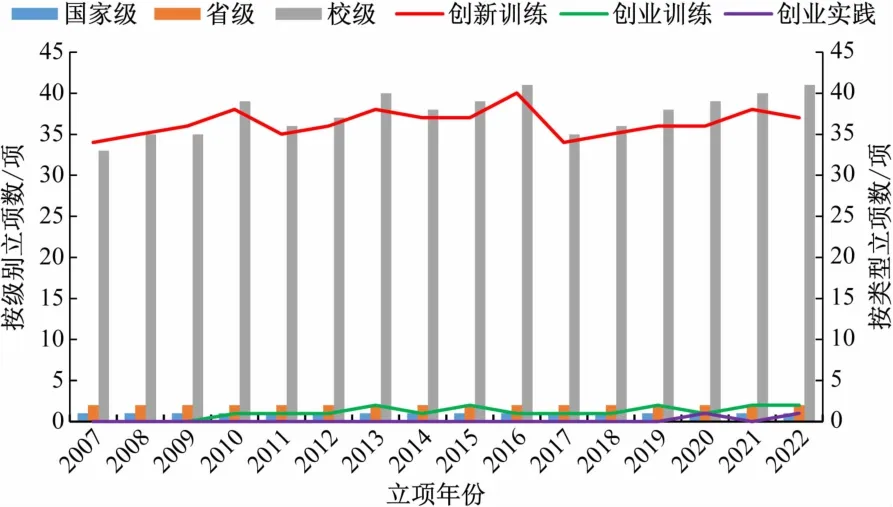
圖1 山西大學生物學國家級實驗教學示范中心2007 ~2022年生物科學專業大創計劃立項數(2007 ~2011 年為原“國家大學生創新性實驗計劃”)
2 生物科學專業實驗教學改革內容
2.1 植物學、植物生理學實驗教學改革
基于《植物學實驗》(高等教育出版社)實驗九——原核藻類和真核藻類,補充綠藻門代表性種類小球藻形態學鑒定的設計性課改內容;基于《植物生理學實驗教程》(科學出版社出版)第三篇——綜合性、設計性與研究性實驗,補充小球藻中性脂含量測定的設計性課改內容。該課程改革依托山西大學2016年大創計劃——產油綠藻的篩選及其油脂積累研究,凝練計劃項目核心研究成果,增加以上2 門課程的設計性實驗教學內容。通過本實驗項目的學習,學生可增強對低等藻類植物的形態學認識,教師可通過啟發式教學手段,引導學生將無機化學、有機化學相關實驗內容應用于功能藻的脂類等重要生理指標的檢測,有助于其進一步深入理解與掌握不同物種關鍵生理指標的測定方法。
實驗選取普通小球藻(Chlorellasp.)[5]為實驗材料,光學顯微鏡下對小球藻的細胞形態進行觀察[見圖2(a)];提取藻株的基因組DNA,設置rbcL 基因序列擴增體系并進行PCR擴增,擴增序列經測序后用NJ算法構建小球藻rbcL序系統進化樹;依據形態學及系統進化樹結果,鑒定該小球藻的種類為C. vulgaris。

圖2 小球藻顯微形態及不同鹽度脅迫下總脂含量測定
取10 mL小球藻液于離心管中8000 r/min離心5 min,取出后棄上清,加入氯仿2 mL、甲醇4 mL,混勻后用超聲波破碎儀破碎10 min,再次同等條件離心,之后取上清液于試管中;下層沉淀重復以上操作,直至藻粉呈白色。上清液中加入蒸餾水靜置可見分層,上層為甲醇與水相,下層為氯仿相,用滴管小心吸取上層液(甲醇與水相);將試管置于60 ℃烘箱中蒸發下層液中的氯仿及水分后,烘干稱重。按以下公式計算總脂含量及總脂產率:總脂含量(%)=所得油脂重量(mg)/干重(mg)×100%。由生理實驗結果可知[見圖2(b)],隨著鹽度的升高,小球藻的總脂含量先升高后降低,在1 g/L 鹽濃度下,小球藻的總脂含量最高,達53.89%。
2.2 動物學、動物生理學實驗教學改革
基于《動物學實驗教程》(科學出版社)實驗十二——昆蟲分類,補充飛蝗的前胸腺解剖學演示性實驗;基于《動物生理學實驗》(高等教育出版社)第三部分——綜合實驗,增加RNA沉默LmCYP307A1 對飛蝗蛻皮激素合成影響的研究性實驗。該課程改革依托山西大學2015 年大創計劃——RNA 沉默Halloween 基因家族對飛蝗蛻皮激素合成的影響,選取該項目研究的陽性實驗案例,分別增補進以上2 門課程的演示性和研究性實驗教學內容中。教師可利用現代信息技術手段,通過顯微互動、虛擬仿真等可視化、形象化的方式將該課程內容進行講授。通過本實驗項目的實施,學生可進一步掌握昆蟲解剖方法、蝗蟲組織器官識別、蝗蟲發育過程理解及利用轉錄組測序數據對生理相關目標基因進行表達量分析等。
實驗選取飛蝗(Locusta migratoria)[6]作為實驗材料,用解剖剪從飛蝗腹部末端開始,沿其背中線偏左位置向前剪開蟲的體壁,再用鑷子將腹部胸腺取下放入盛有超純水的盤中,肉眼觀察其胸腺形態;取潔凈載玻片,滴上清水,用解剖剪沿前胸腺位置剪開部分組織,用鑷子取蟲體前胸腺組織放入水滴中,蓋上蓋玻片進行顯微觀察。由解剖形態觀察結果可知(見圖3),飛蝗的前胸腺位于頭、胸間隔,頭頸斷面頭部一側,呈飄帶狀,形態隨著齡期和日齡變化明顯。
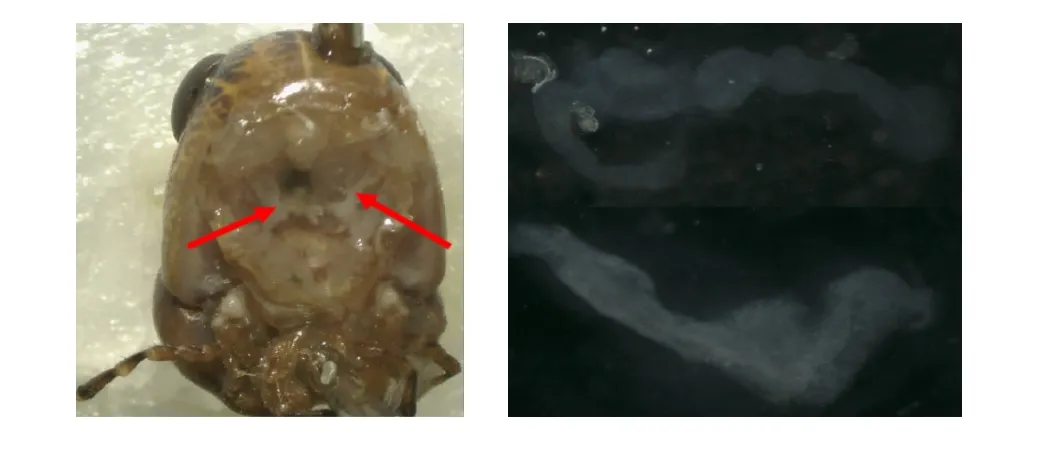
圖3 飛蝗前胸腺解剖觀察(左側紅色箭頭指向前胸腺位置,右側為放大20倍鏡下的光學顯微照片)
分別對飛蝗五齡若蟲進行dsRNA的注射,依據前期項目研究團隊已獲得的轉錄組測序數據集,對Halloween基因家族[7]的CYP307A1 基因進行五齡第2、5、8 天,成蟲第2 天胸腺組和對照組的基因含量分析。結果發現實驗組中的RNA 沉默后該基因的表達量遠高于對照組,其中樣本N5D5_PG(五齡第5 d)中基因的表達極顯著(見表1),通過表型進一步觀察發現該時期蟲體的蛻皮困難,甚至出現畸形蟲體,這間接表明CYP307A1 基因對飛蝗蛻皮激素的合成起正向調控作用。
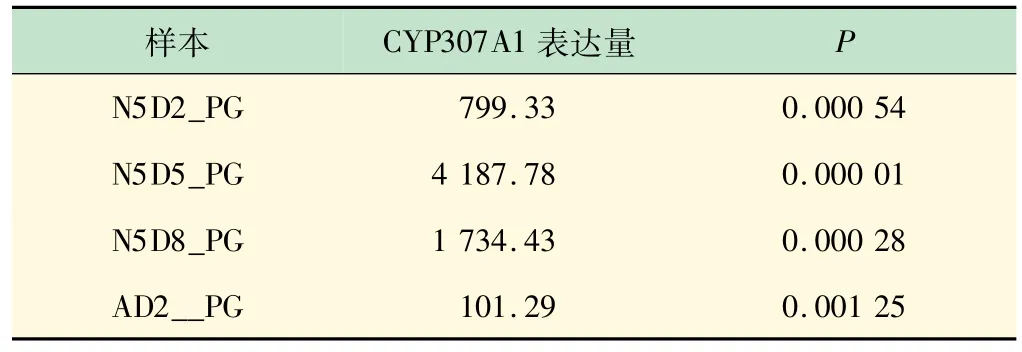
表1 飛蝗CYP307A1 基因在前胸腺的qRT-PCR相對表達
2.3 微生物學實驗教學改革
基于《微生物學實驗》(高等教育出版社)第三篇——研究性實驗,增加辣椒溶桿菌對櫻桃葉枯菌拮抗作用分析的研究性實驗教學內容。該課程改革依托山西大學2021 年大創計劃——細菌菌株C09 高效拮抗櫻桃葉枯菌的作用機制,遴選該研究項目中辣椒溶桿菌C09 對6 株櫻桃葉枯病原菌的拮抗研究部分,補充進該課程的研究性實驗項目中。教師可通過討論式、探究式教學手段,將該微生物學實驗基礎實驗技術、流程融入課程內容中,以規范微生物無菌化實驗操作為首要教學目標。通過本實驗項目的學習,學生不僅可鞏固細菌、真菌基礎知識,還可訓練學生在細菌/真菌培養、培養基配制、涂菌、抑菌分析等方面的操作。
本實驗所用細菌C09 經16S rDNA 測序和系統發育分析鑒定為辣椒溶桿菌屬;所用的植物病原細菌(Bacillussp. ZQX、Bacillussp. Z713、Bacillussp. Z7、Bacillussp. SB)和植物病原真菌(Fasuriumsp. JK、Fasuriumsp. ZQ)經前期研究驗證可導致櫻桃葉枯病[8]。將病原細菌分別接種到R2A培養基、病原真菌分別接種到PDA培養基中,28 ℃,180 r/min搖床培養36 h,收集菌液備用;吸取20 μL 菌液分別加入到20 mL R2A或PDA固體培養基中,迅速振蕩混勻后傾倒平板,培養基凝固后用鑷子將已滅菌牛津杯垂直放置到培養基表面,靜置10 min 后按序依次加入50 μL C09 菌液及50 μL R2A或PDA 液體培養基;靜置3 h后,28 ℃恒溫培養箱培養5 天觀察抑菌圈情況[見圖4(a)]。抑菌圈直徑測量結果顯示[見圖4(b)],辣椒溶桿菌C09對6株常見的櫻桃葉枯病原細菌和真菌均有良好的拮抗活性,拮抗大小順序分別為:Fasuriumsp. JK >Fasuriumsp.ZQ >Bacillussp. Z7 >Bacillussp. Z713 >Bacillussp. ZQX >Bacillussp. SB。

圖4 C09對櫻桃葉枯病菌的拮抗檢測
2.4 細胞生物學、遺傳學實驗教學改革
基于《細胞生物學實驗》(高等教育出版社)實驗13——細胞吞噬運動的觀察,增加嗜熱四膜蟲細胞對納米TiO2吞噬作用觀察的演示性實驗教學內容;基于《遺傳學實驗》(北京師范大學出版社)實驗3——動物生殖細胞減數分裂標本的制備與觀察,增加了納米TiO2暴露下的嗜熱四膜蟲細胞形態及核發育觀察的設計性實驗教學內容。該課程改革依托山西大學2020 年大創計劃——基于嗜熱四膜蟲[9]分析納米TiO2對減數分裂的影響,將其中涉及細胞形態觀察及有性生殖過程觀察的內容融入實驗課程項目中。教師可以經典案例的方式將涉及細胞實驗與遺傳實驗的內容進行綜合,著重考查學生對不同種類生物細胞形態的認識與特定細胞功能的理解。學生通過該實驗項目的學習,可進一步增強對于原生動物細胞形態的認知,學會使用激光掃描共聚焦顯微鏡,了解水污染毒素納米TiO2對水環境指示性生物四膜蟲生長發育的影響。
取活化的四膜蟲細胞200 μL,血細胞計數板計數后轉接混勻的細胞液至10 mL 培養基中(細胞終濃度:0.5 ×106個/mL),設置空白對照組以及納米材料實驗組。將各組恒溫搖床30 ℃,80 r/min培養,在12、24、36、48 h分別取樣計量分析,利用激光掃描共聚焦顯微鏡進行觀察。由圖5(a)~(c)可知,納米TiO2平均粒徑為(34.29 ± 12.37)nm,納米TiO2可與嗜熱四膜蟲細胞膜吸附,被四膜蟲吞噬進入胞內。
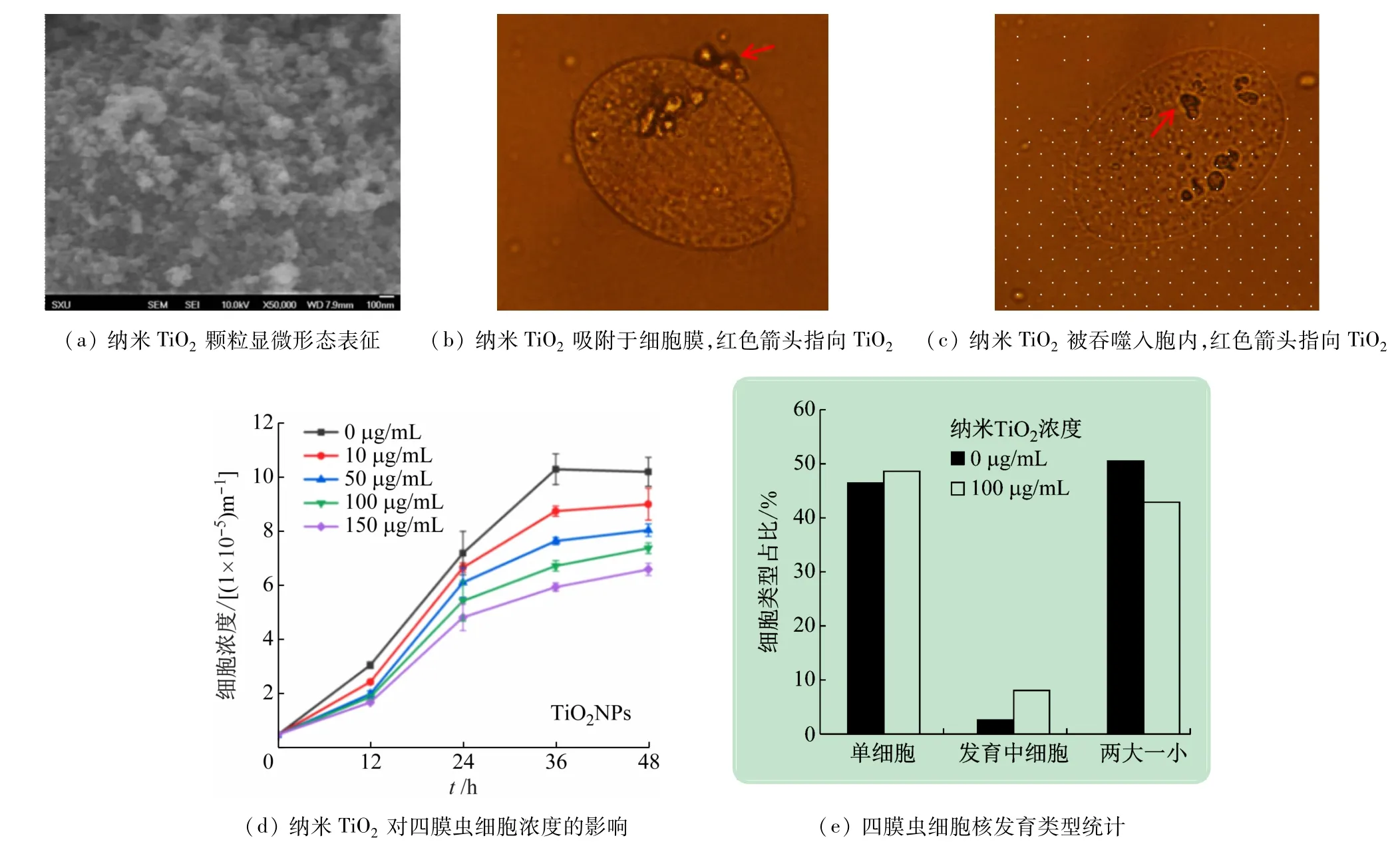
圖5 納米TiO2 對嗜熱四膜蟲細胞生長與發育影響
取活化的四膜蟲細胞200 μL 轉于10 mL SPP 培養基中,30 ℃孵育24 h 后將10 mL 培養液3500 r/min 離心5 min,去上清后加入10 mL Tis-HCL,3500 r/min離心5 min,洗去培養基,取10 mL蟲液饑餓24 h,再添加100 μg/mL納米TiO2,2、4、6、8、10、12、24 h 分別取樣計數。在激光掃描共聚焦顯微鏡下,樣本加入5 μL DAPI后觀察蟲細胞核發育情況并計數。由圖5(d)可知,不同濃度的納米TiO2在處理時間內,都會對四膜蟲細胞生長產生抑制作用,表現出劑量-效應關系(納米顆粒濃度升高,細胞數量越少;處理時間越長,細胞數量越少)。四膜蟲有性生殖一般在24 h 結束,最終細胞核發育為兩大一小形態。通過對比分析發現[見圖5(e)],實驗型與野生型四膜蟲的單細胞比例相似,細胞核發育形態一致性占比也較為相似,暗示該納米材料僅延緩了四膜蟲發育,但不會對其有性生殖過程產生影響。
2.5 生物化學、分子生物學實驗教學改革
基于《生物化學實驗》(高等教育出版社)第四章實驗14——植物基因組DNA 提取,增加以油菜為實驗材料的基因組DNA提取的驗證性實驗教學內容;基于《分子生物學實驗指導》(高等教育出版社)第二篇實驗五——DNA重組,增加油菜啟動子napA 的克隆及轉化的研究性實驗教學內容。該課程改革依托山西大學2013 年大創計劃——油菜種子特異啟動子NapA的克隆及在油菜中的轉化,將項目成果中油菜基因組DNA提取及其啟動子NapA 序列[10]擴增、連接T-載體、轉入E. coil DH5α菌株的內容融入本實驗課改內容。教師可以分步式、設計式教學手段,將本實驗教學內容進行設計與分解,設立各步的實驗小目標,鍛煉學生的邏輯思維能力。通過該實驗項目的學習,學生可鞏固植物基因組DNA提取的方法步驟,通過實例設計與實踐,加深對外源DNA轉化與重組的認識。
取油菜新鮮幼苗葉片5 或6 片,洗凈后用CTAB法提取基因組DNA[11]。每個DNA 樣品取5 μL 進行瓊脂糖凝膠電泳。由圖6(a)可知,CTAB 法提取的油菜基因組DNA片段較完整,可用于進一步實驗操作。

圖6 油菜啟動子NapA擴增及其轉化
根據GenBank 中NapA(X17542.1)的序列信息,設計特異引物對(上游引物: 5′-CGCGGATCCATACCATCTGATCATATCC-3′,下游引物:5′-AACTGCAG TTGCTCGAATACTAAATC-3′)。以油菜基因組DNA 為模板,按照表2 所示PCR 擴增體系進行反應溶液配制,PCR 儀上設置反應程序(94 ℃4 min、94 ℃30 s、60 ℃30 s、72 ℃2 min、72 ℃8 min、4 ℃10 min)進行NapA片段擴增。凝膠電泳結果顯示該片段成功克隆[見圖6(b)]。將NapA 片段進行膠回收,回收片段連接到T-載體,再將轉入大腸桿菌DH5α感受態細胞,陽性菌落進行質粒DNA 擴增[見圖6(c)]。將凝膠電泳陽性轉化子進行測序驗證。酶切法將NapA 片段從T-載體、35S 啟動子從pCaMBIA1301 上分別切下,回收NapA 和pCaMBIA1301 載體,連接酶作用下,將二者連接,構建植物表達載體Pcambia1301-NapA[見圖6(d)]。將表達載體pCAMBIA1301-NapA轉入到土壤農桿菌中,用農桿菌侵染油菜種子,在種子萌發時進行GUS基因表達的組織化學染色分析。結果顯示[見圖6(e)],種子有藍色反應,表明該啟動子在油菜種子中特異表達。

表2 油菜NapA PCR擴增體系
2.6 醫學生物學實驗教學改革
基于《醫學生物學實驗》(科學出版社)第四篇探究性實驗,增加1 個肺炎克雷伯菌耐藥性實驗的研究性實驗教學內容。該課程改革依托山西大學2019 年大創計劃——耐碳青霉烯肺炎克雷伯菌的耐藥機制研究,將項目研究成果中的創新方法——改良的Carba NP法用于鑒定菌株是否產碳青霉烯酶[12],再利用藥敏紙片擴散法(K-B 法)[13]檢測菌株對不同抗生素的敏感性。教師可嘗試翻轉式教學方式講授該實驗課程內容,學生通過自主設計、搭配抗生素種類,進行比較對照實驗,自主判斷并報告實驗結果,教師對結果進行分析反饋。通過該實驗項目的學習,學生可進一步掌握酶學實驗中酶活檢測的不同方法以及菌株耐藥性實驗的操作技術。
將前期經16S rRNA 鑒定為肺炎克雷伯菌[14]的10 株菌株(分別命名為K1,K2,…,K10)在BHI 液體培養基培養,16 h 后取出;用藥敏紙片擴散法檢測肺炎克雷伯菌對10 種常見抗生素(孢唑林、頭孢他啶、亞胺培南、環丙沙星、阿米卡星、阿奇霉素、四環素、磷霉素、氯霉素、復方新諾明)的藥物敏感性。檢測結果顯示(見表3),10 株肺炎克雷伯菌對頭孢唑林、頭孢他啶、亞胺培南、環丙沙星、阿米卡星均100%耐藥,對阿奇霉素的耐藥性為40%、四環素60%、復方新諾明60%,對磷霉素顯著敏感(100%不耐藥),對氯霉素耐藥性無法準確判斷。

表3 肺炎克雷伯菌對抗生素敏感性檢測結果
改良后的Carba NP法操作步驟:取20 μL甘油菌接種于3 mL BHI肉湯中(含1.5 μL 2μg/mL美羅培南),37 ℃下200 r/min 培養18 h;取上述菌液20 μL稀釋100 倍,同樣條件繼續培養至OD600檢測值在1.0至1.4;取2 mL菌液4 ℃5000 g 離心5 min,棄上清后用預冷的Tris-HCL(pH =7.8)洗菌兩次后重懸于500 μL Tris-HCL;冰上裂解菌體,12000 g 離心5 min后取上清;將50 μL上清分別加入底物Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ的檢測孔內,吹打混勻后置于37 ℃溫箱孵育1 ~2 h,期間注意底物顏色變化。結果顯示(見圖7),K1 ~K10 底物Ⅱ和Ⅳ均變為黃色,表明10 株肺炎克雷伯菌均可產生A類碳青霉烯酶(產碳青霉烯酶的一種),而早有研究顯示[15],產碳青霉烯酶是肺炎克雷伯菌對碳青霉烯類抗生素產生耐藥的主要原因。

圖7 改良后的Carba NP試驗結果
3 生物科學專業實驗教學改革實踐與實施成效
基于學校生物學國家級實驗教學示范中心10 年來的大創計劃實施成果,我們將上述典型實驗教學改革項目與生物科學專業實驗課程深度融合,以培養高質量生命科學人才為目標,構建了依托大創計劃的“四位一體”(選題優化、內容銜接、分階施教、動態調整)生物科學專業實驗教學改革體系(見圖8)。

圖8 示范中心生物科學專業實驗教學改革體系
2012 ~2022 年,參與示范中心實驗教學改革實踐的學生共538 人,授課教師17 人(其中高級職稱11人,中級職稱6 人),實驗教學改革項目累計實施2675人次,實驗總數1852 人時。通過對示范中心學生的問卷調查、成績合格率、升學就業情況間接反映該實驗教學改革舉措的實施效果。據統計,平均98.17%的學生反饋教學良好,實驗課程成績合格率平均達90.66%,升學率平均達26.71%,一次性就業率平均達71.73%。目前,學校示范中心實驗教學改革模式已在山西師范大學、太原師范學院、長治學院等進行推廣,部分研究成果已被山西省農科院、青島艾欣生物科技有限公司等單位應用,反饋效果良好;2 個項目入選教育部國家級大學生創新創業年會,4 個項目獲得全國大學生生命科學競賽一等獎,實施成效明顯。
4 結語
山西大學生物學國家級實驗教學示范中心依托大創計劃,深入推進生物科學專業學生的創新創業訓練,將大創計劃重要研究成果與本科實驗教學有機融合,構建“四位一體”的生物科學專業實驗教學改革體系,驅動高校“以創促學,以創促教”,以點帶面,全面深化學校實驗教學改革創新。在新時代“四新”建設背景下[16],該教學改革模式為國內高校培養當代大學生科學素養精神、創新實踐能力、科研訓練技能等方面提供了有益的借鑒。

