過量鐵攝入對(duì)孕鼠糖代謝和肝臟氧化損傷的影響
劉佩,蔡雁
過量鐵攝入對(duì)孕鼠糖代謝和肝臟氧化損傷的影響
劉佩,蔡雁
哈爾濱醫(yī)科大學(xué)附屬第四醫(yī)院產(chǎn)科,黑龍江哈爾濱 150001
探究過量鐵攝入對(duì)孕鼠糖代謝和肝臟氧化損傷的影響。選取28只SPF級(jí)C57BL/6雌鼠適應(yīng)2周后,根據(jù)體質(zhì)量進(jìn)行區(qū)組隨機(jī)化分組,分為對(duì)照(normal dose,ND)組、低劑量補(bǔ)鐵(low dose,LD)組、中劑量補(bǔ)鐵(middle dose,LD)組和高劑量補(bǔ)鐵(high dose,HD)組,鐵含量分別為35、175、350、525mg/kg,喂養(yǎng)2周后,雌雄3∶1同籠。孕0、6、12、18d測(cè)量小鼠空腹血糖(fasting blood glucose,F(xiàn)BG);孕17d行口服葡萄糖耐量試驗(yàn)(oral glucose tolerance test,OGTT);測(cè)定孕18d血清空腹胰島素(fasting insulin,F(xiàn)INS)水平,并計(jì)算穩(wěn)態(tài)模型評(píng)估的胰島素抵抗指數(shù)(homeostasis model assessment of insulin resistance,HOMA-IR);測(cè)定肝臟組織的總鐵離子含量、丙二醛(malondialdehyde,MDA)濃度和總超氧化物歧化酶(total superoxide dismutase,T-SOD)活性。HD組和MD組小鼠的肝臟總鐵離子含量明顯高于ND組(<0.05);與ND組相比,HD組、MD組和LD組小鼠在孕0、6、12、18d的FBG差異均無統(tǒng)計(jì)學(xué)意義(>0.05);HD組小鼠服糖后30、60min后血糖濃度顯著高于ND組(<0.05);HD組小鼠FINS和HOMA-IR顯著高于ND組。HD組、MD組和LD組小鼠肝臟的MDA含量明顯高于ND組(<0.05);但僅有HD組小鼠T-SOD活性明顯低于ND組(<0.05)。小鼠孕前及孕期膳食補(bǔ)充中、高劑量的鐵可顯著增加肝臟儲(chǔ)鐵量,但只有高劑量補(bǔ)鐵時(shí)才會(huì)導(dǎo)致孕鼠的肝臟出現(xiàn)一定程度的氧化損傷,以及胰島素抵抗、高胰島素血癥和糖耐量減低。
小鼠;鐵過量;妊娠;糖代謝;氧化應(yīng)激
妊娠期糖尿病(gestational diabetes mellitus,GDM)是常見的妊娠并發(fā)癥之一,可導(dǎo)致多種母兒并發(fā)癥,如巨大兒、肩難產(chǎn)和2型糖尿病等[1-2]。高齡、孕前超重、肥胖和糖尿病家族史等是GDM的已知危險(xiǎn)因素[3]。近年來,孕期鐵的攝入量與GDM的相關(guān)性也引起了重視,在妊娠期間是否常規(guī)進(jìn)行補(bǔ)鐵已經(jīng)成為一個(gè)極具爭(zhēng)議的話題[4]。鐵缺乏(iron deficiency,ID)在孕婦中是常見的,臨床上通常推薦常規(guī)補(bǔ)鐵,以預(yù)防孕產(chǎn)婦貧血并確保胎兒鐵儲(chǔ)存充足[5]。然而鐵也是一種強(qiáng)氧化劑,過量的鐵所誘發(fā)的氧化損傷可導(dǎo)致機(jī)體糖代謝受損[6]。研究表明,過量血清鐵蛋白(serum ferritin,SF)和葡萄糖代謝紊亂之間存在顯著關(guān)聯(lián)[7-10]。研究顯示,孕期較高的SF和血紅蛋白(hemoglobin,Hb)與GDM風(fēng)險(xiǎn)增加有關(guān),但關(guān)于補(bǔ)鐵和GDM風(fēng)險(xiǎn)的研究結(jié)果還不明確,部分結(jié)果相互矛盾,這可能與基線鐵狀態(tài)、補(bǔ)鐵劑量和持續(xù)時(shí)間相關(guān)[11-12]。
關(guān)于鐵過量導(dǎo)致GDM的機(jī)制尚不明確,根據(jù)鐵的促氧化作用及氧化應(yīng)激與GDM的關(guān)系,目前認(rèn)為機(jī)體內(nèi)鐵水平升高可能通過氧化應(yīng)激影響胰島素信號(hào)通路及胰島β細(xì)胞功能,進(jìn)而導(dǎo)致糖代謝紊亂和GDM的發(fā)生[13]。因此,本研究以小鼠為實(shí)驗(yàn)對(duì)象,擬通過模仿人類孕期補(bǔ)鐵,在孕前和孕期給予小鼠高鐵膳食,建立孕鼠鐵過量模型,并進(jìn)一步探討孕期非病理狀態(tài)下鐵過量相關(guān)的氧化損傷以及與糖代謝紊亂之間可能存在的關(guān)聯(lián)。
1 材料與方法
1.1 主要試劑與儀器
總鐵離子試劑盒、丙二醛(malondialdehyde,MDA)試劑盒、總超氧化物歧化酶(total superoxide dismutase,T-SOD)試劑盒(武漢伊萊瑞特生物科技股份有限公司);BCA蛋白濃度測(cè)定試劑盒(上海碧云天生物技術(shù)有限公司);Synergy HTX多功能酶標(biāo)儀(美國(guó)BioTek公司);AU5800全自動(dòng)生化分析儀(美國(guó)貝克曼庫爾特有限公司);安穩(wěn)+快速血糖儀(三諾生物傳感股份有限公司)。
1.2 動(dòng)物飼料
飼料購買于南通特洛菲飼料科技有限公司,根據(jù)美國(guó)營(yíng)養(yǎng)學(xué)會(huì)(American Institute of Nutrition,AIN)93生長(zhǎng)期飼料配方(鐵含量12mg/kg)定制飼料,通過向飼料中添加枸櫞酸鐵,配制成含鐵量不同的飼料,分別為正常飼料(鐵含量35mg/kg,生理需要?jiǎng)┝浚蛣┝垦a(bǔ)鐵飼料(鐵含量175mg/kg,5倍標(biāo)準(zhǔn)鐵含量),中劑量補(bǔ)鐵(鐵含量350mg/kg,10倍標(biāo)準(zhǔn)鐵含量),高劑量補(bǔ)鐵飼料(鐵含量525mg/kg,15倍標(biāo)準(zhǔn)鐵含量)。
1.3 實(shí)驗(yàn)動(dòng)物
SPF級(jí)6周齡C57BL/6小鼠36只(其中雌性28只,雄性8只),體質(zhì)量16~18g,購自遼寧長(zhǎng)生生物技術(shù)股份有限公司,實(shí)驗(yàn)動(dòng)物許可證號(hào):SCXK(遼)2020-0001。將小鼠飼養(yǎng)于哈爾濱醫(yī)科大學(xué)附屬第四醫(yī)院實(shí)驗(yàn)動(dòng)物中心,保持適應(yīng)的環(huán)境溫度、濕度和光照,自由飲水和攝食。本研究獲得哈爾濱醫(yī)科大學(xué)附屬第四醫(yī)院動(dòng)物倫理委員會(huì)批準(zhǔn)(倫理審批號(hào):2022-DWSYLLCZ-12)。
1.4 實(shí)驗(yàn)分組干預(yù)
小鼠飼養(yǎng)于SPF級(jí)動(dòng)物房中,適應(yīng)性喂養(yǎng)2周后,雌鼠根據(jù)體質(zhì)量進(jìn)行區(qū)組隨機(jī)化分組,分為對(duì)照(normal dose,ND)組、低劑量補(bǔ)鐵(low dose,LD)組、中劑量補(bǔ)鐵(middle dose,LD)組和高劑量補(bǔ)鐵(high dose,HD)組。分組喂養(yǎng)2周后,每日18時(shí)將小鼠按雌雄3∶1合籠,次日8時(shí)見陰栓者記為孕第0天,未見陰栓者繼續(xù)行陰道涂片檢查,如果涂片見到精子者記為孕第0天。隔日監(jiān)測(cè)孕鼠體質(zhì)量,若孕10d體質(zhì)量增長(zhǎng)<2g,則視為未孕,將其繼續(xù)與雄鼠合籠。定期觀察小鼠的一般情況并記錄小鼠的攝食量及體質(zhì)量。
1.5 樣本采集
禁食不禁水14h,在基線(隨機(jī)分組前)和孕0、6、12、18d經(jīng)尾靜脈采血測(cè)定空腹血糖(fasting blood glucose,F(xiàn)BG);孕17d給予小鼠50%葡萄糖(1g/kg)灌胃處理,然后于0、30、60、120min經(jīng)尾靜脈采血測(cè)定血糖濃度;孕18d實(shí)驗(yàn)結(jié)束后,用10%水合氯醛(4ml/kg)經(jīng)腹腔注射麻醉小鼠,經(jīng)眼球取血后處死小鼠,剖取肝臟。
1.6 糖代謝相關(guān)指標(biāo)測(cè)定
采用快速血糖儀測(cè)量血糖水平,全自動(dòng)生化分析儀檢測(cè)血清空腹胰島素(fasting insulin,F(xiàn)INS)水平,并計(jì)算穩(wěn)態(tài)模型評(píng)估的胰島素抵抗指數(shù)(homeostasis model assessment of insulin resistance,HOMA-IR)=FBG(mmol/L)×FINS(μIU/ml)/22.5,評(píng)估胰島素抵抗水平。
1.7 肝臟鐵離子和氧化應(yīng)激水平檢測(cè)
分別取0.1g小鼠肝臟組織,按照試劑盒說明分別進(jìn)行組織總鐵離子含量、MDA含量和SOD活性測(cè)定,采用BCA法定量測(cè)定蛋白濃度,計(jì)算得到總鐵離子含量(μmol/kg濕重)、MDA含量(μmol/g prot)和SOD活性(U/mg prot)。
1.8 統(tǒng)計(jì)學(xué)方法
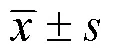
2 結(jié)果
2.1 一般情況
最終成功受孕24只雌鼠(ND組6只、LD組7只、MD組5只、HD組6只)。各組小鼠攝食量正常、毛色光澤、反應(yīng)靈敏、生長(zhǎng)發(fā)育正常、精神狀態(tài)良好、活動(dòng)正常,組間無明顯差異。受孕后小鼠體質(zhì)量逐漸增加,但各組之間差異無統(tǒng)計(jì)學(xué)意義(>0.05),見圖1。
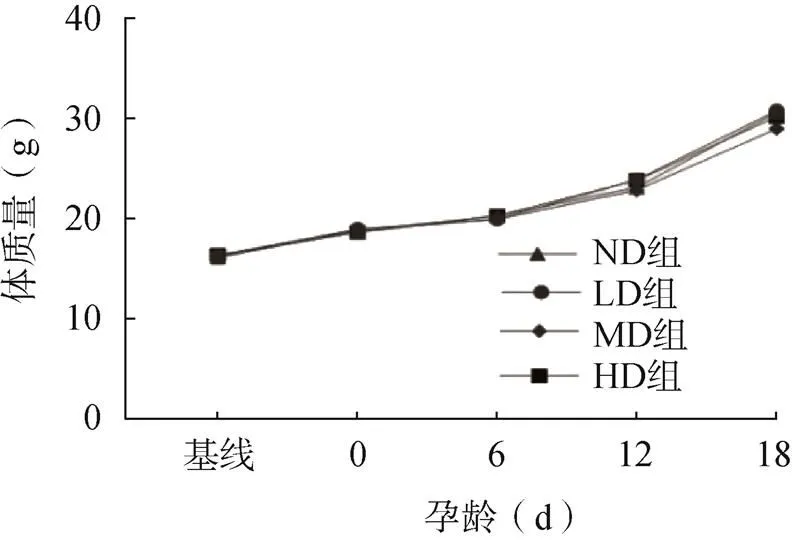
圖1 小鼠體質(zhì)量增長(zhǎng)情況
2.2 小鼠肝臟組織鐵離子變化
小鼠肝臟鐵離子含量隨著補(bǔ)鐵劑量的增加而升高,HD組(<0.01)、MD組(<0.05)肝臟鐵離子含量顯著高于ND組,LD組與ND組差異無統(tǒng)計(jì)學(xué)意義(>0.05),見圖2。
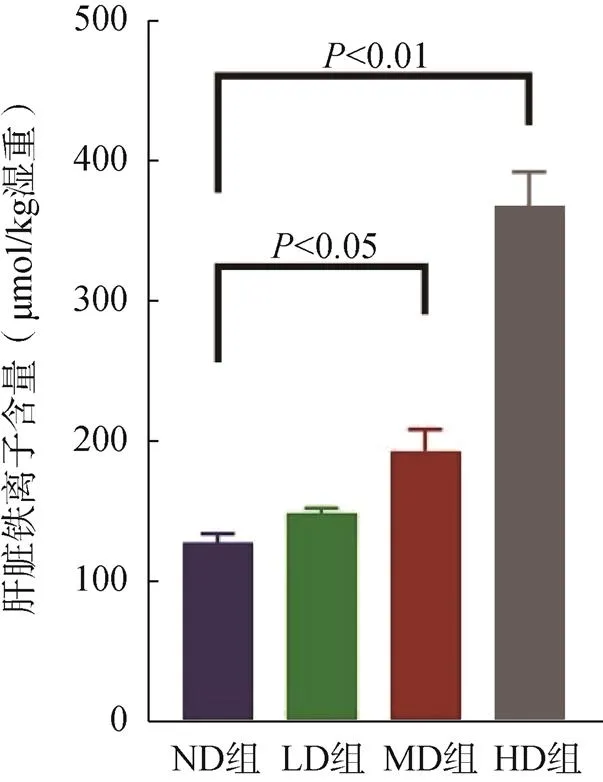
圖2 小鼠肝臟鐵離子變化
2.3 鐵過量對(duì)小鼠糖代謝相關(guān)指標(biāo)的影響
各組小鼠基線FBG差異無統(tǒng)計(jì)學(xué)意義(>0.05),隨著妊娠的進(jìn)展,血糖水平逐漸上升,孕12d后血糖水平開始下降。LD組、MD組和HD組在孕6、12、18d的FBG高于ND組,但差異無統(tǒng)計(jì)學(xué)意義(>0.05,圖3A)。服糖30min和60min后,HD組血糖濃度顯著高于ND組(<0.05,圖3B),各組小鼠在0min及服糖120min后的血糖值差異無統(tǒng)計(jì)學(xué)意義(>0.05,圖3B)。HD組的FINS濃度和HOMA-IR顯著高于ND組(<0.05,表1)。
2.4 小鼠肝臟氧化應(yīng)激指標(biāo)變化
LD組、MD組、HD組小鼠的MDA含量均明顯高于ND組(<0.05,圖4A);各組小鼠的肝臟T-SOD活性逐漸下降,僅HD組則顯著低于ND組(<0.05,圖4B)。
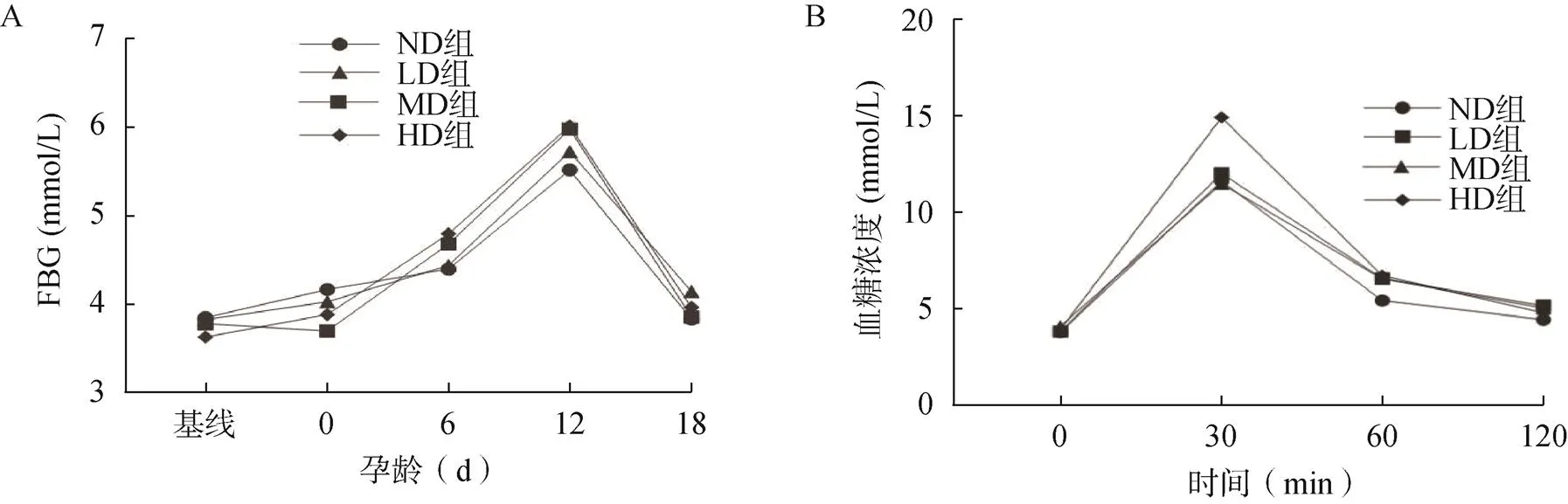
圖3 小鼠空腹血糖及口服葡萄糖耐量變化
A.小鼠空腹血糖變化;B.小鼠口服葡萄糖耐量變化
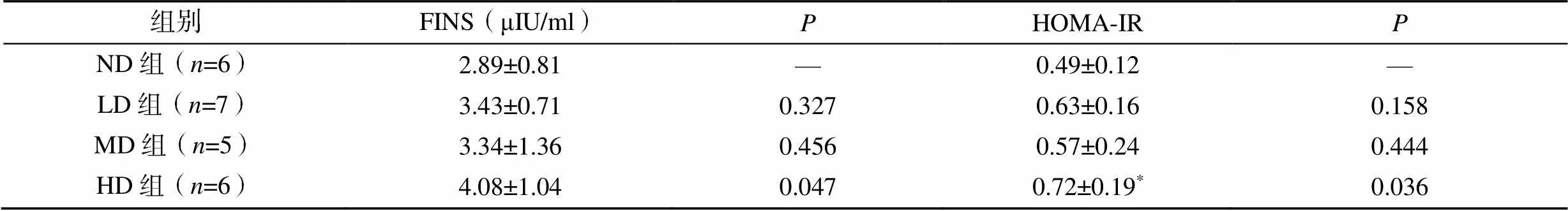
表1 小鼠空腹胰島素及胰島素抵抗指數(shù)變化
注:與ND組比較,*<0.05
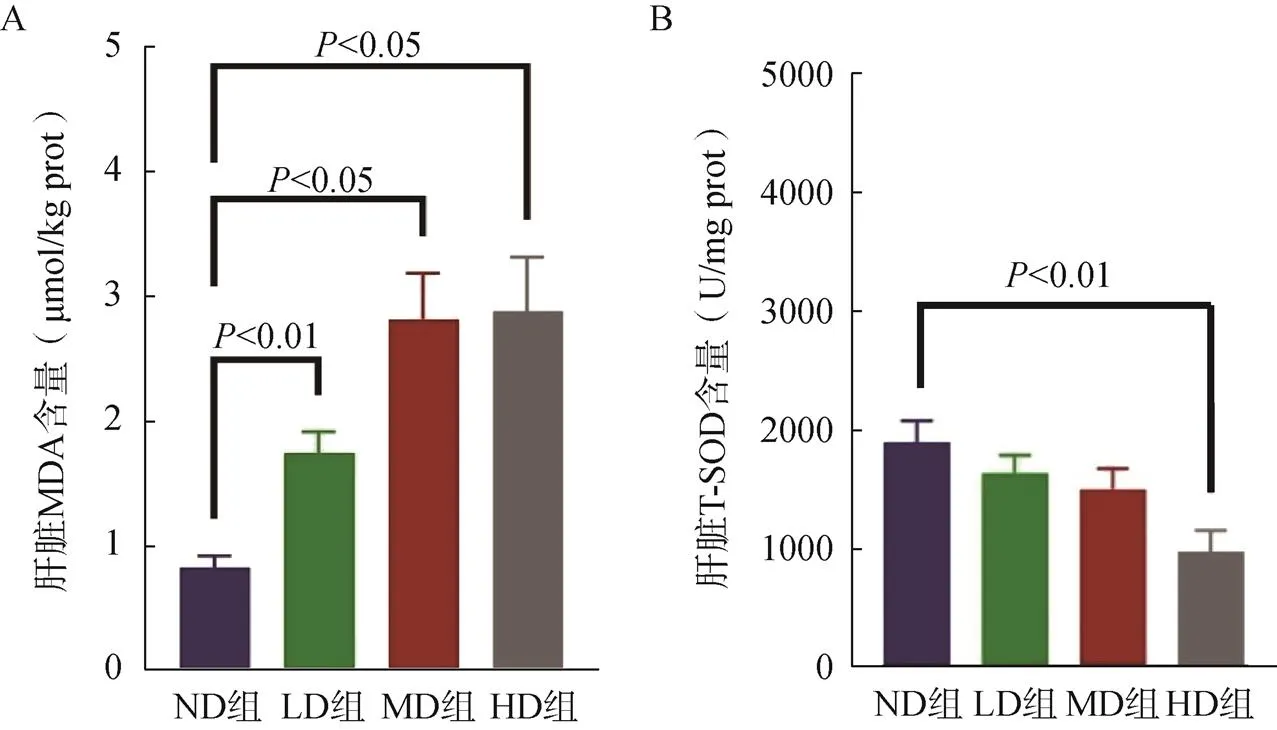
圖4 小鼠肝臟氧化應(yīng)激指標(biāo)變化
A.小鼠肝臟丙二醛含量;B.小鼠肝臟總超氧化物歧化酶活性
3 討論
越來越多的臨床研究發(fā)現(xiàn),孕期鐵儲(chǔ)備增加和GDM發(fā)生風(fēng)險(xiǎn)相關(guān),這引起了臨床醫(yī)師對(duì)孕期普遍補(bǔ)鐵的重視[10,14-15]。隨著人們對(duì)孕期ID及IDA的重視以及生活水平的提高,許多婦女可能已經(jīng)達(dá)到了膳食鐵的推薦攝入量,無論她們是否貧血,都可能在孕前和孕期補(bǔ)充含有不同劑量鐵元素的復(fù)合維生素或單純鐵劑,因此很有可能面臨鐵過量的風(fēng)險(xiǎn)。同時(shí)研究表明,孕期母體鐵調(diào)素將受到抑制,這將促進(jìn)膳食鐵的吸收,可能使母體暴露于鐵過量的狀態(tài)下[5]。
本研究以C57BL/6小鼠為實(shí)驗(yàn)對(duì)象,通過向動(dòng)物飼料中添加不同含量的枸櫞酸鐵,建立了孕鼠鐵過量模型,觀察對(duì)孕鼠糖代謝的影響和肝臟的損傷情況。根據(jù)各類指南共識(shí)的推薦劑量,在我國(guó)孕婦中補(bǔ)充鐵劑的劑量范圍為30~300mg/d元素鐵,比我國(guó)膳食鐵推薦攝入量20~29mg/d高出約15倍[16-18]。因此,為了模仿人類的孕期補(bǔ)鐵,在本研究的小鼠飼料中鐵含量范圍與推薦給孕婦的比例相似,補(bǔ)鐵組添加的鐵含量在175~525mg/kg之間,比正常對(duì)照組(35mg/kg)高出5~15倍。
本實(shí)驗(yàn)中對(duì)照組和補(bǔ)鐵組之間的攝食量沒有差異,這表明攝食量對(duì)實(shí)驗(yàn)結(jié)果的干擾較小,該模型可以用來探究膳食鐵過量對(duì)孕期糖代謝的影響。肝臟是全身鐵穩(wěn)態(tài)的關(guān)鍵器官,肝臟的鐵含量被認(rèn)為是代表機(jī)體鐵狀態(tài)的重要指標(biāo)[19]。膳食鐵缺乏時(shí)肝臟鐵含量將顯著降低,而鐵過量時(shí)將增加[20]。隨著膳食補(bǔ)鐵劑量的不斷增加,肝臟中的鐵含量也逐漸增加。本研究結(jié)果顯示,HD組和MD組小鼠的鐵含量顯著高于ND組,這說明通過中、高劑量的補(bǔ)鐵成功建立了孕期鐵過量的小鼠模型。
由于孕期的血糖水平隨著妊娠時(shí)間的變化而不同,且小鼠的孕期為19~21d,因此本研究在孕0、6、12、18d動(dòng)態(tài)監(jiān)測(cè)小鼠的血糖[21]。既往的研究表明,膳食補(bǔ)鐵可使小鼠FBG升高,膳食鐵限制可降低FBG[22]。而在本研究結(jié)果中,補(bǔ)鐵組小鼠的血糖水平與對(duì)照組之間差異無統(tǒng)計(jì)學(xué)意義,這可能是因?yàn)楸狙芯康纳攀宠F含量較低,尚不足以引起小鼠糖代謝的紊亂。研究發(fā)現(xiàn),膳食補(bǔ)鐵可干擾葡萄糖的攝取和利用,導(dǎo)致妊娠大鼠的糖耐量減低,而鐵耗竭可使胰島素敏感度增加[23-24]。本研究中小鼠的OGTT結(jié)果顯示,HD組在服糖30min及60min后的FBG高于ND組,這說明孕期膳食鐵過量對(duì)小鼠糖代謝有一定的影響。由于孕期采血量過多易導(dǎo)致小鼠流產(chǎn),因此,本研究?jī)H在處死當(dāng)天進(jìn)行了FINS測(cè)量,結(jié)果顯示,僅HD組空腹胰島素和HOMA-IR顯著高于ND組。這些結(jié)果均表明膳食補(bǔ)充高劑量鐵會(huì)干擾胰島素信號(hào)通路,并導(dǎo)致一定程度的胰島素抵抗。
當(dāng)自由基的生成速度超過機(jī)體的抗氧化能力時(shí),就會(huì)導(dǎo)致氧化應(yīng)激,氧化應(yīng)激是胰島素抵抗和糖尿病發(fā)展的主要上游事件[25]。當(dāng)細(xì)胞內(nèi)的游離鐵增加時(shí),羥基自由基的產(chǎn)生將會(huì)增加,進(jìn)而促進(jìn)氧化應(yīng)激的發(fā)生。MDA通常用于反映細(xì)胞脂質(zhì)過氧化的程度,間接反映細(xì)胞損傷的程度,而SOD作為機(jī)體最重要的抗氧化酶之一,通常與MDA共同測(cè)定用于反映機(jī)體的氧化應(yīng)激水平[26]。研究表明,鐵過量相關(guān)的氧化應(yīng)激可能導(dǎo)致胰島素抵抗和胰島β細(xì)胞損傷;肝臟作為全身最大的代謝器官及機(jī)體主要的儲(chǔ)鐵器官,在胰島素抵抗中發(fā)揮著關(guān)鍵作用,鐵過量所誘發(fā)的氧化損傷將首先發(fā)生在肝臟[27]。因此,本研究測(cè)定了肝臟的氧化損傷標(biāo)志物以反映鐵過量對(duì)孕期氧化應(yīng)激水平的影響。本研究結(jié)果顯示,LD組、MD組、HD組小鼠MDA含量均顯著高于ND組,僅HD組的SOD活性顯著高于ND組。這表明當(dāng)攝入過量鐵時(shí),機(jī)體脂質(zhì)過氧化損傷增加,同時(shí)抗氧化作用也會(huì)增強(qiáng),只有高劑量補(bǔ)鐵時(shí)才會(huì)導(dǎo)致機(jī)體的氧化和抗氧化作用失衡,進(jìn)而導(dǎo)致氧化應(yīng)激的發(fā)生。
綜上所述,本研究認(rèn)為小鼠孕前及孕期過量攝入鐵可以使小鼠肝臟的鐵沉積增加,同時(shí)攝入高劑量的鐵將導(dǎo)致肝臟組織出現(xiàn)一定程度的氧化損傷。過量攝入鐵雖不會(huì)對(duì)小鼠FBG造成明顯的影響,但卻導(dǎo)致了糖耐量減低、高胰島素血癥和胰島素抵抗。隨著社會(huì)經(jīng)濟(jì)水平的提高,孕前及孕期膳食和各種營(yíng)養(yǎng)素中鐵元素的攝入量也逐漸增加,臨床醫(yī)生應(yīng)警惕過量補(bǔ)鐵的潛在風(fēng)險(xiǎn),根據(jù)孕婦的個(gè)體鐵代謝水平推薦合適的補(bǔ)鐵方案,嚴(yán)密監(jiān)測(cè)鐵缺乏的指標(biāo),避免補(bǔ)鐵過量可能帶來的危害。
[1] YE W, LUO C, HUANG J, et al. Gestational diabetes mellitus and adverse pregnancy outcomes: systematic review and meta-analysis[J]. BMJ, 2022, 377: e067946.
[2] JOHNS E C, DENISON F C, NORMAN J E, et al. Gestational diabetes mellitus: mechanisms, treatment, and complications[J]. Trends Endocrinol Metab, 2018, 29(11): 743–754.
[3] LEE K W, CHING S M, RAMACHDRAN V,et al. Prevalence and risk factors of gestational diabetes mellitus in Asia: a systematic review and meta-analysis[J]. BMC Pregnancy Childbirth,2018, 18(1): 494.
[4] SUN C, WU Q J, GAO S Y,et al. Association between the ferritin level and risk of gestational diabetes mellitus: a meta-analysis of observational studies[J]. J Diabetes Investig, 2020, 11(3): 707–718.
[5] FISHER A L, NEMETH E. Iron homeostasis during pregnancy[J]. Am J Clin Nutr, 2017, 106(Suppl 6): 1567S–1574S.
[6] FISHER A L, SANGKHAE V, BALUSIKOUA K, et al. Iron-dependent apoptosis causes embryotoxicity in inflamedand obese pregnancy[J]. Nat Commun, 2021, 12(1): 4026.
[7] HAIDER B A, OLOFIN I, WANG M,et al. Anaemia, prenatal iron use, and risk of adverse pregnancy outcomes: systematic review and meta-analysis[J]. BMJ, 2013, 346: f3443.
[8] ZHANG X, WU M, ZHONG C, et al. Association between maternal plasma ferritin concentration, iron supplement use, and the risk of gestational diabetes: a prospective cohort study[J]. Am J Clin Nutr, 2021, 114(3): 1100–1106.
[9] CHENG Y, LI T, HE M,et al. The association of elevated serum ferritin concentration in early pregnancy with gestational diabetes mellitus: a prospective observational study[J]. Eur J Clin Nutr, 2020, 74(5): 741–748.
[10] ZHANG C, RAWAL S. Dietary iron intake, iron status, and gestational diabetes[J]. Am J Clin Nutr, 2017, 106(Suppl 6): 1672S–1680S.
[11] DONGIOVANNI P, RUSCICA M, RAMEETTA R,et al. Dietary iron overload induces visceral adipose tissue insulin resistance[J]. Am J Pathol, 2013, 182(6): 2254–2263.
[12] PETRY C J. Iron supplementation in pregnancy and risk of gestational diabetes: a narrative review[J]. Nutrients, 2022, 14(22): 4791.
[13] 劉俊秀, 賀木蘭, 程琰, 等. 孕期補(bǔ)鐵與妊娠期糖尿病關(guān)系的研究進(jìn)展[J]. 中華圍產(chǎn)醫(yī)學(xué)雜志, 2017, 20(5): 393–396.
[14] RAWAL S, HINKLE S N, BAO W, et al. A longitudinal study of iron status during pregnancy and the risk of gestational diabetes: findings from a prospective, multiracial cohort[J]. Diabetologia, 2017, 60(2): 249–257.
[15] DURRANI L, EIAZ S, TAVARES L B, et al. Correlation between high serum ferritin level and gestational diabetes: a systematic review[J]. Cureus, 2021, 13(10): e18990.
[16] 中華醫(yī)學(xué)會(huì)圍產(chǎn)醫(yī)學(xué)分會(huì). 中國(guó)妊娠期鐵缺乏和缺鐵性貧血診治指南[J]. 中華圍產(chǎn)醫(yī)學(xué)雜志, 2014, 17(7): 451–454.
[17] PAVORD S, DARU J, PRASANNAN N, et al. UK guidelines on the management of iron deficiency in pregnancy[J]. Br J Haematol, 2020, 188(6): 819–830.
[18] 中國(guó)營(yíng)養(yǎng)學(xué)會(huì)膳食指南修訂專家委員會(huì)婦幼人群膳食指南修訂專家工作組. 孕期婦女膳食指南[J]. 中華圍產(chǎn)醫(yī)學(xué)雜志, 2016, 19(9): 641–648.
[19] PANTOPOULOS K, PORWAL S K, TARTAKOFF A, et al. Mechanisms of mammalian iron homeostasis[J]. Biochemistry, 2012, 51(29): 5705–5724.
[20] SANGKHAE V, FISHER A L, WONG S, et al. Effects of maternal iron status on placental and fetal iron homeostasis[J]. J Clin Invest, 2020, 130(2): 625–640.
[21] 任甲翠, 丁葉, 殷璐, 等. 高糖高脂飼料喂養(yǎng)時(shí)間對(duì)建立妊娠期糖尿病小鼠模型的影響[J]. 衛(wèi)生研究, 2018, 47(1): 128–133.
[22] DONGIOVANNI P, RUSCICA M, RAMETTA R, et al. Dietary iron overload induces visceral adipose tissue insulin resistance[J]. Am J Pathol, 2013, 182(6): 2254–2263.
[23] HE M, JIANG J, LIU S, et al. Effect of iron supplementation on glucose transporter 4 expression in adipose tissue and skeletal muscle of pregnant rats[J]. OJOG, 2013, 3(6): 500–507.
[24] DONGIOVANNI P, VALENTI L, LUDOVICA FRACANZANI A, et al. Iron depletion by deferoxamine up-regulates glucose uptake and insulin signaling in hepatoma cells and in rat liver[J]. Am J Pathol, 2008, 172(3): 738–747.
[25] YARIBEVGI H, SATHVAPALAN T, ATKIN S L, et al. Molecular mechanisms linking oxidative stress and diabetesmellitus[J]. Oxid Med Cell Longev, 2020, 2020: 8609213.
[26] LIANG D, MINIKES A M, JIANG X. Ferroptosis at the intersection of lipid metabolism and cellular signaling[J]. Mol Cell, 2022, 82(12): 2215–2227.
[27] BACKE M B, MOEN I W, ELLERVIK C, et al. Iron regulation of pancreatic beta-cell functions and oxidative stress[J]. Annu Rev Nutr, 2016, 36: 241–273.
Effects of excessive iron intake on glucose metabolism and liver oxidative damage in pregnant mice
Department of Obstetrics, the Fourth Affiliated Hospital of Harbin Medical University, Harbin 150001, Heilongjiang, China
To investigate the effects of excessive iron intake on glucose metabolism and liver oxidative damage in pregnant mice.After two weeks of adaptation, twenty-eight SPF C57BL/6 female mice were divided into control group (ND group), low-dose iron supplement group (LD group), medium-dose iron supplement group (MD group) and high-dose iron supplement group (HD group) by block randomization based on body weight, the iron content was 35mg/kg, 175mg/kg, 350mg/kg and 525mg/kg, respectively. After two weeks of feeding, the male and female were in the same cage at a rate of 3∶1. Fasting blood glucose (FBG) was measured at 0d, 6d, 12d and 18d after pregnancy. Oral glucose tolerance test (OGTT) was performed at 17d after pregnancy. The level of serum fasting insulin (FINS) was measured and homeostasis model assessment of insulin resistance (HOMA-IR) was calculated at 17 d after pregnancy. The content of total iron ions, the concentration of malondialdehyde (MDA) and the activity of total superoxide dismutase (T-SOD) in liver were measured.The content of total iron ions of liver were significantly higher in HD group, and MD group than those in ND group (<0.05). There were no significant differences in the FBG between HD group, MD group, LD group and ND group at 0d, 6d, 12d, 18d after pregnancy. The blood glucose concentration of HD group was significantly higher than that of ND group at 30min, 60min after taking sugar (<0.05); FINS and HOMA-IR in HD group was significantly higher than those in ND group (<0.05). The content of MDA in liver of HD group, MD group and LD group was significantly higher than those of ND group (<0.05); however, only the activity of T-SOD in HD group was significantly lower than that in ND group (<0.05).Dietary supplementation of medium and high doses of iron before and during pregnancy can significantly increase iron storage in liver of mice, however, only high doses of iron supplementation can lead to a certain degree of oxidative damage to the liver of pregnant mice, as well as insulin resistance, hyperinsulinemia and impaired glucose tolerance.
Mice; Iron excess; Pregnancy; Glucose metabolism; Oxidative stress
R714
A
10.3969/j.issn.1673-9701.2023.29.016
蔡雁,電子信箱:caiyan318@126.com
(2022–12–19)
(2023–09–02)

