凋亡蛋白Caspase-9/Caspase-3在慢性間歇性低氧模型小鼠肝損傷中的作用
余孝海 劉國瑩 鐘明奎
摘要:目的探索凋亡蛋白Caspase-9/Caspase-3在慢性間歇性低氧模型小鼠肝損傷中的作用。方法將雄性C57小鼠隨機分為正常氧對照組(Sham)、慢性間歇性低氧組(CIH),CIH組小鼠放入低氧倉進行間歇性低氧處理(8 h/d,連續28d)。4周后HE 染色顯微鏡下觀察肝部病理形態學改變,比較兩組小鼠血清指標白介素-1(IL-1)、白介素-6(IL-6)、谷丙轉氨酶(ALT)、谷草轉氨酶(AST)水平。用Western blot檢測小鼠肝組織中凋亡蛋白Caspase3 和Caspase9的水平。結果與Sham組相比,CIH組肝組織形態學病理改變受損嚴重,白介素-1(IL-1)、白介素-6(IL-6)、谷丙轉氨酶(ALT)、谷草轉氨酶(AST)水平顯著升高;凋亡蛋白Caspase3 和Caspase9的表達上調。結論慢性間歇性低氧引起肝損傷,機制可能與凋亡蛋白上調相關。
關鍵詞:慢性間歇性低氧,肝損傷,凋亡蛋白
中圖分類號:R531.8
文獻標識碼:A
文章編號:1674-9545(2023)03-0102-(05)
DOI:10.19717/j.cnki.jjun.2023.03.019
間歇性低氧(chronicinter—mittent hypoxia,C1H)是阻塞性睡眠呼吸暫停綜合征(obstructive sleep apnea syndrome,OSAS)最為典型的病理生理特征,OSAS可以引起代謝綜合征損傷多種器官[1]。氧化應激是指體內活性氧(reactive oxygen species,ROS)與抗氧化劑和活性氮之間的一種動態平衡被打破。缺血再灌注模型可以模擬OSAS患者睡眠中反復出現的缺氧-復氧損傷,缺氧-復氧破壞了患者體內抗氧化劑和促氧化劑平衡系統,體內過量產生ROS,從而導致過氧化損傷[2]。缺氧還可以造成引起慢性炎癥,慢性炎癥也是OSAS重要的病理生理學特征。OSAS引起的CIH在體內可過量產生ROS,ROS的過度激活主要是兩方面參與機體調節,一方面參與體內氧化應激反應,另一方面可以作為第二信使,可以激活低氧誘導因子-1α和核因子kB(Nuclear Factor-kB ,NF-kB)等核轉錄因子,NF-k B通路是比較常見的炎癥信號通路,同時可以使白介素IL-6(interleukin-6,IL-6)和腫瘤壞死因子TNF-α(Tumor Necrosis Factor-α,TNF-α)活化,引發炎癥反應[3,4]。 同時有研究顯示,CIH可以促進非酒精性肝病(nonalcoholic fatty liverdisease,NAFLD)患者的病情變化,從脂肪肝不斷進展為肝硬化、甚至是肝癌。即使是沒有伴隨NAFLD大鼠,CIH也可通過促進一系列炎癥反應,從而調控炎癥因子活性,一定程度造成肝損傷[5-6]。氧化損傷與細胞凋亡有很大關系,氧化損傷是導致肝損傷的原因之一。該研究目的是建立慢性間歇性低氧模型,觀察慢性間歇性低氧時凋亡蛋白在肝臟損傷中的作用,探討慢性間歇性低氧模型(CIH)小鼠對肝損傷機制。
1.1 材料
1.1.1 動物 實驗動物清潔級雄性C57小鼠,(n=16,體重=27±4g),由安徽長臨河醫藥科技有限公司,按照安徽醫科大學實驗動物保護條例執行,并嚴格遵守,合格證號 Scxk(皖)2017-001。實驗小鼠被養在標準籠中,每籠不超過8只,12 h暗光循環保證晝夜節律,飼養期間不干預小鼠進食和飲水,動物房環境保持良好的通風和溫濕度條件。自由進水和實物充分,室內溫度保持18~25℃,小鼠的使用嚴格執行《中華人民共和國實驗動物管理條例》。
1.1.2儀器 測氧儀(CYS-1型,購自南京新飛分析儀器公司);液氮罐(醫用,成都金鳳液氮容器有限公司);酶標儀(南京德鐵實驗公司)。
1.1.3 試劑 壓縮氧氣(濃度大于99. 9%) 、壓縮氮氣(濃度大于99. 99% ,高純氮氣) 都是由合肥市醫用氧氣廠提供;谷丙轉氨酶(glutamie-pyruvic transaminase,ALT)(長春匯力公司)、谷草轉氨酶(glutamic-Oxalacetie transaminase AST);(長春匯力公司);Caspase3 antibody、Caspase9 antibody(博奧森生物技術有限公司)。白介素-l(interleukin-1,IL-1),白介素-6(interleukin-6,IL-6)(北方生物公司)。
1.2方法
1.2.1慢性間歇性低氧模型的制備和分組 小鼠在飼養一周后進行實驗,隨機分成Sham組、CIH組,每組均為8只。該實驗的原理是利用氮氣稀釋原理,對照該實驗室先前的造模方法,將實驗組小鼠輕輕放入含有測氧儀探頭的低氧艙內,實時顯示數據,通過測氧儀探頭監測氧濃度,通過兩個旋鈕調節氧氣和氮氣氣體流量,氧濃度始終控制在6~21%范圍內。氧氣和氮氣由兩個旋鈕閥門控制,一個循環時間為9 min,先充入氮氣4 min ,使低氧艙內的氧濃度下降到約6% ,保持約 40 s ;隨即充入氧氣5 min ,氧濃度恢復至最高約21%,保持約 40 s,循環往復周期,每天8 h( 9∶00 am~5∶00 pm) 共28d。造模第28d之后,將小鼠處死,進行下一步實驗。
1.2.2體重的測定 低氧模型制備完成之后,首先進行小鼠體重測量。
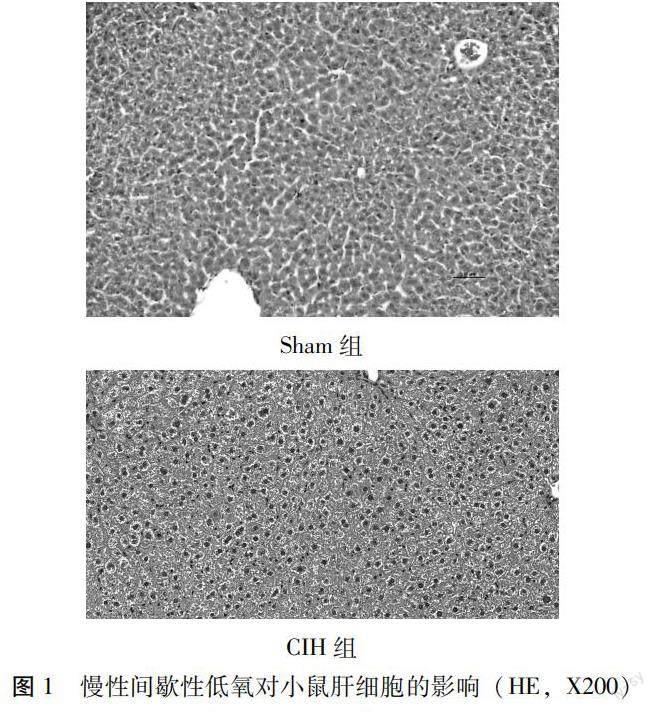
1.2.3 組織學觀察小鼠的肝臟 小鼠的肝組織被清水洗滌之后,用濾紙包裹吸干,多聚甲醛對其進行沖洗,同時準備含有多聚甲醛溶液的試管,在其中固定,實驗室脫水機脫水之后,石蠟包埋技術將肝組織包埋成蠟塊以備后期觀察,將肝臟蠟塊標本切成4μm 薄片,隨即放入溫水中任其自由展開,展開后用載玻片撈出,放入90℃烘烤箱中,約20 min后進行脫蠟,準備染色并封片,用光學顯微鏡下放大200倍觀察肝臟部病理改變,同時截圖留存。
1.2.4 血清指標的檢測 實驗結束后,采用眼球取血,提前加入抗凝劑,離心后提取血清,ALT和AST水平采用化學法測定,放射免疫分析法檢測測定IL-1、IL-6水平,具體操作參照相應試劑盒說明。
1.2.5 小鼠肝臟凋亡蛋白的測定 小鼠處死后,在冰盤上取出肝臟,取適量肝臟組織與對應劑量的RIPA裂解液在研缽器中充分研磨,裂解液的成分為:150 mol/L NaCl、50 mol/L Tris·base、1% NP-40、50 mol/L NaF、1% PMSF,充分研磨成勻漿后,放在4℃冰箱里,10min離心,用槍頭提取上清液,分別裝于準備好的EP管中,臨時保存于-20℃冰箱中。
1.4統計學處理 實驗結果x-±s表示,用SPSS 26.0軟件對數據做統計分析兩組之間的比較采用配對t檢驗,多組之間的比較選用單因素方差分析(ANOVA),p<0.05為差異有統計學意義。
2結果
2.1慢性間歇性低氧對小鼠肝細胞結構的影響 正常組在顯微鏡下肝臟組織細胞形態正常,排列整齊,大小規整,細胞無明顯變性及壞死情況。顯微鏡下低氧組肝臟組織中肝細胞腫大及空泡化明顯,細胞排列紊亂無序,有細胞出現變性及壞死,有炎癥細胞聚集現象。
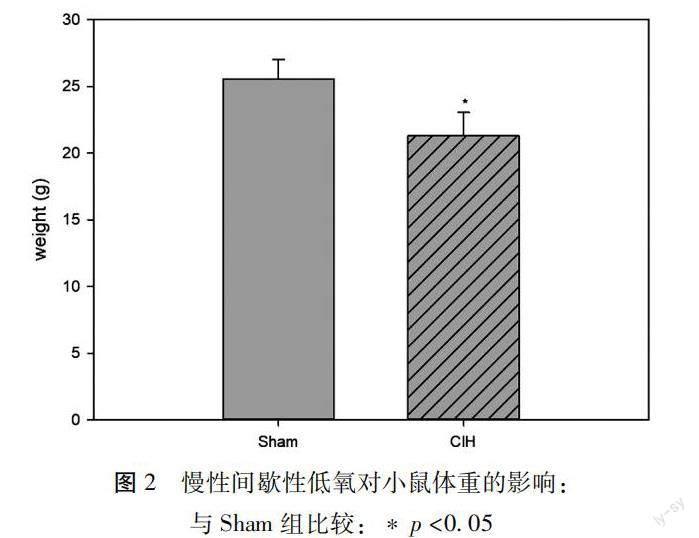
2.2慢性間歇性低氧對小鼠體重的影響 與Sham組相比,間歇性低氧28d后,CIH組小鼠體重[(25.53±1.49)vs(21.28±1.77),p< 0.05,]明顯減輕,見圖 2。
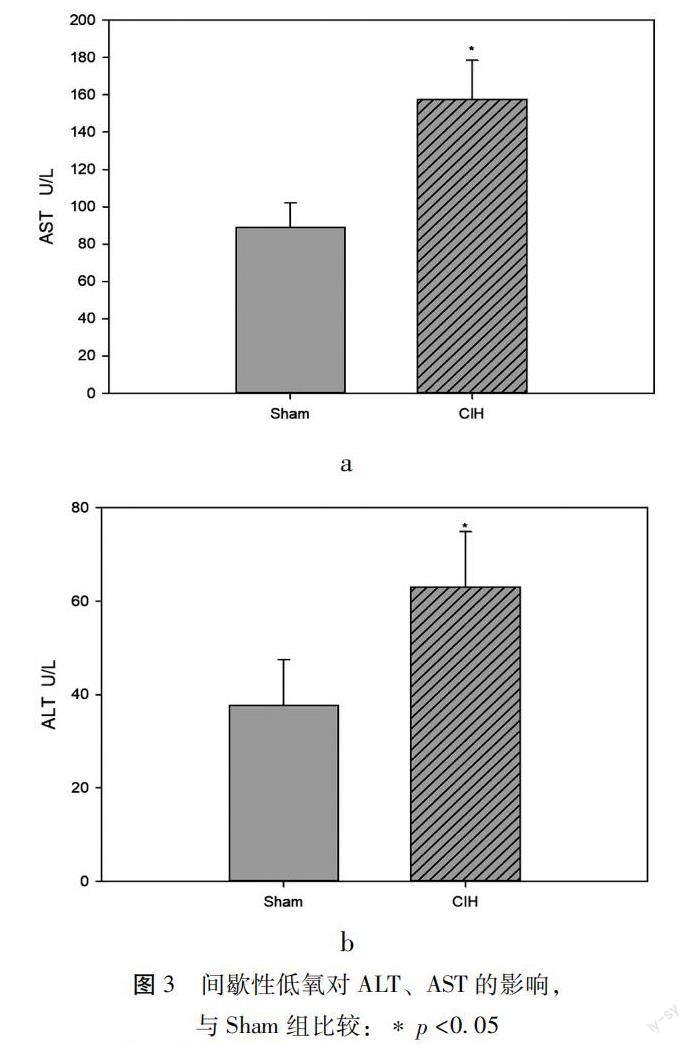
2.3慢性間歇性低氧對小鼠肝臟生化血清指標的影響 肝臟生化血清指標顯示CIH組ALT水平[(37.63±9.89)vs(63.06±11.79),p<0.05],AST水平[(88.74±13.56)vs(157.56±20.96),p<0.05]顯著高于Sham組,見圖3。
2.4 慢性間歇性低氧對凋亡蛋白的影響 與Sham組相比,間歇性低氧28d后,CIH組凋亡蛋白Caspase-3 和Caspase-9的蛋白表達上調,見圖4。
2.5 慢性間歇性低氧對小鼠肝臟生化血清指標IL-1、IL-6的變化
血清指標顯示CIH組IL-1水平[(94.13±24.07)vs(134.06±21.02),p<0.05],IL-6水平[(61.99±7.66)vs(140.06±20.30),p<0.05]顯著高于Sham組,見圖5。
3討論
OSAS以CIH最為典型病理生理學特征之一,是一種危險性比較高的疾病類型,OSAS可引起高血壓、糖尿病和代謝綜合征等多種疾病。根據最新研究調查顯示:大概35~45%的肥胖患者伴有OSAS,超過4%的普通人群也患有OSAS[7]。實驗發現經過間歇性低氧處理28 d后,CIH組肝臟組織中肝細胞腫大及空泡化明顯,細胞排列紊亂無序,有細胞出現變性及壞死,有炎癥細胞聚集現象,顯微鏡下CIH組肝組織形態學病理改變受損嚴重,白介素-1(IL-1)、白介素-6(IL-6)、谷丙轉氨酶(ALT)、谷草轉氨酶(AST)水平顯著升高;凋亡蛋白Caspase3 和Caspase9的表達上調,結果提示慢性間歇性低氧引起肝損傷,機制可能與凋亡蛋白上調相關。間歇性低氧一段時間后小鼠體重降低,由于低氧環境對小鼠產生應激反應,小鼠減少攝食,導致體重減輕。有關文獻研究發現:間歇性缺氧可通過誘導脂代謝紊亂導致脂肪肝的發生,脂代謝紊亂導致脂肪肝的發生同低氧水平呈正相關[8-9]。CIH的最典型特征是機體不斷發生的血氧去飽和,同時ROS產生的重要來源也可以是組織氧利用度的振蕩不斷變化,機體在過氧化物與抗氧化物的相互失衡可產生過量的ROS,ROS的產生引起氧化應激反應,氧化應激可通過DNA損傷、細胞功能障礙、誘導凋亡、信號通路的激活等一系列途徑加重肝損傷。細胞內線粒體作為維持細胞基本功能的關鍵細胞器,很容易不同程度上受到氧化應激的影響,線粒體功能異常會進一步促進內源性的 ROS 產生[10],氧化損傷與細胞凋亡有很大關系,氧化損傷與肝損傷密切相關,Caspase-9是誘導細胞凋亡經過線粒體途徑的主要指標之一,Caspase-9被激活后促進慢性間歇性低氧誘導肝細胞凋亡,Caspase-3在各種凋亡方式中扮演了執行小分子,所以它被認為是細胞凋亡的標志,同時Caspase-9被激活后引起一系列反應,下游Caspase-3被激活,通過線粒體途徑誘導細胞凋亡,從而導致肝損傷[11-13]。OSAS對肝臟的損傷主要是病理性改變,表現為肝臟出現不同程度的損傷、炎癥、纖維化等[14]。HIF是在缺氧情況下機體內重要轉錄因子,分為α亞基和β亞基,α亞在低氧環境下,一般結構穩定,而在常氧環境下不穩定而降解,與β亞基結合而發揮相應作用,缺氧時,由于HIF-1αm RNA表達增加,增加HIF-1α活性及相關蛋白穩定性,重新獲得氧氣后HIF-1α蛋白降解,HIF-1α和其結合序列多種基因作用來完成細胞缺氧反應性的調節[15]。
細胞發生凋亡的過程中,有Caspase依賴機制,也有非Caspase依賴機制。陳素艷等[16]對缺血再灌注模型取樣后,檢測腦組織凋亡相關蛋白Caspase-9和Caspase-3m RNA水平,提示凋亡蛋白Caspase-9和Caspase-3 m RNA的水平上調在48 h達到頂值,然后不斷下降,研究表明缺血再灌注模型大鼠神經損傷與凋亡蛋白上調密切相關,凋亡蛋白Caspase是凋亡中重要的分子。本研究發現,小鼠慢性間歇性低氧28 d后,間歇性低氧組肝組織形態學病理改變受損嚴重,白介素-1(IL-1)、白介素-6(IL-6)、谷丙轉氨酶(ALT)、谷草轉氨酶(AST)水平顯著升高,凋亡蛋白Caspase3 和Caspase9的表達上調,提示慢性間歇性低氧引起肝損傷,機制可能與凋亡蛋白上調相關。凋亡蛋白Caspase3 和Caspase9可能參與慢性間歇性低氧引起肝損傷。
參考文獻:
[1]Liu JN,Zhang JX,Lu G,et al.The effect of oxidative stress in myocardial cell injury in mice exposed to chronic in—termittent hypoxia[J].ChinMedJ,2010,123(1):74.
[2]Lavie L. Oxidative stress in obstructive sleep apnea and intermittent hypoxia-revisited-the bad ugly and good: implications to the heart and brain[J]. Sleep medicine reviews, 2015,20(3):27.
[3]Meléndez GC, Mc Larty JL, Levick SP, et al. Interleukin 6 mediates myocardial fibrosis, concentric hypertrophy, and diastolic dysfunction in rats[J]. Hypertension (Dallas, Tex. : 1979), 2010,56(2):225.
[4]Zhao L, Cheng G, Jin R, et al. Deletion of Interleukin-6 Attenuates Pressure Overload-Induced Left Ventricular Hypertrophy and Dysfunction[J]. Circulation research, 2016,118(12):1918.
[5]張香紅.間歇性低氧誘導大鼠心肌損傷及依達拉奉的干預作用[D].蘭州:蘭州大學,2021.
[6]Paschetta E,Belci P,A1isi A,et a1.OSAS-related infla-matory mechanisms of liver injury in nonalcoholic fatty liverdisease[J].Mediators Inflamm,2015,20(5):815721.
[7]楊勝昌,陳玲玲,傅天,等. 氫氣對慢性間歇性低氧大鼠肝臟氧化應激損傷的改善作用[J].中國應用生理學雜志, 2018,34(1);61.
[8]Karkinski D,Georgievski O,Dzekova-Vidimliski P,et a1.Obstructive Sleep Apnea and Lipid Abnormalities[J].Open Access Maced J Med Sci,2017,5(1):19.
[9]范風云,沈婉婷,鄭青青,等. 低氧性肺動脈高壓小鼠體內脂質水平的變化[J].中國應用生理學雜志,2016,32(5):463.
[10]Han D, Gu X, Gao J, et al. Chlorogenic acid promotes the Nrf2/HO-1 anti-oxidative pathway by activating p21(Waf1/Cip1) to resist dexamethasone-induced apoptosis in osteoblastic cells [J]. Free radical biology & medicine, 2019, 137(6): 1.
[11]Wasilewski m,Scorrano L.The changing shape of mitochondrial apoptosis[J].Trends in Endocrino logy and Metabolism,2009,20(6):287.
[12]孫琳,李俠,趙玉軍.細胞凋亡機制在無機汞致腎臟損害中作用的研究進展[J].工業衛生與職業病,2020,46(4):341.
[13]Wu P B,Song Q,Yu YJ,et al.Effect of metformin on mitochondrial pathway of apoptosis and oxidative stress in cell model of nonalcoholic fatty liver disease[J].Chinese Journal of Hepatology,2020, 28(1):64.
[14]馬克. TGR5在膽鹽引起的肝內膽管結石病肝內膽管纖維化中的作用及機制初探[D].遵義:遵義醫科大學,2022.
[15]Wenger RH.Cellular adaptation to hypoxia:O2-sensing proteinhydroxylases,hypoxia-inducible transcription factors,and O2-regulated gene expression[J].FASEB J,2002,16(3):1151.
[16]陳素艷,張振香,高峰,等.常壓氧療對大鼠腦缺血再灌注后腦組織Caspase-9及Caspase-3 m RNA表達的影響[J].鄭州大學學報(醫學版),2014,49(2):203.
(責任編輯 胡安娜)

