人呼吸道合胞體病毒感染細胞中長鏈非編碼RNA差異表達情況觀察及生物學功能分析
歐陽靜, 彭 雙, 譚英征, 周 慧
1.株洲市中心醫院 感染內科,湖南 株洲 412000;2.株洲愷德心血管病醫院 神經內科,湖南 株洲 412000
人呼吸道合胞體病毒(human respiratory syncytial virus,RSV)是由單股負鏈RNA構成的一種肺炎病毒科病毒,是導致嬰幼兒、老年人及免疫缺陷患者發生下呼吸道感染的重要病因,該病毒感染后容易導致患者出現支氣管或肺功能發生改變,嚴重影響患者生命健康[1]。在病毒感染過程中,宿主細胞可以通過模式識別受體對病毒相關分子模式進行監測,然后啟動天然免疫反應,并通過分泌產生干擾素等細胞因子殺滅病毒,但RSV能通過多種免疫逃逸機制產生細胞感染和遺傳物質復制[2-3]。長鏈非編碼RNA(long non-coding RNAs,lncRNA)不具備蛋白質編碼功能,但能調控基因表達,從轉錄及轉錄后調控、表觀遺傳學等方面調節基因表達過程[4]。本研究旨在觀察RSV感染的A549細胞中lncRNA的差異表達情況,并分析其生物學功能,以期為從lncRNA角度認識RSV及其與A549宿主細胞之間的相互作用提供參考。現報道如下。
1 材料與方法
1.1 細胞培養與病毒感染 人肺部細胞系A549、Calu-1、HCC827、MRC-5、HFL1細胞購自尚恩生物,采用DMEM培養液(美國Gibco)進行細胞培養,加入含10%胎牛血清(fetal bovine serum,FBS),置于37℃、5%CO2培養箱中培養,當人肺部細胞系生長至80%密度,PBS洗滌3次,采用感染復數為1的RSV感染肺部細胞系,1 h后加入DMEM維持液(含2% FBS),繼續放置于37℃、5%CO2培養箱中培養。
1.2 RNA提取及lncRNA基因芯片檢測 RSV感染A549細胞24 h后,提取總RNA,采用NanoDropND-1000(美國Thermo)檢測總RNA濃度,并采用瓊脂糖凝膠電泳對RNA完整性進行檢測。然后采用Agilent lncRNA Human Gene Expression Microarray version基因芯片檢測lncRNA表達譜,采用Agilent Feature Extraction software進行圖像分析。當P<0.05且相對表達量變化倍數>2時,認為lncRNA存在顯著差異,然后采用Cluster 3.0繼續進行層次聚類分析。
1.3 lncRNA靶基因的GO和KEGG功能富集分析 對存在差異表達的lncRNA相關靶基因進行GO和KEGG Pathway富集分析,分析lncRNA靶基因可能參與的細胞通路及潛在疾病類型、生物學功能。
1.4 實時熒光定量聚合酶鏈反應法驗證 將RSV接種于人肺部細胞系并發生感染24 h后對細胞進行收集處理,加入TRIzol試劑將細胞完全裂解,然后使用Prime Script RT reagent Kit反轉錄試劑盒將總RNA進行反轉錄。聚合酶鏈反應條件:95℃ 15 min,95℃ 15 s,60℃ 20 s,連續循環40次。最后均采用2-△△ct計算lncRNA相對表達量。
2 結果
2.1 RSV感染A549細胞后的lncRNA差異表達 A549細胞感染RSV后共計2 415個lncRNA發生差異表達,包括1 453個上調lncRNA和962個下調lncRNA,前10個上調和下調最顯著的lncRNA見表1。其中,上調和下調最多的lncRNA分別為ENST00000607613.1[差異倍數(fold change,FC)=165.687]和ENST00000520156.1(FC=23.562)。RSV感染A549細胞后的lncRNA差異表達整體分布火山圖和聚類分析見圖1和圖2。
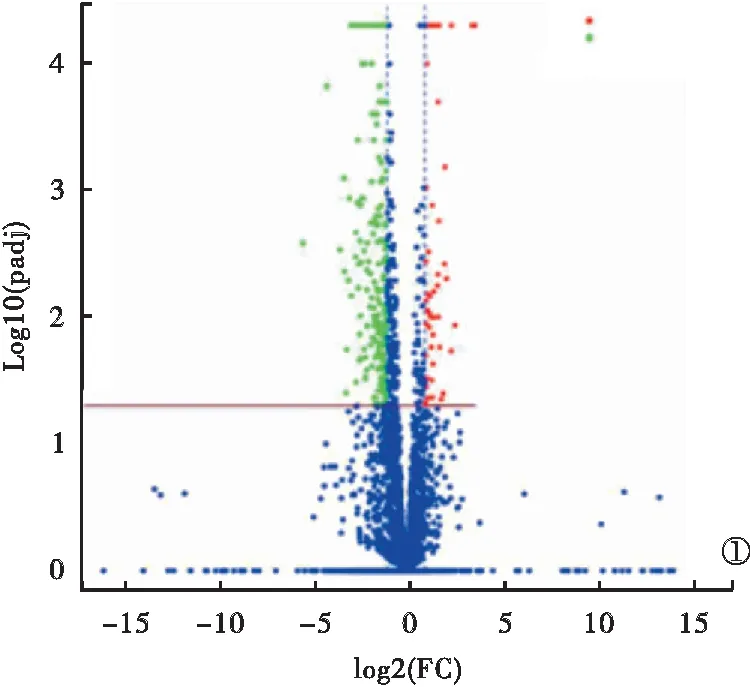
圖1 RSV感染A549細胞后的lncRNA差異表達整體分布火山圖(藍點代表非顯著差異表達的lncRNA,紅點、綠點分別表示發生上調、下調且存在顯著表達差異的lncRNA)

圖2 RSV感染A549細胞后的lncRNA差異表達聚類分析(紅色、綠色分別表示發生上調、下調且存在顯著表達差異的lncRNA)

表1 RSV感染A549細胞后的lncRNA上調和下調表達結果
2.2 GO和KEGG富集分析 GO富集分析顯示,差異表達的lncRNA調控靶基因主要與干擾素(Ⅰ型)信號轉導、宿主抗病毒反應、病毒基因組復制的負調控等免疫反應生物學過程高度相關。進一步的pathway富集分析結果顯示,差異表達的lncRNA主要調控干擾素信號轉導途徑、免疫及炎癥等信號通路。差異表達lncRNA調控的mRNA靶基因的GO功能富集結果和KEGG功能富集結果見圖3和圖4。
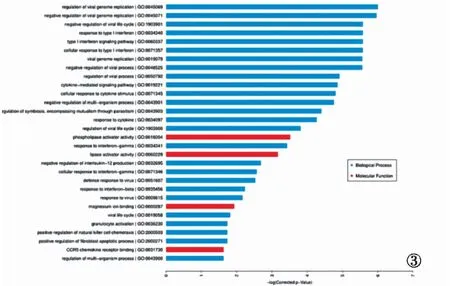
圖3 差異表達lncRNA調控的mRNA靶基因的GO功能富集結果
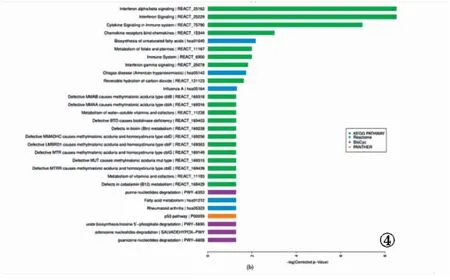
圖4 差異表達lncRNA調控的mRNA靶基因的KEGG功能富集結果
2.3 實時熒光定量聚合酶鏈反應驗證分析 生物信息學分析結果顯示,18種lncRNA(P17101、P7539、P8209、P25918、P38638-v4、P8612、P8610、P34527-v4、P6011、P4480、P13713、殖及干擾素調節過程具有高度相關性。提取RSV感染的A549細胞RNA并進行實時熒光定量聚合酶鏈反應驗證發現,18種lncRNA相對表達水平分析結果與表達譜數據一致。見圖5。在人肺部細胞Calu-1、HCC827、MRC-5、HFL1中18種lncRNA相對表達水平的上升或下降與A549細胞一致。見圖6。
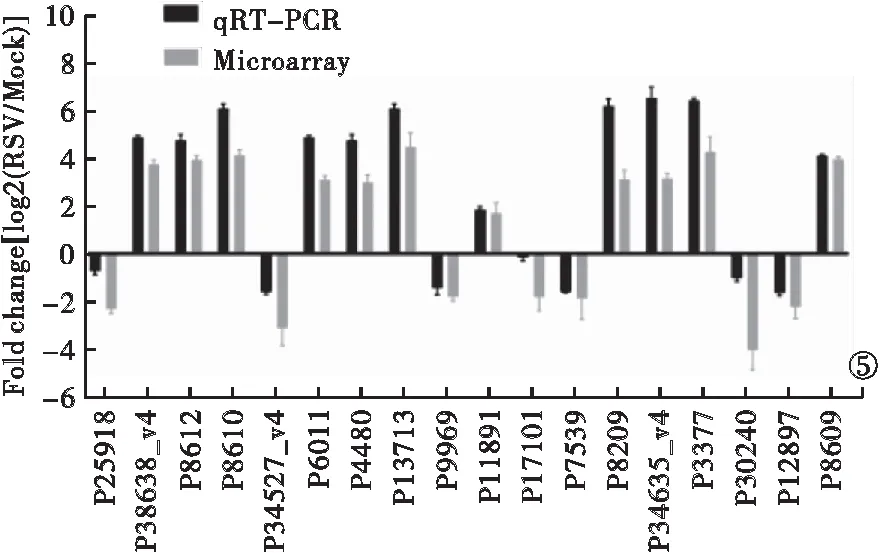
圖5 18種顯著差異表達lncRNA的實時熒光定量聚合酶鏈反應驗證結果
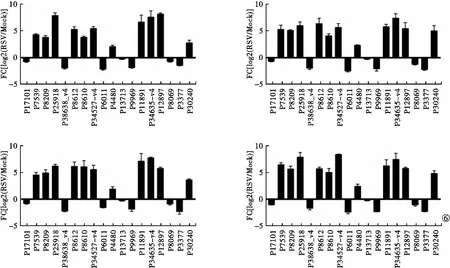
圖6 18種顯著差異表達lncRNA在其他人肺部細胞的實時熒光定量聚合酶鏈反應驗證結果
P9969、P11891、P34635-v4、P12897、P8069、P3377、P30240)存在顯著差異表達,且上述存在差異表達的lncRNA與RSV繁
3 討論
在RSV感染宿主細胞過程中發生著廣泛的蛋白質組學和轉錄組學的變化,上述變化直接或間接介導并參與宿主對RSV感染的適應性免疫反應和固有免疫反應;同時,RSV可以通過黏膜糖蛋白、融合糖蛋白、基質蛋白和非結構蛋白(nonstructural protein,NS)等多種方式和途徑規避宿主對其產生的應激反應[5-6]。RSV與宿主之間的相互作用對于抗RSV藥物以及相關疫苗的開發具有關鍵性的指導意義,但既往研究中關于兩者之間的相互作用更多集中于RSV與宿主蛋白質的相互關系[7],關于RSV與宿主之間的相互作用尚且需要進一步深入研究。
lncRNA作為非編碼RNA分子,在基因重組、蛋白質轉錄和翻譯等生理過程中發揮重要作用,與多種疾病密切相關[8-9],特別是lncRNA的異常表達是導致疾病發生和發展的重要原因。有研究證實,lncRNA在皰疹病毒等DNA病毒、乙肝病毒等RNA病毒與宿主之間的相互作用中發揮重要調控作用[10]。當RSV感染宿主細胞后,宿主細胞lncRNA表達水平可發生差異化表達,進而通過調控特異性蛋白的編碼基因而干擾病毒復制過程。本研究結果顯示:A549細胞感染RSV后共計2 415個lncRNA發生差異表達,包括1 453個上調lncRNA和962個下調lncRNA,其中,上調和下調最多的lncRNA分別為ENST00000607613.1(FC=165.687)和ENST00000520156.1(FC=23.562);進一步的生物信息學分析結果證實,上述差異表達的lncRNA主要調控干擾素信號轉導途徑、免疫及炎癥等信號通路,且上述結果經實時熒光定量聚合酶鏈反應驗證得以證實;GO和KEGG功能富集分析發現,差異化表達的lncRNA主要富集在宿主抗病毒反應、干擾素(Ⅰ型)信號轉導、病毒基因組復制的負調控等免疫反應生物學過程。這提示,在RSV感染A549細胞后,免疫反應相關基因在病毒感染及拮抗反應過程中發揮關鍵作用。關于lncRNA在細胞中功能的發揮,邵冰等[11]研究發現,mRNA和lncRNA均可作為競爭性內源性RNA,與miRNA位點結合,從而相互調節,進而推測lncRNA也可能通過內源競爭性方式調控相關基因表達。多項研究證實,RSV NS1和NS2能夠通過降低腫瘤壞死因子受體相關因子3蛋白表達量發揮Ⅰ型干擾素分泌抑制作用[12-13]。劉美琴等[14]通過采用互補siRNA對A549細胞中的lncRNA P3377和P8610進行敲低研究發現,RSV感染的A549細胞中的BST2和OAS2靶基因表達量明顯降低,表明lncRNA P3377對靶基因OAS2和BST2存在明顯正向調節功能,進而抑制RSV復制,發揮宿主抗病毒抑制作用。
綜上所述,RSV感染A549細胞后,lncRNA表達譜產生顯著變化,差異化表達的lncRNA主要通過炎癥反應和干擾素信號轉導途徑參與細胞對病毒感染的反應調控過程。

