細胞毒性T淋巴細胞來源外泌體抑制肝星狀細胞活化的機制
覃川福, 趙雅麗, 龍麗娟, 邱華
1 廣西醫(yī)科大學附屬腫瘤醫(yī)院中醫(yī)科, 南寧 530021; 2 廣西醫(yī)科大學第一臨床醫(yī)學院, 南寧 530021
肝纖維化是一種以肝組織中胞外基質(zhì)(ECM)過多為特征的慢性肝損傷,由多種因素引起,包括病毒性肝炎、藥物和自身免疫性疾病[1]。目前在我國其主要病因仍是HBV感染。最新流行病學調(diào)查顯示,我國慢性HBV感染者約存7 000萬例,其中慢性乙型肝炎(CHB)患者為2 000萬~3 000萬例。如未得到有效治療由CHB進展至肝纖維化、肝硬化的5年累積發(fā)生率可達12%~25%,肝硬化進展至肝衰竭或肝細胞癌(HCC)的5年累積發(fā)生率分別達20%~30%和6%~15%[2-3]。因此,深入探索乙型肝炎肝纖維化的機制,尋找有效的防治方法,具有重大意義。HBV感染并不能直接導致肝細胞病變,研究者們普遍認為機體的病理損傷和病程轉(zhuǎn)歸主要與病毒入侵后引發(fā)的機體免疫應(yīng)答有關(guān),針對HBV抗原的免疫應(yīng)答強度決定了疾病最終的轉(zhuǎn)歸[4],其中細胞毒性T淋巴細胞(CTL)是清除HBV的決定性力量,并發(fā)揮著對HBV長期免疫監(jiān)視,抑制乙型肝炎肝纖維化激活的功能[5]。而HBx蛋白在慢性乙型肝炎發(fā)生、發(fā)展中發(fā)揮著重要調(diào)控作用[6]。有研究[7]發(fā)現(xiàn)將轉(zhuǎn)染了HBx的肝細胞與肝星狀細胞(HSC)共培養(yǎng),α-SMA、膠原和TGF-β1的表達明顯增高。但CTL是否通過調(diào)控HBx蛋白表達而影響HBV復制及抑制肝纖維化未見報道。近年來,對外泌體作為細胞間物質(zhì)和信息的傳遞工具的研究越來越受關(guān)注。有研究表明,感染HBV肝細胞、HSC及CTL細胞均可分泌外泌體,并在不同層面參與了肝纖維化的調(diào)控。本研究前期已經(jīng)成功構(gòu)建含HBV全基因組1.3倍體的HepG2穩(wěn)轉(zhuǎn)細胞模型,并命名為HepGA14[8]。據(jù)此,本研究將CTL-exo加入HepGA14培養(yǎng)體系,同時將CTL-exo和HBV-exo按照不同比例進行混合后,與LX-2細胞共孵育,擬明確CTL能否通過外泌體途徑跨細胞靶向HBx抑制HSC活化,以期為乙型肝炎肝纖維化的防治提供新途徑。
1 材料和方法
1.1 材料
1.1.1 細胞系 HepG2、HepGA14、HSC-LX2和CTL細胞(上海諾百生物科技有限公司)。
1.1.2 主要試劑及藥物 DMEM培養(yǎng)液、1640培養(yǎng)液、FBS(美國Thermo Fisher Scientific公司);抗體:Anti-CD63 antibody、Anti-TSG101 antibody、Anti-Hepatitis B Virus X antigen antibody(英國Abcam公司);Anti-GAPDH(北京博奧森生物技術(shù)有限公司);HRP-conjugated Goat Anti-Mouse IgG、HRP-conjugated Goat Anti-Rabbit IgG(上海生工生物工程有限公司);氟硼二吡咯染料(美國Sigma公司);磷鎢酸(德國Merck公司);RIPA裂解液、BCA蛋白濃度測定試劑盒(上海碧云天生物技術(shù)有限公司)。
1.1.3 主要儀器設(shè)備 熒光定量PCR儀(美國Bio-Rad公司);熒光顯微鏡(日本Olympus公司);離心機(美國Beckman Coulter公司);透射電鏡(美國Thermo Fisher Scientific公司);共聚焦顯微鏡(德國Leica公司)。
1.2 方法
本研究嚴格遵循《中華人民共和國生物安全法》中“病原微生物實驗室生物安全”的相關(guān)法律規(guī)定進行管理與操作。
1.2.1 細胞培養(yǎng) (1)HepG2、HepGA14和LX-2細胞分別在含有10%胎牛血清、100 U/mL青霉素和100 μg/mL鏈霉素的高糖DMEM培養(yǎng)基中,在37 ℃、5% CO2恒溫恒濕培養(yǎng)箱中培養(yǎng)。(2)CTL系TALL-04培養(yǎng):培養(yǎng)基為1640基礎(chǔ)培養(yǎng)基,加10%FBS和1%雙抗。傳代時采用1 000 r/min離心5 min,用新鮮培養(yǎng)基重懸,再按照比例(1∶2~1∶4)傳到新皿中,培養(yǎng)至1×108個細胞量。
1.2.2 HepG2、HepGA14及CTL細胞外泌體提取與鑒定 (1)外泌體提取:培養(yǎng)HepG2及HepGA14細胞,準備80%左右密度的細胞各50皿,換成無血清培養(yǎng)液繼續(xù)培養(yǎng)48 h,分別收集細胞上清。超速離心法提取外泌體,具體步驟如下:取50 mL細胞上清,以1 000 r/min離心10 min,取上清。以3 000 r/min離心10 min,取上清。10 000×g離心30 min,取上清。在4 ℃下以100 000×g持續(xù)離心90 min,去掉上清,留下的沉淀PBS重懸后,再次以100 000×g離心90 min,取上清,同法提取CTL細胞外泌體,將獲取的外泌體分別保存?zhèn)溆谩#?)外泌體鑒定:①透射電鏡觀察外泌體形態(tài)。分別取NC-exo、HBV-exo及CTL-exo 10 μL滴于透射電鏡專用的載樣銅網(wǎng)上,常溫靜置2 min,濾紙吸去浮液,用1%(W/V)磷鎢酸溶液染色5 min后,濾紙吸去多余染色液,晾干,透射電鏡觀察外泌體結(jié)構(gòu)。②Western Blot檢測外泌體的標志物CD63和TSG101表達(以細胞裂解物為對照)。取HepGA14細胞上清,以100 000×g離心90 min后,棄上清,加入100 μL RIPA裂解液,吹打使裂解液和HBV-exo充分混合,冰上裂解30 min。4 ℃、12 000 ×g離心30 min,吸取上清液置于1.5 mL EP管中,-80 ℃凍存。BCA法檢測蛋白濃度,加入5×Loading Buffer,99 ℃變性10 min。取20 μg/孔上樣至10% SDS-PAGE膠,80 V電泳30 min,120 V電泳1 h,采用濕法轉(zhuǎn)膜,220 mA轉(zhuǎn)膜1 h,5%牛血清白蛋白室溫封閉1 h,5%牛血清白蛋白稀釋一抗CD63,4 ℃孵育一抗過夜。TBST漂洗10 min,洗滌3次,加入二抗室溫孵育1 h,加入顯影液,上機曝光。同法檢測HepG2、CTL細胞外泌體的標志物CD63和TSG101表達,以細胞裂解液為對照。
1.2.3 觀察HBV-exo能否進入且影響HSC (1)外泌體熒光標記:用工作濃度為1 μg/mL氟硼二吡咯染料(BODIPY)避光染色30 min標記肝細胞HepG2及HepGA14細胞;換成無血清細胞培養(yǎng)基繼續(xù)培養(yǎng)48 h后,收集細胞培養(yǎng)上清液,采用超速離心法提取純化外泌體(方法同1.2.2),保存?zhèn)溆谩#?)共聚焦熒光顯微鏡觀察:取LX-2細胞重懸于無血清培養(yǎng)基中,置于37 ℃、5% CO2培養(yǎng)箱中,待細胞貼壁后加入上述熒光標記的HBV-exo,孵育48 h后采用PBS洗滌細胞2次,4%多聚甲醛固定、DAPI染色。共聚焦熒光顯微鏡下觀察HBV-exo是否進入細胞。同法檢測NC-exo能否進入HSC,不加外泌體為對照(簡寫為Con)。(3)檢測HBV-exo能否影響LX-2細胞活性:①倒置顯微鏡觀察LX-2細胞形態(tài)學改變;②將NC-exo、HBV-exo分別加入到LX-2細胞培養(yǎng)體系中,同時設(shè)置兩種外泌體1∶1混合組(簡寫為NC-exo+HBV-exo),以不加外泌體為對照(簡寫為Con),37 ℃孵育48 h后,收集HSC,提取總RNA。采用實時熒光定量PCR(qPCR)檢測LX-2細胞中TGF-β1、α-SMA、Collagen1等活化生物標志物的表達水平,以actin為內(nèi)參,qPCR反應(yīng)條件:95 ℃ 2 min,95 ℃ 10 s,60 ℃ 30 s,70 ℃ 30 s,40個循環(huán),引物見表1。

表1 qPCR引物序列Table 1 Real-time PCR primer sequences
1.2.4 分析CTL細胞外泌體對HepGA14細胞的影響 (1)將CTL-exo加入到HepGA14的培養(yǎng)體系中,以不加外泌體為對照。孵育48 h分別收集HepGA14細胞(細胞依次簡寫為CTL-exo和Con)和培養(yǎng)上清(上清外泌體依次簡寫為CTL+HBV-exo和HBV-exo);用qPCR檢測HepGA14細胞內(nèi)HBV DNA和cccDNA水平,上清液提取外泌體中HBx mRNA的水平,qPCR反應(yīng)條件:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 30 s,70 ℃ 30 s,40個循環(huán);Western Blot檢測外泌體HBx蛋白水平,方法同1.2.2。(2)將CTL-exo和HBV-exo按照不同比例(2∶1、5∶1、10∶1)進行混合后,加入到LX-2細胞培養(yǎng)體系中,以單加HBV-exo為陽性對照,以不加外泌體為陰性對照(簡寫為Con),37 ℃孵育48 h后收集LX-2細胞;qPCR檢測LX-2細胞中TGF-β1、α-SMA、Collagen1等活化生物標志物的表達,方法同1.2.3。
1.3 統(tǒng)計學方法 應(yīng)用軟件SPSS 23.0進行統(tǒng)計分析,所有實驗均重復3次,符合正態(tài)分布的計量資料以表示,兩組間比較采用成組t檢驗。多組間比較用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。P<0.05為差異有統(tǒng)計學意義。
2 結(jié)果
2.1 外泌體鑒定 透射電鏡觀察可見具有雙層膜結(jié)構(gòu)的微囊,呈圓形或橢圓形,囊泡的直徑為50~100 nm,符合外泌體粒徑范圍;Western Blot檢測顯示,與相應(yīng)對照組比較,NC-exo組、HBV-exo組及CTL-exo組高表達標志蛋白CD63和TSG101(圖1)。
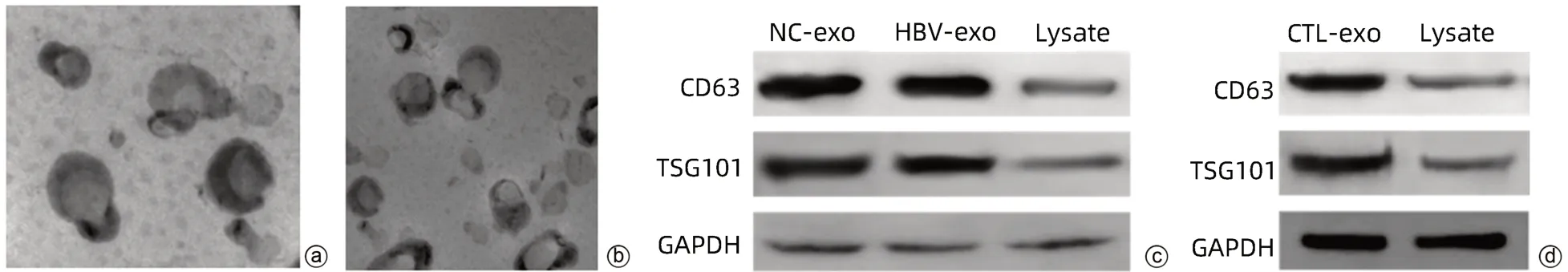
圖1 外泌體鑒定Figure 1 Exosome identification
2.2 觀察外泌體能否進入HSC及活化HSC
2.2.1 外泌體與LX-2細胞共培養(yǎng)觀察 共聚焦熒光顯微鏡下可見NC-exo、HBV-exo被HSC攝取(圖2)。
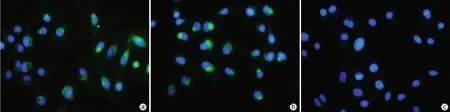
圖2 熒光顯微鏡下觀察外泌體進入LX-2細胞情況(×200)Figure 2 Observation of exosomes entering LX-2 cells under fluorescence microscopy(×200)
2.2.2 HBV-exo能否活化HSC-LX2 (1)倒置顯微鏡下可見HBV-exo進入LX-2細胞后HSC胞體增大、胞突伸展(圖3)。(2)qPCR結(jié)果示NC-exo組、NC-exo+HBV-exo組、HBV-exo組及Con組LX-2細胞中TGF-β1、α-SMA和Collagen1基因相對表達量不同,差異均有統(tǒng)計學意義(P值均<0.05)。與NC-exo組相比,NC-exo+HBV-exo組和HBV-exo組LX-2細胞中TGFβ-1、α-SMA及Collagen1基因相對表達量均顯著升高(P值均<0.05),與HBV-exo組相比,NC-exo+HBV-exo組LX-2細胞中TGFβ-1、α-SMA及Collagen1基因相對表達量均顯著降低(P值均<0.05)(表2)。
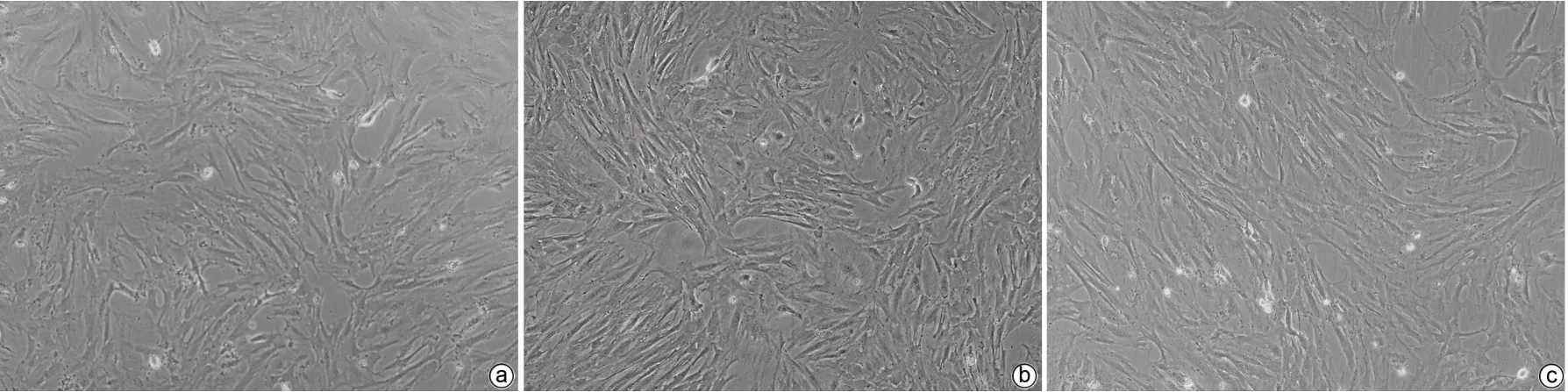
圖3 相差顯微鏡下觀察LX-2細胞形態(tài)學改變(×100)Figure 3 Observe the morphological changes of LX-2 cells by phase-contrast microscope(×100)
2.3 分析CTL細胞外泌體對HepGA14細胞的影響
2.3.1 CTL細胞外泌體對HepGA14細胞的影響qPCR檢測顯示:與對照組相比較,CTL-exo組HepGA14細胞中HBV DNA(0.30±0.01 vs 1.00±0.01,t=-85.732,P<0.05)及cccDNA(0.25±0.01 vs 1.00±0.01,t=-113.000,P<0.05)表達量均明顯下降;與HBV-exo組相比,CTL+HBV-exo組外泌體中HBx mRNA相對表達量明顯下降(0.20±0.01 vs 1.00±0.03,t=-38.105,P<0.05)。Western Blot檢測顯示:與HBV-exo組比較,CTL+HBV-exo組外泌體中HBx蛋白相對表達量明顯降低,差異有統(tǒng)計學意義(t=-13.093,P<0.05)(圖4)。
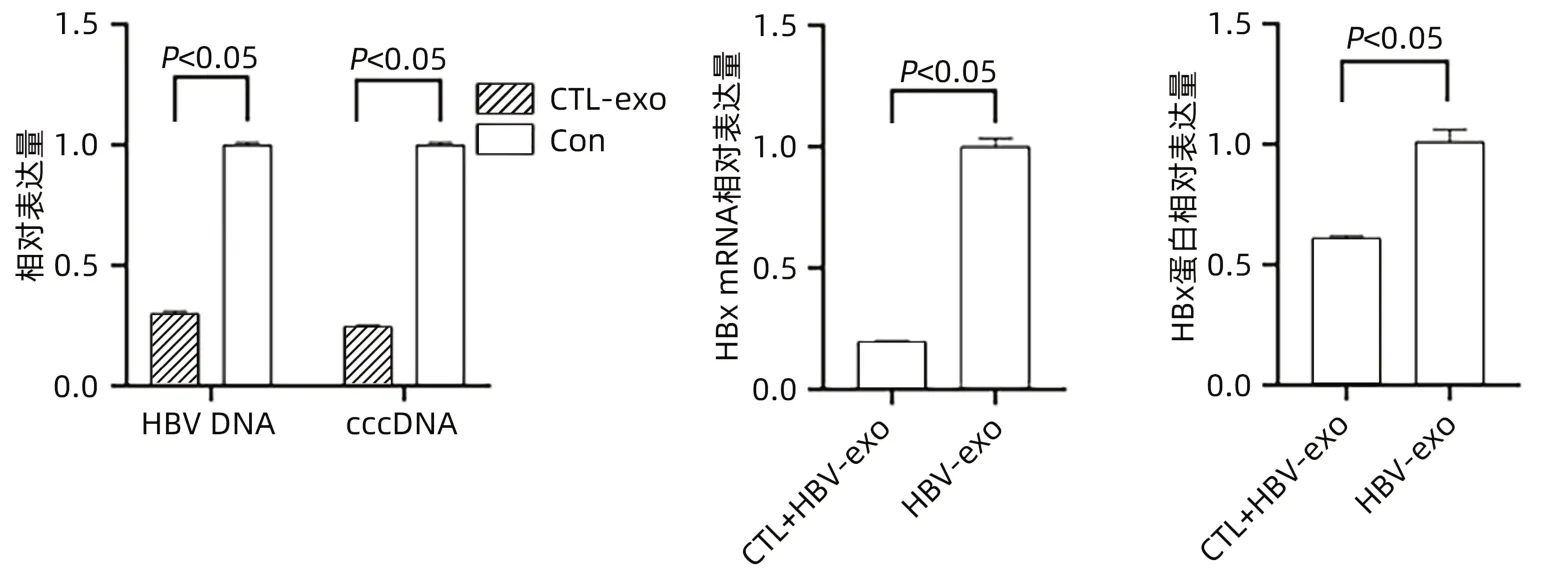
圖4 CTL-exo對HBV感染肝細胞的影響Figure 4 Effect of CTL-exo on HBV-infected hepatocytes
2.3.2 CTL細胞外泌體對HepGA14細胞外泌體活化HSC的影響 qPCR檢測顯示:HBV-exo組、CTL-exo∶HBV-exo=2∶1組、CTL-exo∶HBV-exo=5∶1組、CTL-exo∶HBV-exo=10∶1組、Con組LX-2細胞中TGF-β1、α-SMA、Collagen1基因相對表達量不同,差異均有統(tǒng)計學意義(P值均<0.05);與Con組相比,HBV-exo組、CTL-exo∶HBV-exo=2∶1組、CTL-exo∶HBV-exo=5∶1組中α-SMA、Collagen1基因表達上調(diào),差異有統(tǒng)計學意義(P值均<0.05);并且LX-2細胞中TGF-β1、α-SMA、Collagen1基因相對表達量隨著CTL-exo比例的增加而逐漸減弱(表3)。
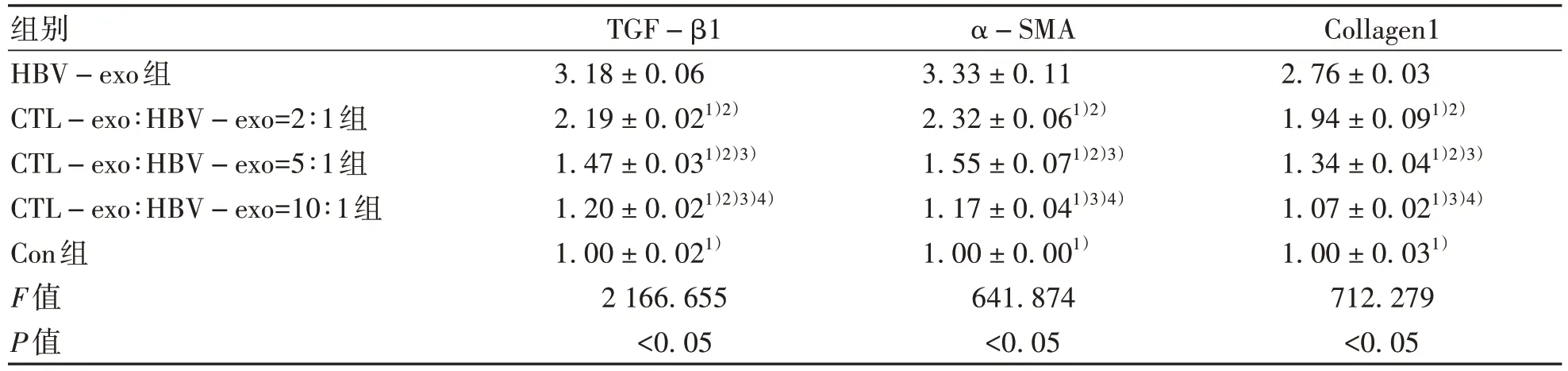
表3 不同HBV-exo、CTL-exo濃度比例干預后HSC-LX2細胞中TGF-β1、α-SMA、Collagen1的相對表達量Table 3 Relative expressions of TGF-β1, α-SMA and Collagen1 in HSC-LX2 cells after different HBV-exo and CTL-exo concentration ratios
3 討論
HBV感染呈世界性流行,是影響全球的嚴重公共衛(wèi)生問題。現(xiàn)我國由于乙型肝炎疫苗和乙型肝炎預防知識的普及,乙型肝炎新發(fā)人數(shù)有逐步下降的趨勢,但在2009—2018年的10年期間,年新發(fā)人數(shù)仍維持在100萬左右[9]。目前抗病毒病因治療是乙型肝炎的主要治療手段,主要包括核苷(酸)類似物及干擾素兩大類,通過有效抑制HBV復制使肝纖維化能獲得不同程度的改善,但不能徹底清除HBV,有部分患者仍出現(xiàn)肝纖維化及進展[10-11]。有研究[12]發(fā)現(xiàn)對于僅取得病毒學和生化學應(yīng)答的部分患者,其肝纖維化依然存在,甚至持續(xù)進展,可最終發(fā)展為肝硬化或肝癌;而對于獲得HBeAg、HBsAg血清學應(yīng)答者,肝臟炎癥及纖維化進程能獲得明顯改善,發(fā)生肝硬化和HCC的風險顯著減少。陳博武等[13]在一項隨訪長達5年包含542例患者的接受抗病毒治療的代償期乙型肝炎肝硬化患者隊列研究中,比較持續(xù)病毒學應(yīng)答隊列患者和非持續(xù)病毒學應(yīng)答隊列患者的肝癌發(fā)生率,發(fā)現(xiàn)非持續(xù)病毒學應(yīng)答隊列患者5年肝癌發(fā)生率為34.8%,持續(xù)病毒學應(yīng)答隊列患者5年肝癌發(fā)生率為20.6%,發(fā)生率明顯下降。由HBV的生命周期可知HBeAg、HBsAg血清學轉(zhuǎn)換的本質(zhì)就是獲得對cccDNA的抑制、沉默及清除[14]。這表明了免疫對HBV控制力的強弱,才是決定乙型肝炎肝纖維化是否激活與進展的關(guān)鍵因素。目前關(guān)于CTL對HBV的清除機制研究較為深入,已有研究發(fā)現(xiàn)3種抑制或清除HBV的主要途徑。其一,F(xiàn)as配體(FasL)途徑[15]:CTL可表達與Fas相結(jié)合的細胞表面蛋白FasL。當FasL與靶細胞上的Fas相互作用,通過死亡信號轉(zhuǎn)導而活化凋亡途徑,然而這種機制在清除胞漿內(nèi)HBV核衣殼和復制的HBV DNA中間體方面作用較小。其二,穿孔素和顆粒酶途徑[16]:CTL通過穿孔素和顆粒酶系統(tǒng)誘導感染HBV的肝細胞直接裂解,減少感染HBV的肝細胞數(shù)量。其三,細胞因子途徑[17]:CTL可通過釋放細胞因子TNF-α、IFN-γ等清除HBV核衣殼顆粒、復制中間體,甚至是降解轉(zhuǎn)錄模板cccDNA。這種“非殺細胞”模式不會引起細胞壞死及炎癥,是CTL清除cccDNA,實現(xiàn)乙型肝炎“治愈”,抑制肝纖維化的最主要途徑。但其調(diào)控機制尚不清楚。
外泌體是一種能被機體內(nèi)大多數(shù)細胞分泌的微小膜泡,具有脂質(zhì)雙層膜,直徑為30~150 nm,幾乎所有細胞均可分泌,并廣泛存在于各種體液中[18-20],外泌體可將參與生理或病理過程的生物分子從母體細胞轉(zhuǎn)移到受體細胞,是細胞間通訊的有效方式[21]。有研究[22]發(fā)現(xiàn)T淋巴細胞、巨噬細胞、樹突狀細胞等免疫細胞分泌的外泌體含有免疫調(diào)節(jié)成分,如IFN-α、IFN-β、ILs等,使外泌體具有抗病毒的活性。并且有研究者[23]發(fā)現(xiàn)從HBV感染者外周血血清分離出的外泌體中含有大量的病毒成分,包括HBV DNA、HBV RNA、HBsAg、HBeAg、HBx蛋白等。本研究將BODIPY標記的HBV-exo,加入HSC-LX2培養(yǎng)體系中,顯微鏡下發(fā)現(xiàn)HBV-exo能進入LX2細胞,并活化LX-2細胞,也證實了外泌體的載體作用。由此推測CTL可能通過外泌體途徑干預HBx表達、抑制HBV表達及HSC活化。
為此本研究將CTL-exo加入到HepGA14培養(yǎng)體系中,發(fā)現(xiàn)HepGA14細胞內(nèi)HBV DNA、cccDNA表達水平下降,并下調(diào)外泌體中HBx mRNA及蛋白的水平,差異具有統(tǒng)計學意義(P<0.05),表明CTL-exo可能靶向HBx抑制HBV復制。再將CTL-exo和HBV-exo按照不同比例進行混合后干預LX-2細胞,TGF-β1、α-SMA、Collagen1的表達水平也隨著CTL-exo比例的增加而逐漸減弱,由此可見,CTL-exo可能通過抑制HBx的表達,從而抑制HSC活化。由此,本課題組在原肝纖維化“炎癥致病”學說的基礎(chǔ)上,進一步追溯到炎癥產(chǎn)生的源頭,提出了外泌體介導的跨細胞競爭機制假說:即感染HBV的肝細胞通過外泌體途徑跨細胞傳輸HBx等致病因子引起HSC活化,而CTL等免疫細胞亦可通過外泌體途徑傳輸抗cccDNA的免疫防御因子,抑制HSC活化。乙型肝炎肝纖維化是否啟動或進展決定于上述兩股力量“綜合競爭”的結(jié)果。本研究表明CTL可通過外泌體途徑下調(diào)HBx表達從而抑制HSC活化,為乙型肝炎肝纖維治療新途徑提供參考。
利益沖突聲明:本文不存在任何利益沖突。
作者貢獻聲明:覃川福負責實驗研究、數(shù)據(jù)分析、論文撰寫;趙雅麗負責實驗研究和數(shù)據(jù)分析;龍麗娟負責實驗研究及論文撰寫;邱華負責課題設(shè)計,數(shù)據(jù)分析,指導實驗和寫作。
- 臨床肝膽病雜志的其它文章
- 血液代謝標志物在原發(fā)性肝癌治療反應(yīng)及預后預測中的應(yīng)用
- 肝硬化再代償:現(xiàn)狀與挑戰(zhàn)
- 經(jīng)頸靜脈肝內(nèi)門體分流術(shù)中聯(lián)合側(cè)支血管栓塞治療肝硬化食管胃靜脈曲張出血的應(yīng)用進展與爭議
- 代謝相關(guān)脂肪性肝病與2型糖尿病的關(guān)系及共病機制研究進展
- Hepatology International|表達靶向HBV抗原的TCR-T細胞治療肝移植后復發(fā)的肝細胞癌患者具有良好的安全性和可行性:Ⅰ期臨床試驗結(jié)果
- 全胰切除聯(lián)合自體胰島細胞移植的研究進展

