不同稻蟹共作模式下寒區稻田土壤微生物的高通量測序研究
劉金雨,張瑞,羅亮,王世會,郭坤,白慶利,徐偉,趙志剛
(1.中國水產科學研究院黑龍江水產研究所,黑龍江省冷水性魚類種質資源及增養殖重點開放實驗室,黑龍江 哈爾濱 150070;2.上海海洋大學水產與生命學院,上海 201306)
稻漁綜合種養是將水稻種植和水產養殖相結合的復合農業生產方式[1],利用水稻與水生生物之間的互利共生關系,提升種養系統物質循壞和能量流動的效率[2]。目前,稻漁綜合種養已形成稻-魚、稻-蝦、稻-蟹、稻-鱉、稻-鰍等5 大類19 種典型模式[3],具有穩糧、促漁、提質、增效和可持續發展的特點[4,5]。全國稻蟹綜合種養面積占稻漁綜合種養總面積的4.97%,主要分布在北方地區[6]。黑龍江省作為我國水稻種植面積最大的省區之一,種植面積達400 多萬公頃,發展稻漁綜合種養潛力巨大,稻蟹綜合種養也是目前黑龍江省發展稻漁綜合種養的主要模式之一。
關于寒區稻蟹綜合種養目前多集中于通過機體生長、水質理化因子、浮游生物和底棲生物等參數來評價種植、施肥和投喂等技術層面的研究[7-11],缺乏種養系統土壤微生物評價等的基礎研究[12,13],尤其對寒區不同稻蟹共作模式下土壤微生物群落結構和多樣性研究尚未見報道。稻田土壤系統中的微生物是土壤物質循環的重要組成部分,在稻田系統中發揮著至關重要的作用[14,15]。水產動物的攝食、排泄等活動通過食物網影響稻漁綜合種養系統的物質循環和能量流動[16]。研究稻田土壤微生物群落組成和多樣性有助于明晰稻漁綜合種養的共作機制。細菌是微生物的主要組成部分,研究土壤細菌的群落結構和多樣性可以在一定程度上掌握土壤微生物的結構特征。土壤中大部分細菌因較難分離培養,傳統方法無法滿足土壤微生物群落結構的研究需要[17,18]。Illumina MiSeq 測序平臺高效準確的特點更適用于土壤微生物群落結構和多樣性的研究[19,20]。本研究采用高通量測序技術比較分析了寒區稻-蟹共作(RC)、稻-蟹-鰍共作(RCL)和水稻單作(CK)三種模式下表層土壤細菌(16S rDNA)的多樣性,探討稻-蟹共作和稻-蟹-鰍共作模式對水稻表層土壤微生物群落結構和多樣性的影響,為寒區稻蟹綜合種養模式的建立提供理論依據。
1 材料與方法
1.1 實驗設計
實驗在黑龍江省綏化市國家級稻漁綜合種養示范區進行。實驗田采用:稻田單作模式(CK)、稻蟹共作模式(RC)和稻-蟹-鰍共作模式(RCL),分別設3 個重復,共9 個單元,每個單元面積為300 m2,栽培管理方式一致。各單元內,在距離田埂0.6 m 處挖口寬0.5 m,底寬0.3 m,深0.4 m 的環溝,溝田比為10%。在各單元的外圍利用塑料布設高于地面0.4 m 的防逃墻。共作模式的水稻均采用大壟雙行,邊行加密的栽培模式,水稻單作組仍采用等間距的常規稻田種植方式,水稻品種為“綏粳4 號”。稻蟹模式放養河蟹(Eriocheir sinensis)體質量為(21.45±1.45)g,放養密度為500 ind./667 m2;稻-蟹-鰍模式,河蟹體質量為(21.45±1.45)g/ind.,放養密度為350 ind./667 m2,體質量為(0.47±0.07)g 泥鰍(Misgurnus anguillicaudatus)的放養密度為2 223 inds/667 m2。河蟹和泥鰍的放養時間分別為2020 年6 月25日和7 月5 日。養殖期間投喂配合飼料,每天投喂一次,投喂量為河蟹體體質量的2%~3%。河蟹和泥鰍于2020 年9 月10 日收獲,水稻于9 月20 日收割。施有機肥為基肥,化肥為提苗肥,實驗期間均不使用農藥。
1.2 土壤樣品采集和處理
2020 年9 月20 日分別在各單元的稻田中隨機選5 個點采集表層土壤樣品,混合為1 個樣品。樣品編號分別為CK_1、CK_2、CK_3、RC_1、RC_2、RC_3、RCL_1、RCL_2 和RCL_3。鮮土去除雜質混勻裝入50 mL 離心管后于-80 ℃冷凍保存,用于微生物多樣性分析。
1.3 土壤微生物DNA 提取與檢測
用試劑盒提取微生物基因組DNA,NanoDrop 2000 紫外-可見分光光度計檢測DNA 純度和濃度。基因組DNA 抽提后,用1%瓊脂糖凝膠電泳檢測DNA 完整性,PCR 預擴增檢測樣品。
1.4 PCR 擴增及高通量測序
采用通用引物338F(5'ACTCCTACGGGAGGGA GCA-3')[21]和806R(5'-GGACTCHV GGGTWTCTAAT-3')[22]擴增細菌16S rRNA 基因V3-V4 區,PCR 采 用TransGen AP221-02:TransStart Fastpfu DNA Pliymerase,PCR 儀為ABI GeneAmp9700 型。PCR 反應使用以下程序進行:95 ℃預變性120 s,95℃變性30 s,55 ℃退火30 s,72 ℃延伸30 s,持續25個循環周期,最后72 ℃延伸5 min,每個樣品3 個重復。使用AxyPrepDNA 凝膠回收試劑盒切膠回收PCR 產物,Tris_HCL 洗脫;利用2%瓊脂糖凝膠電泳檢測PCR 擴增效果,借助QuantiFluorTM-ST 藍色熒光定量系統對PCR 產物進行檢測定量。高通量測序采用Illumina 公司的Miseq 平臺,土壤微生物總DNA 提取和測序服務委托上海美吉生物醫藥科技公司完成。
1.5 生物信息分析
利用QIIME1.9.1 對原始DNA 序列進行過濾處理,去除嵌合體,嵌合體由uchime 確定,得到優化序列[23];利用UPARSE 7.1 軟件按照97%相似度將非重復序列進行聚類,得到OTU(Operational Taxonomic Unit)的代表序列,在此基礎上進行分類學分析,統計各個分類水平上樣品群落組成。
1.6 數據分析
實驗結果采用平均值±標準誤差(Mean±SE)表示,數據進行單因素方差(ANOVA)分析,并進行Duncan 氏多重比較,以P<0.05 作為差異顯著性標志。用Venn 圖統計多個樣本中所共有和獨有的物種數目。Alpha 多樣性分析包括Chao 指數、ACE 指數、Shannon 指數和Coverage 指數分析。Beta 多樣性分析通過未加權(Unweighted UniFrac)計算距離矩陣,根據得出的距離矩陣進行主坐標分析(PCoA)。通過土壤門和屬水平的細菌菌群結構,分析各模式的微生物組成。
2 結果與分析
2.1 DNA 測序數據和OTUs
由表1 可知,RC、RCL 和CK 組的9 個樣品中土壤細菌V3-V4 區測序獲得的平均序列數分別為69 561.33、65 007.00 和65 872.00;平均堿基數分別為28 977 495.33、27 084 291.33 和27 493 837.00;序列平均長度分別為416.57 bp、416.61 bp 和417.35 bp。以97%相似度劃分,共得到6 404 個OTUs,平均OTU 數分別為5 026、5 305 和4 969。用Coverage 反映測序深度,各組覆蓋率超過97.0%(表1)。用稀釋曲線來反映測序深度,稀釋曲線達到飽和平臺表明測序數據量合理,圖1 表示測序深度足以描述微生物多樣性。
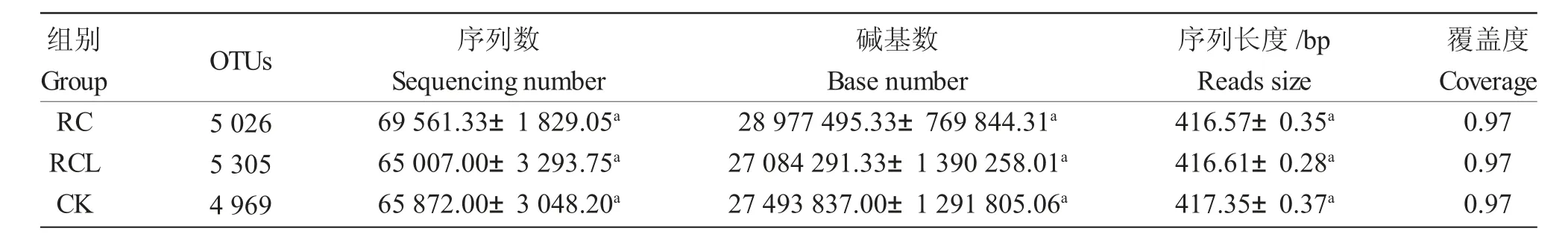
表1 不同模式下細菌高通量測序結果統計Tab.1 Illumina MiSeq sequencing results of the bacterial community in different modes
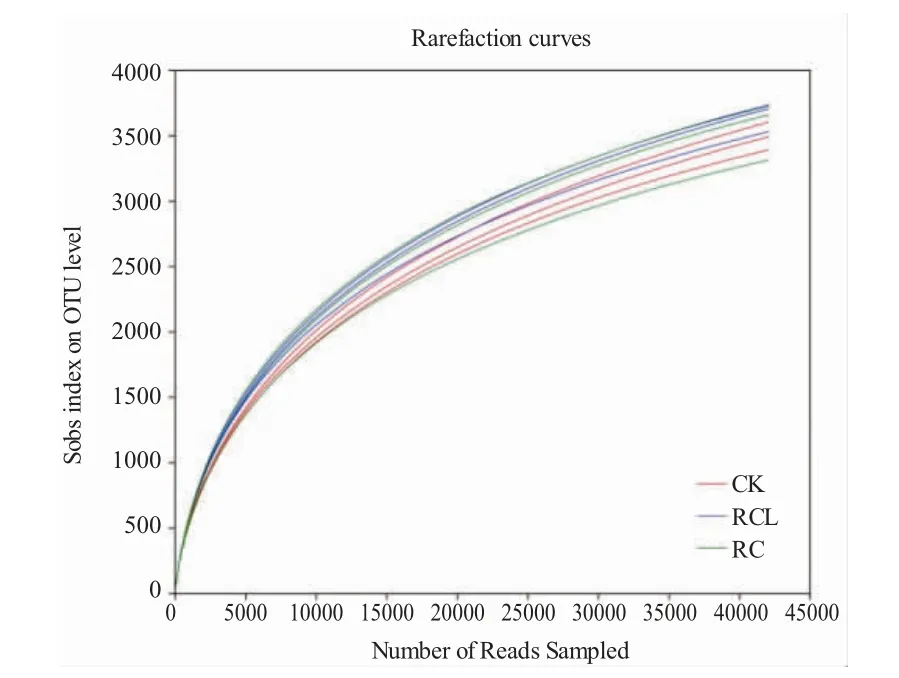
圖1 三種模式稻田土壤微生物的稀釋曲線Fig.1 Rarefaction curve analysis of microbial diversity in the paddy soils in three modes
Venn 圖評估不同組OTU 的相似性和重疊情況見圖2。圖2 中數字表示所在區域的OTU 數目。結果顯示:三種模式共有3 679 個OTUs,占總OTU 的57.45%,說明三種模式中的微生物種類較為相似。兩兩共享的OTU 中,RCL 和RC 共享數量最多,共有623 個,其次為RCL 和CK,共有550 個OTUs,最低的為CK 和RC,共有365 個OTUs。不同的OTU代表了不同的物種,特有的OTU 中,RCL 最高,為453 個,表示RCL 的特有物種最多;其次為CK,375個OTUs;RC 特有物種最少,為359 個OTUs。
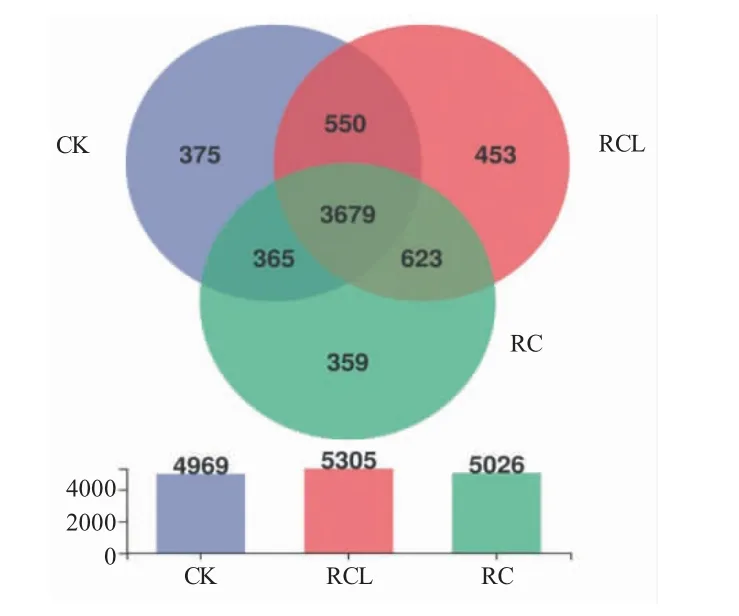
圖2 三種模式稻田土壤微生物的韋恩圖Fig.2 Venn diagram of microbial diversity in the paddy soils in three modes
2.2 多樣性指數
α 多樣性是指群落內部種的多樣性,常用指標包 括ACE 指數、Chao 指數、Shannon 指數以及Simpson 指數等。ACE 指數用來估算群落物種豐富度,Chao 指數用來估計群落中含OTU 數目的指數,ACE 指數和Chao 指數越大說明細菌群落豐度越高。Shannon 指數和Simpson 指數用來反映群落物種多樣性,Shannon 指數值越大或Simpson 指數越小,說明細菌群落多樣性越高。與CK 相比,RC 和RCL 模式土壤細菌的ACE 指數增加了0.13%和1.58%,Chao 指數增加了0.88%和2.79%,Shannon指數增加了1.54%和2.71%(表2)。方差分析結果表明,2 種共作模式的稻田土壤細菌群落豐度和多樣性均高于水稻單作,但差異并不顯著(P>0.05)。
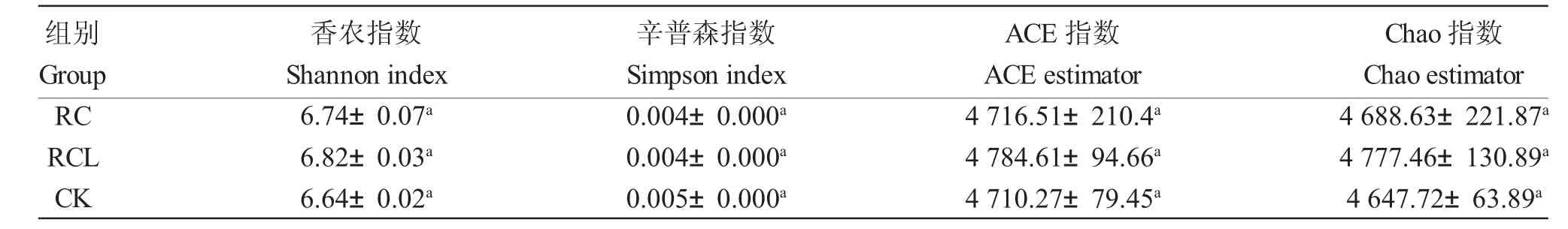
表2 不同模式下細菌群落多樣性指數Tab.2 Bacterial diversity index of microbial diversity in the paddy soils in three modes
β 多樣性表示的是微生物群落之間的差異。對三種模式下稻田土壤的OTU 進行PCoA 分析,第一主軸和第二主軸對細菌結構變異的貢獻率分別為56.97%和12.60%(圖3)。圖中每個點表示一個樣品,點之間的距離表示樣本間微生物群落結構的相似程度,距離越近越相似。PCoA 圖顯示RC 和RCL距離較近,同時二者與CK 的距離較遠,且出現顯著性差異(R=0.4239,P=0.045)。
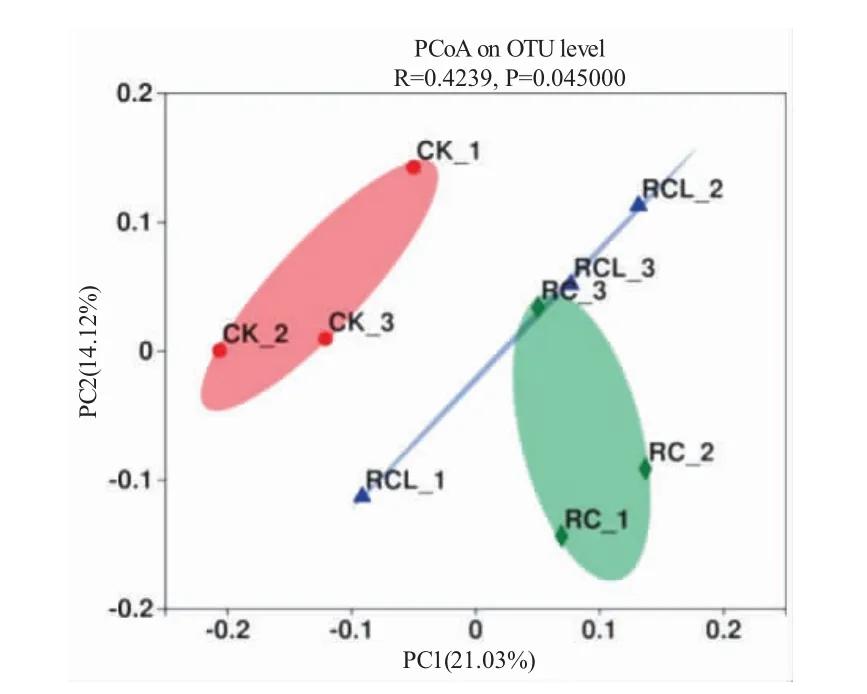
圖3 不同模式微生物群落的主坐標分析(PCoA)Fig.3 Principal coordinate analysis(PCoA)of microbial diversity in the paddy soils in three modes
2.3 細菌門水平分類
本次測序中,得到的所有序列均為細菌序列。9個稻田土壤樣品的6 404 個OTUs 分別屬于59 個門、181 個綱、397 個目、1 093 個屬、2 245 個種。圖4為門水平上的細菌分類,平均豐度低于1%的物種被合并為圖中的others。相對豐度大于5%的優勢菌門均為相同的7 個菌門,分別為放線菌門(Actinobacteria)、綠彎菌門(Chloroflexi)、變形菌門(Proteobacteria)、擬桿菌門(Bacteroidota)、酸桿菌門(Acidobacteria)、厚壁菌門(Firmicutes)以及脫硫桿菌門(Desulfobacterota)。上述菌門在三種模式中豐度不同,但均未出現顯著性差異(P>0.05)。CK 中相對豐度從高到低的菌門依次為:放線菌門(18.68%)、變形菌門(15.39%)、綠彎菌門(14.20%)、擬桿菌門(13.34%)、厚壁菌門(10.81%)、酸桿菌門(8.05%)以及脫硫桿菌門(7.68%)。RCL 相對豐度從高到低的菌門依次為:綠彎菌門(19.08%)、放線菌門(16.07%)、變形菌門(12.44%)、酸桿菌門(11.46%)、擬桿菌門(10.82%)、厚壁菌門(9.89%)和脫硫桿菌門(6.36%)。RC 相對豐度從高到低的菌門依次為:放線菌門(20.31%)、綠彎菌門(17.76%)、酸桿菌門(12.54%)、變形菌門(11.80%)、擬桿菌門(10.42%)、厚壁菌門(8.92%)和脫硫桿菌門(5.34%)。
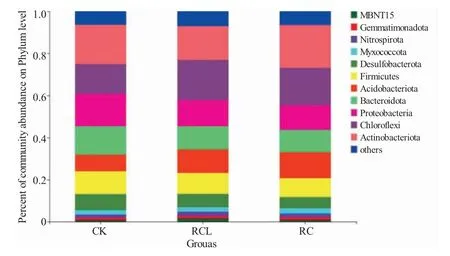
圖4 三種模式稻田土壤微生物在門水平的細菌物種組成Fig.4 Bacterial community composition in the paddy soils in three modes at the phylum level
2.4 細菌屬水平分類
如圖5 所示,熱圖顯示了三種模式在屬水平上微生物群落的相對豐度的差異。平均豐度低于1%的物種被合并為others,其在CK、RC 和RCL 中分別占59.17%、55.74%和57.62%。相對豐度>1%的優勢菌屬有22 個,其中一些屬沒有科學名稱,以norank 作為標記。CK 中相對豐度前五的優勢菌屬為稻田土壤菌屬(Oryzihumus,4.32%)、擬桿菌屬(norank_f_Bacteroidetes_vadinHA17,3.71%)、假節桿屬(Pseudarthrobacter,3.85%)、(norank_f_norank_o_SJA-15,3.57 %)和(norank_f_Lentimicrobiaceae,2.84%)。RC 中相對豐度前五的菌屬為稻田土壤菌屬(4.86%)、假節桿屬(4.08%)、(norank_f_ norank_o_norank_c_KD4-96,4.01%)、擬桿菌屬(3.86%)以及(norank_f_norank_o_RBG-13-54-9,2.44%)。RCL中相對豐度前五的菌屬分別為擬桿菌屬(4.02%)、(norank_f_norank_o_norank_c_KD4-96,3.97%)、(no rank_f_norank_o_RBG-13-54-9,2.96%)、稻田土壤菌屬(2.87%)以及假節桿屬(2.81%)。
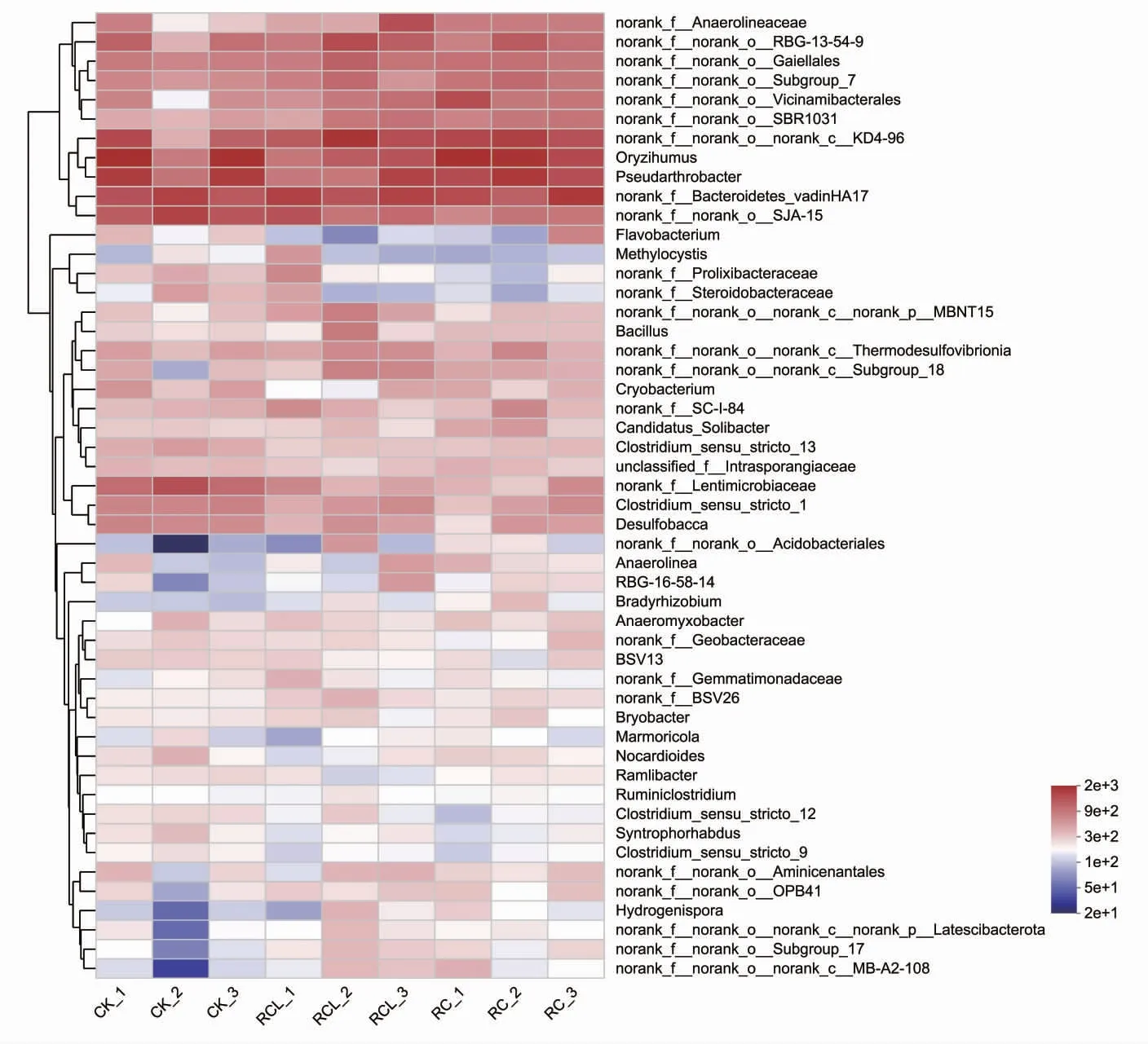
圖5 三種模式稻田土壤微生物在屬水平的豐度熱圖Fig.5 Heatmap of microbial diversity in the paddy soils in three modes at the phylum level
3 討論
3.1 不同稻蟹共作模式土壤的細菌多樣性
微生物多樣性指數是評價微生物群落豐富度和多樣性的綜合指標,較高的生物多樣性更能保證生態系統的穩定[24]。微生物的多樣性變化可直接或間接影響土壤肥力[25]。在稻漁綜合種養系統中,灌溉、施肥、栽培和共作方式均會影響土壤微生物[26,27],稻漁共作過程中養殖動物和飼料投喂水平也會造成土壤微生物多樣性的變化[28,29]。研究表明,水產動物與水稻共作可提升稻田土壤微生物的群落結構和多樣性[30-33]。本研究結果顯示,在寒區進行RC 和RCL 后的稻田土壤微生物多樣性指數均高于水稻單作,與上述結果一致,表明這兩種寒區稻蟹共作模式均提升了稻田土壤細菌群落的多樣性。同時,RCL 的Shannon 指數、ACE 指數和Chao 指數均高于RC,表明稻-蟹-鰍共作模式較稻-蟹模式更能提升稻田土壤微生物多樣性,在一定程度上揭示了稻-蟹-鰍共作模式下,土壤生態系統相對更為穩定。宋宇等[33]研究結果中的PCoA 圖顯示,稻蝦共作和稻蟹共作均與水稻單作的距離較遠,而兩種共作模式之間的距離較近,這與本實驗PCoA 分析圖中RC 和RCL 與CK 在不同區域聚類,RC 和RCL距離較近的結果相似。本實驗土壤微生物不同區域聚類表明稻蟹共作模式與水稻單作模式的稻田土壤微生物群落結構差異較大,而兩種稻蟹共作模式稻田土壤微生物的群落結構較為相近。稻蟹共作模式在種養過程中,其殘餌、糞便可為土壤微生物提供營養;河蟹和泥鰍的活動也對土壤產生擾動,增加土壤的通透性,這些因素均可能顯著影響稻蟹共作系統中稻田土壤微生物的組成和多樣性。
3.2 不同稻蟹共作模式土壤的細菌群落結構組成
高通量測序技術可檢測到更多豐度較低的微生物類群[34]。本研究中,3 種模式在97%的相似性下共獲得6 404 個OTUs,檢測到59 個門1 093 個屬的微生物種群。在門的分類水平上,三種模式的優勢菌門均為放線菌門、綠彎菌門、變形菌門、擬桿菌門、酸桿菌門、厚壁菌門及脫硫桿菌門。放線菌可加速土壤中動植物殘體的腐爛分解[35]。宋宇等[36]研究認為,稻蟹共作土壤放線菌的豐度較水稻單作增加了1.36%。本研究中,稻蟹模式土壤放線菌的豐度增加了1.63%,土壤放線菌豐富度的增加有助于加速稻田土壤系統的物質循環進程。變形菌門大多為革蘭氏陰性菌,其中大部分細菌均具有固氮能力[37]。成永旭等[38]研究表明,稻蟹共作模式土壤細菌相對豐度最高的菌門為變形菌門。羅衡等[39]對稻鱉共作模式土壤微生物的研究也認為,土壤微生物以變形菌門為主導。本研究在寒區稻蟹共作模式中也得到了相似的結果。稻魚共作土壤系統中綠彎菌門豐度大幅上升,成為優勢菌門[30]。本實驗稻蟹共作模式也有效提升了土壤綠彎菌門的相對豐度,可能因共作模式稻田水淹程度較大,土壤中形成的微厭氧環境適宜該菌的生長。擬桿菌門、酸桿菌門、厚壁菌門及脫硫桿菌門均為稻田常見的細菌類群[40]。本研究在寒區兩種稻蟹共作模式和水稻單作模式中也分別監測到了這些菌群。稻蟹共作模式中,宋宇等[33]檢測的土壤細菌優勢菌門與本實驗相似,而在屬分類水平上差異較大,前者優勢屬菌為藍藻屬(norank_c_Cyarbacteria)、硫曲菌屬(Sulfuricurvum)和厭氧繩菌屬(norank_f_Anaerolineareae),而本研究中的優勢菌屬分別為稻田土壤菌屬、假節桿屬、norank_f_norank_o_norank_c_KD4-96、擬桿菌屬和norank_f_norank_o_RBG-13-54-9,主要原因可能是不同實驗地點的氣候環境差異所致。本研究在土壤主要優勢菌屬中,對比水稻單作,稻-蟹共作和稻-蟹-鰍共作土壤中的norank_f_norank_o_no-rank_c_KD4-96、擬桿菌屬和norank_f_norank_o_RBG-13-54-9 的相對豐度均有所增加,可能因兩種稻蟹共作模式中殘餌、糞便提升了稻田土壤系統的肥力,在一定程度上為上述細菌類群提供了更為適宜的生長環境。
3.3 結論
本研究中,寒區“稻-蟹”和“稻-蟹-鰍”兩種共作模式下稻田土壤細菌群落結構和多樣性結果表明,與水稻單作相比,稻蟹共作模式和稻-蟹-鰍共作模式均能改變稻田土壤的細菌群落結構,增加稻田土壤細菌群落的豐富度和多樣性。

